胆碱氨基酸离子液体水溶液在288.15~323.15 K 的传输性质
2022-03-03周宁宁殷天翔
周宁宁, 殷天翔
(华东理工大学化学与分子工程学院,上海 200237)
离子液体(ILs)通常被定义为100 ℃以下的液态盐,是一种具有独特特性的可设计溶剂,如液态范围宽、蒸汽压低、热稳定性和化学稳定性高以及良好的溶剂化行为等[1]。离子液体在萃取分离工艺、CO2捕集、催化、传感器、生物质加工、制药工业等不同领域都有广泛的研究和应用报道[2-10]。离子液体在早期被普遍认为是毒性低、生物降解性好的绿色溶剂。然而,进一步的研究表明,一些含有咪唑基阳离子或卤化物的离子液体表现出的毒性远远高于一些常用的有机溶剂[11-13]。因此,从自然生物材料中开发新型离子液体已成为离子液体进一步应用的重要课题。
文献[14]首次合成了以1-乙基-3-甲基咪唑为阳离子的氨基酸基离子液体,其毒性小,生物降解性好。此外,胆碱是一种无毒、可生物降解的材料,可被用来取代咪唑阳离子[15-17],合成出一种胆碱氨基酸基离子液体(CHAAILs),该离子液体对各种细胞[18]几乎无毒,被认为是真正的绿色化学品[19]。学术界对CHAAILs 的理化性质和结构进行了实验和理论研究[17,20-23],认为羧酸盐和羟基之间的稳定的离子对可以促使强氢键的形成。此外,CHAAILs 已被成功地用作增强药物溶解性能的绿色功能辅料,以及酶合成的反应介质、生物传感器、催化剂、提取分离剂、CO2吸附剂等[24-29]。
黏度和电导率作为传输性质是离子液体工业化的重要物理化学数据,对质量传递速率至关重要,但纯离子液体的高黏度和低电导率往往成为实际应用的障碍。离子液体与传统溶剂混合是构造具有理想物理化学性质的新型液体的有效方法,这种新型液体的性质可以通过简单地改变其组分来控制,它扩大了离子液体的潜在应用范围,但这建立在对离子液体混合物的物理化学性质有更深入和广泛了解的基础上。耿彦芳等[30]测定了咪唑离子液体与乙醇胺复配形成的二元混合物的黏度、电导率以及体系的超额黏度和摩尔电导率等物理化学性质,此低黏度的混合物可用于CO2的吸收。徐金乔等[31]研究了以脯氨酸为阴离子,以咪唑基为阳离子的一系列氨基酸离子液体的水溶液在298.15~323.15K的密度,探讨了温度对超额摩尔体积的影响。水是最常用的共溶剂,CHAAILs 与水的混合物已被应用于生物质加工和提取等领域[32-34]。然而,关于CHAAILs 水溶液的理化性质的研究却很少[35-37]。本文合成了两种分别以甘氨酸(Gly)和L-丙氨酸(L-Ala)为基础的CHAAILs,测定了这两种CHAAILs 及其水溶液的黏度和电导率等传输性质,对CHAAILs 的设计、合成和将CHAAILs 作为具有良好流动性的溶剂有着极其重要的指导意义,并有助于揭示CHAAILs 作为功能型添加剂在助溶及促渗等方面的应用[38-39]。
1 实验部分
1.1 实验原料
胆碱氢氧化物(Cho),w=44%;甘氨酸,w≥99%;L-丙氨酸,w≥99%。上述原料均购自上海阿拉丁有限公司。水采用超纯水系统(DZG-303A),上海砾鼎水处理有限公司。
1.2 离子液体的合成
胆碱甘氨酸离子液体([Ch][Gly])和胆碱丙氨酸离子液体([Ch][Ala])采用相同的合成过程[15-17]。具体操作如下:用量筒量取一定体积的胆碱溶液,用试管逐滴加入氨基酸水溶液(胆碱与氨基酸的物质的量之比为1.00∶1.01)中,边滴加边在0~5 ℃的水浴锅中搅拌。将混合后的胆碱氨基酸水溶液在水浴温度0~5 ℃的条件下连续搅拌24 h。在50 ℃下,通过旋转蒸发除去混合物中的残余水分,得到一种淡黄色液体的粗产品。将乙腈和甲醇(体积比7∶3)的混合物加入粗产品中,此混合液置于烧杯中磁力搅拌12 h,反应后剩余的氨基酸固体被沉淀出来,通过抽滤被过滤掉。重复该过程3 次。将上述滤液在50 ℃时通过旋转蒸发仪除去乙腈和甲醇的混合溶剂,得到黏稠的黄色液体。将产物用P2O5粉末在60 ℃真空条件下干燥48 h,以进一步去除残留水分。
1.3 离子液体的表征
使用Karl-Fisher 水分仪采用库仑法对上述合成的两种离子液体的水含量进行测定,显示其水含量均小于0.2%(质量分数)。采用德国ELEMENTAR VARIO El Ⅲ型元素分析仪对产物进行元素分析。[Ch][Gly] 的 计 算 值 为: C 47.17%, N 15.72%, H 10.18%;实验值为:C 47.21%,N 15.65%,H 10.21%。[Ch][Ala] 的 计 算 值 为: C 49.98%, N 14.57%, H 10.49%;实验值为:C 49.90%,N 14.50%,H 10.53%。使用瑞士布鲁克公司AVANCE Ⅲ 400 型核磁共振仪对两种CHAAILs 进行测定,其1H-NMR 和13C-NMR表征结果分别如图1 和图2 所示,没有发现明显杂质峰,说明所得目标产物为[Ch][Gly]和[Ch][Ala]。

图1 [Ch][Gly] (a) 和 [Ch][Ala] (b) 的1H-NMR 谱图(400 MHz, D2O)Fig. 1 1H-NMR spectra for [Ch][Gly] (a) and [Ch][Ala] (b) (400 MHz, D2O)

图2 [Ch][Gly] (a) 和 [Ch][Ala] (b) 的13C-NMR 谱图(400 MHz, D2O)Fig. 2 13C-NMR spectra for [Ch][Gly] (a) and [Ch][Ala] (b) (400 MHz, D2O)
1.4 传输性质的测定
采用重量法配制离子液体全浓度范围(即离子液 体 摩 尔 分 数x为0~1.0000)内 的[Ch][Gly] +H2O和[Ch][Ala] +H2O 的二元混合物。电子分析天平的精确度为0.1 mg,配制后立即塞上瓶塞,密封,放在磁力搅拌器上搅拌约12 h,直至混合均匀。使用数字式电导率仪(DDSJ-307 型,上海雷磁公司)进行电导率测定,使用前用浓度为0.01 mol/L 的标准KCl 溶液进行校准。校准后电导率测定的相对误差约为0.5%。二元混合物的黏度使用数字式旋转黏度计(上海衡平公司,SNB-2 型)测定,总相对误差小于8%。所有测定均在不同温度下进行,温度准确度约为0.1 K。
2 结果和讨论
2.1 二元混合物的黏度和超额黏度
不同摩尔分数、不同温度下的CHAAILs+H2O混合物的黏度(η)和超额黏度(Δη)值列于表1 和表2。

表1 不同摩尔分数离子液体的[Ch][Gly] +H2O 二元混合物溶液在 288.15~323.15 K 的黏度和超额黏度Table 1 Viscosities and excess viscosities of binary mixtures [Ch][Gly] + H2O with various mole fractions of [Ch][Gly] at 288.15—323.15 K1) (mPa·s)
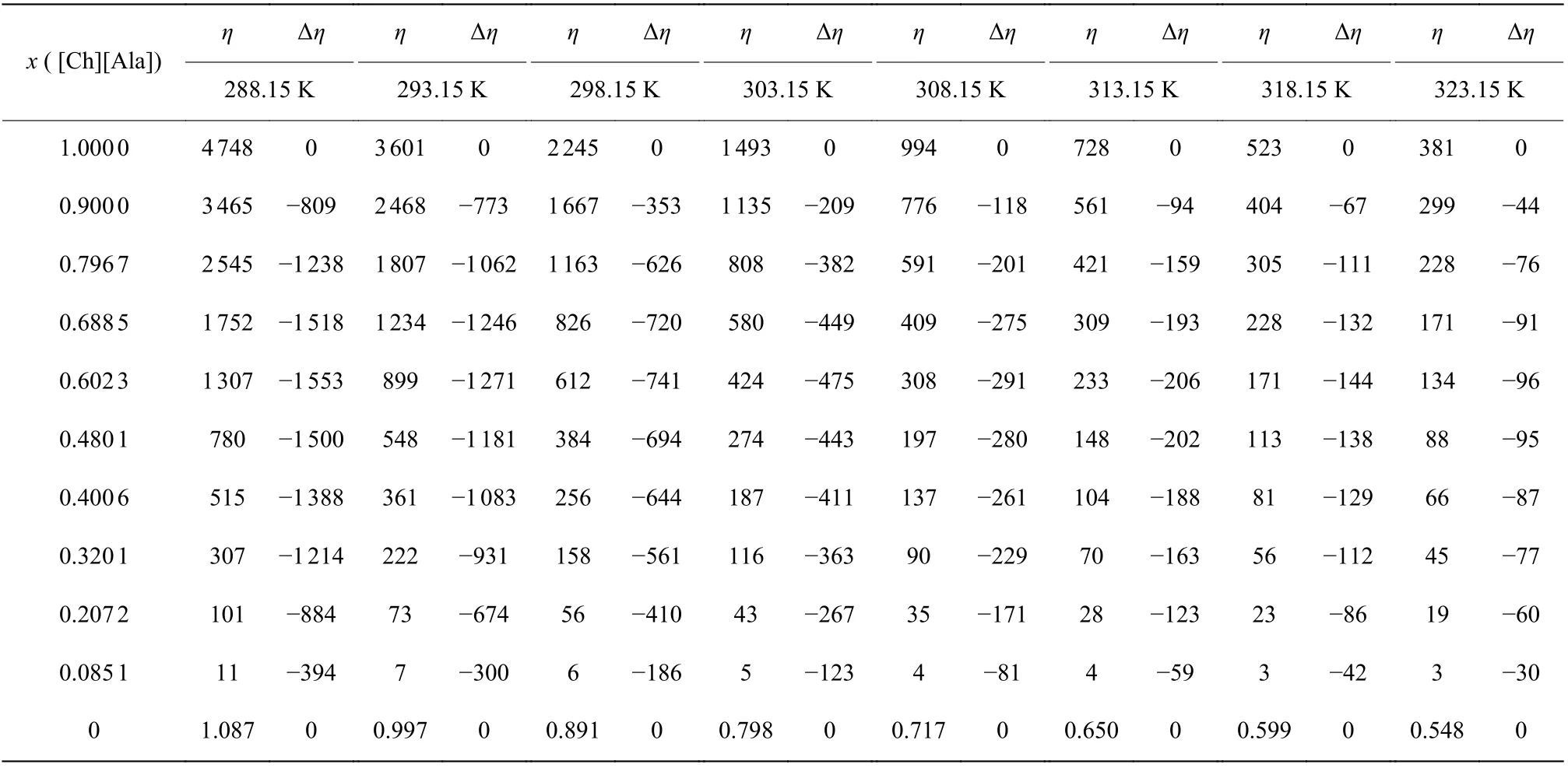
表2 不同摩尔分数离子液体的[Ch][Ala]+H2O 二元混合物溶液在 288.15~323.15 K 的黏度和超额黏度Table 2 Viscosities and excess viscosities of binary mixtures [Ch][Ala] + H2O with various mole fractions of [Ch][Ala] at 288.15—323.15 K1) (mPa·s)
图3 所示为[Ch][Gly]+H2O 和[Ch][Ala]+H2O 两种离子液体混合物的全浓度范围内黏度随温度的变化趋势,可以看出两者是相似的,即黏度随温度升高而降低,当离子液体摩尔分数较高时,混合物的此性质表现得更为明显。

图3 不同摩尔分数离子液体的CHAAILs+H2O 二元混合物溶液在288.15~323.15 K 的黏度Fig. 3 Viscosities of CHAAILs+H2O binary mixtures with various mole fractions of ILs at 288.15—323.15 K
黏度与温度的依赖关系可以用Arrhenius 方程来描述,如式(1)所示:

式中:T为温度,单位K;a、b为可调整参数。通过Arrhenius方程拟合实验值,得到可调整参数的值及方程的拟合偏差(SD,见表3)。SD的计算公式如下:

表3 Arrhenius 方程中不同摩尔分数离子液体的CHAAILs+H2O 混合物黏度的可调整参数a,b 和拟合偏差( 288.15~323.15 K)Table 3 Adjustable parameters a and b for viscosities and SD of CHAAILs+H2O binary mixtures at different mole fractions of ILs by Arrhenius equation ( 288.15—323.15 K)
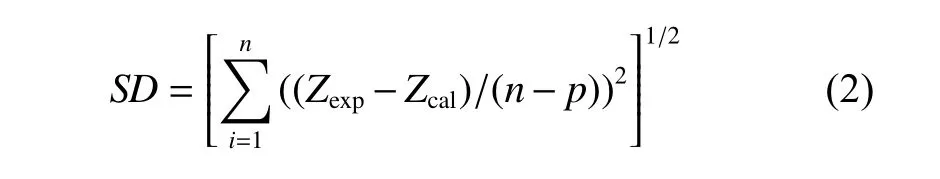
其中:Z指Δη;Zexp和Zcal分别为实验值和拟合计算值;n和p分别为实验数据点和拟合参数的个数。拟合计算值的结果如图4 中实线所示。可见实验值与拟合计算值吻合良好。

图4 CHAAILs+H2O 二元体系的黏度实验值与Arrhenius 方程计算值(实线)的比较Fig. 4 Comparison of the experimental (spot) with calculated values (solid lines) by the Arrhenius equation of viscosities of the CHAAILs+H2O binary systems
根据不同摩尔分数离子液体的[Ch][Gly] +H2O和[Ch][Ala] +H2O 二元混合物溶液的实验黏度值,由式(3)计算出超额黏度:

其中:x为组分摩尔分数,下标1 和2 分别表示离子液体和水。在T为288.15~323.15 K 范围内,超额黏度经Redlich-Kister 多项式拟合:

其中:Ai(i为 0,1,2,3)为可调整参数;n为多项式级数。对于本实验,在误差范围内n=3 已足够描述黏度偏差随组成的变化。各温度下的可调整参数Ai和SD列于表4 中。结果表明,[Ch][Gly] +H2O 和[Ch][Ala]+H2O 二元混合物在温度288.15~323.15 K范围内的4 个可调整参数A0、A1、A2、A3和Redlich - Kister 方程拟合值吻合良好。

表4 Redlich-Kister 方程中CHAAILs+H2O 二元体系分别在 288.15~323.15 K 下的可调整参数Ai 和超额黏度的拟合偏差Table 4 Adjustable parameters Ai and SD of excess viscosities for CHAAILs+H2O binary mixtures by Redlich-Kister equation at 288.15—323.15 K
图5 所示为实验得到的超额黏度值和Redlich-Kister 方程的拟合结果,可见两者吻合较好。此外,这两种离子液体与水形成的混合物都与理想值有负偏差,这种偏差随着温度的升高而减小。比较这两种离子液体的混合物时, [Ch][Ala]+H2O 表现出更大的偏差。
当水加入到离子液体中时,黏度急剧下降。这一现象说明溶剂的加入对于黏度的改善有着极其显著的作用。水和离子液体阴离子之间形成了氢键作用, 减弱了离子液体阴阳离子之间的离子键作用, 导致超额黏度呈现负偏差[40]。此外,由于离子液体的黏度远大于溶剂的黏度,黏度随着溶剂含量的增加而迅速降低,当混合体系的实际黏度远小于理想体系的黏度时,会导致整体呈负偏差。如图5 所示,随着温度的升高,溶液的流动性增大,超额黏度下降的幅度逐渐减小。这说明分子间的运动与温度有直接的联系,即随着实验温度的升高,热运动逐渐加剧,体系趋于向理想溶液体系的行为改变[41-42]。 由图5可见,在全浓度的范围内,二元混合体系超额黏度的变化呈现U 形,在x= 0.6 左右时有一个极值。|Δη|按照离子液体阴离子烷基链降低而减小的顺序为[Ch][Ala]> [Ch][Gly]。

图5 CHAAILs+H2O 二元混合物在不同温度下的超额黏度Fig. 5 Excess viscosities of CHAAILs+H2O binary mixtures at various temperatures
2.2 二元混合物的电导率(κ)和摩尔电导率(Λ)
不同摩尔分数、不同温度下[Ch][Gly] +H2O 和[Ch][Ala] +H2O 混合物的电导率列于表5。摩尔电导率随离子液体浓度的变化如图6 所示。
从图6 可以看出,离子液体二元混合物的摩尔电导率与传统电解质的电导率具有相似的浓度依赖性,即随着离子液体浓度的增加,摩尔电导率降低。黏度与摩尔电导率的关系可以用Walden 规则表示:
图6 CHAAILs+H2O 二元混合物摩尔电导率随离子液体浓度的变化Fig. 6 Mole conductivity as a function of concentration of ILs for CHAAILs+H2O binary mixtures

其中:K为常数。 [Ch][Gly] +H2O 和 [Ch][Ala] +H2O二元混合物中lgΛ和lgη−1的关系如图7 所示。由于0.01 mol/L KCl 水溶液是完全解离的,因此以其黏度和摩尔电导率的关系作为理想线,用以模拟无相互作用的离子液体的电导率和流动性形态。由图7可知,在该理想曲线以下,溶液的离子性均不太理想,并且随着与理想曲线的距离的变大而逐渐变差[42-43]。由此可以推测,[Ch][Ala]在水中的离子化程度比[Ch][Gly]大。

图7 不同温度下CHAAILs+H2O 二元混合物的lg Λ 和 lg η−1 之间的关系Fig. 7 Relationships of lg Λ and lg η−1 of CHAAILs+H2O binary mixtures at different temperatures
此外,从表5 还可以看出,电导率随着温度的升高而升高,这可以用Vogel-Fulcher-Tamman (VFT)方程来描述:

表5 CHAAILs+H2O 二元混合物在不同温度下的电导率Table 5 Electrical conductivities of CHAAILs+ H2O binary mixtures at different temperatures 1)

其中:κ0、A4和T0是拟合参数。
采用最小二乘拟合方法的线性回归分析估计拟合参数,并与标准偏差一起列于表6,电导率拟合结果与实验结果如图8 所示。

图8 CHAAILs+H2O 二元混合物电导率VFT 方程的拟合曲线Fig. 8 Electrical conductivities by VFT equation of the CHAAILs+H2O binary mixtures

表6 离子液体不同摩尔分数下CHAAILs+H2O 二元混合物电导率的VFT 方程拟合参数Table 6 Fitting parameters by VFT equation of conductivity for CHAAILs+H2O binary mixtures with different molar fractions of ILs
3 结 论
(1)以胆碱氢氧化物和氨基酸为原料, 通过酸碱中和反应得到了CHAAILs, 并对其结构进行了表征,表征结果与目标产物结构相符。
(2)测定了两种CHAAILs 在 288.15~323.15 K 范围内水溶液的黏度和电导率,结果表明黏度和电导率随温度的变化可以分别用Arrhenius 方程和VFT 方程来描述,CHAAILs +H2O 二元混合物的黏度随温度升高而降低,电导率随温度升高而升高。
(3)采用 Redlich-Kister 方程对溶液的超额性质进行了关联。 离子液体水溶液的黏度主要受离子液体与水之间形成的氢键作用的影响,显示出了明显的负偏差。离子液体摩尔电导率和黏度之间的关系用Walden 曲线进行了关联,结果显示[Ch][Ala] +H2O的二元体系具有较高的离子化程度。
