鸭源绿色气球菌的分离鉴定及16S rRNA基因序列测定与遗传进化分析
2022-03-03乔宏兴张立恒宋予震边传周赵俊强
乔宏兴,丁 勇,张立恒,宋予震,董 青,边传周,赵俊强
(1.河南牧业经济学院动物医药学院,郑州 450046;2.河南省动物肠道疫病国际联合实验室,郑州 450046;3.河南农业大学动物医学院,郑州 450002;4.河南融瑞祥制药有限公司,商丘 476200)
绿色气球菌(Aerococcusviridans)属于链球菌科(Streptococcaceeae)气球菌属(Aerococcus),是气球菌属的典型代表,最早于1953年由Williams等发现并命名[1],目前已确定的气球菌属包括绿色气球菌、脲气球菌、人脲气球菌、血气球菌、柯氏气球菌、马脲气球菌和阴道气球菌7个不同种[2]。绿色气球菌是革兰氏阳性、微需氧和非运动性的细菌,该菌是一种人畜共患条件性致病菌,广泛存在于自然界中,如空气、尘埃、动物和人体中[3-5],在人医领域被广泛研究,该菌正常情况下潜伏于机体内,当机体免疫免疫力下降或免疫功能不健全时,可引发菌血症、败血症、脑膜炎、心内膜炎及脓毒性关节炎等疾病[6-8],但也有报道称机体在正常情况下感染绿色气球菌并发病,引起社会广泛关注。在动物医学领域,有关绿色气球菌的报道较少,目前已在猪[9]、羊[10]、牛[11]、鼠[13]、罗非鱼[14]及虾蟹[15-17]等动物体内分离得到绿色气球菌,但国内外鲜有鸭源绿色气球菌的报道。
2020年7月,河南省某鸭场出现鸭死亡,病鸭精神不振,食欲废绝,眼鼻流出浆液性分泌物,粪便稀薄呈绿色或黄绿色。病鸭常有共济失调、抽搐等神经症状。剖解发现病变主要为肝周炎,疑为鸭传染性浆膜炎,按照鸭传染性浆膜炎治疗未见明显效果。本研究采集病料,利用鲜血琼脂分离病原菌,经形态学观察、生化反应、药敏试验和16S rRNA基因鉴定,以期为鸭源绿色气球菌病后期研究提供科学依据。
1 材料与方法
1.1 病料
2020年7月于河南某鸭场采集4周龄患病鸭肝脏和脾脏。
1.2 主要试剂
TSB培养基、鲜血琼脂培养基和生化鉴定管均购自青岛海博生物有限公司;营养琼脂培养基购自北京奥博星生物技术有限公司;药敏纸片购自北京天明药物有限公司;胎牛血清购自兰杰柯科技有限公司。
1.3 试验动物
25只18~22 g清洁级雄性昆明小鼠购自河南牧业经济学院实验动物中心。
1.4 细菌分离纯化
无菌采集病死鸭的肝脏和脾脏,划线涂布于营养琼脂平板,37 ℃恒温培养箱内培养24 h后观察菌落性状,分别取单个菌落进行革兰氏染色镜检,用接种环划线接种于血平板,37 ℃恒温培养24 h,观察菌落形态。
1.5 生化鉴定
将分离纯化的菌落接种于TSB培养基,在37 ℃恒温振荡器内振荡培养24 h;取菌液接种于生化鉴定管,37 ℃培养24~96 h,对比结果判定表观察并记录结果。
1.6 16S rRNA鉴定
取纯化后菌种送上海派森诺生物公司测序,采用通用引物27F:5′-AGAGTTTGATCCTGG-CTCAG-3′;1492R:5′-CTACGGCTACCTTGTTA-CGA-3′,预期扩增片段大小为1 324 bp。引物由上海派森诺生物科技股份有限公司合成。PCR反应体系50 μL:基因组DNA(20 ng/μL)1 μL,10×Buffer(含2.5 mmol/L Mg2+)5 μL,Taq聚合酶(5 U/μL) 1 μL,dNTPs (10 mmol/L) 1 μL,上、下游引物各1.5 μL,ddH2O 39 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,共35个循环;72 ℃延伸7 min。反应完成后,取3 μL PCR产物进行1.0%琼脂糖凝胶电泳检测。用NCBI BLAST程序将拼接后的序列与NCBI 数据库中的数据进行比对,得到与待测物种序列相似性最大的物种信息,即为鉴定结果。将测序结果与NCBI数据库中的菌株进行比对分析,利用Mega 7.0软件构建系统进化树。参考菌株信息见表1。
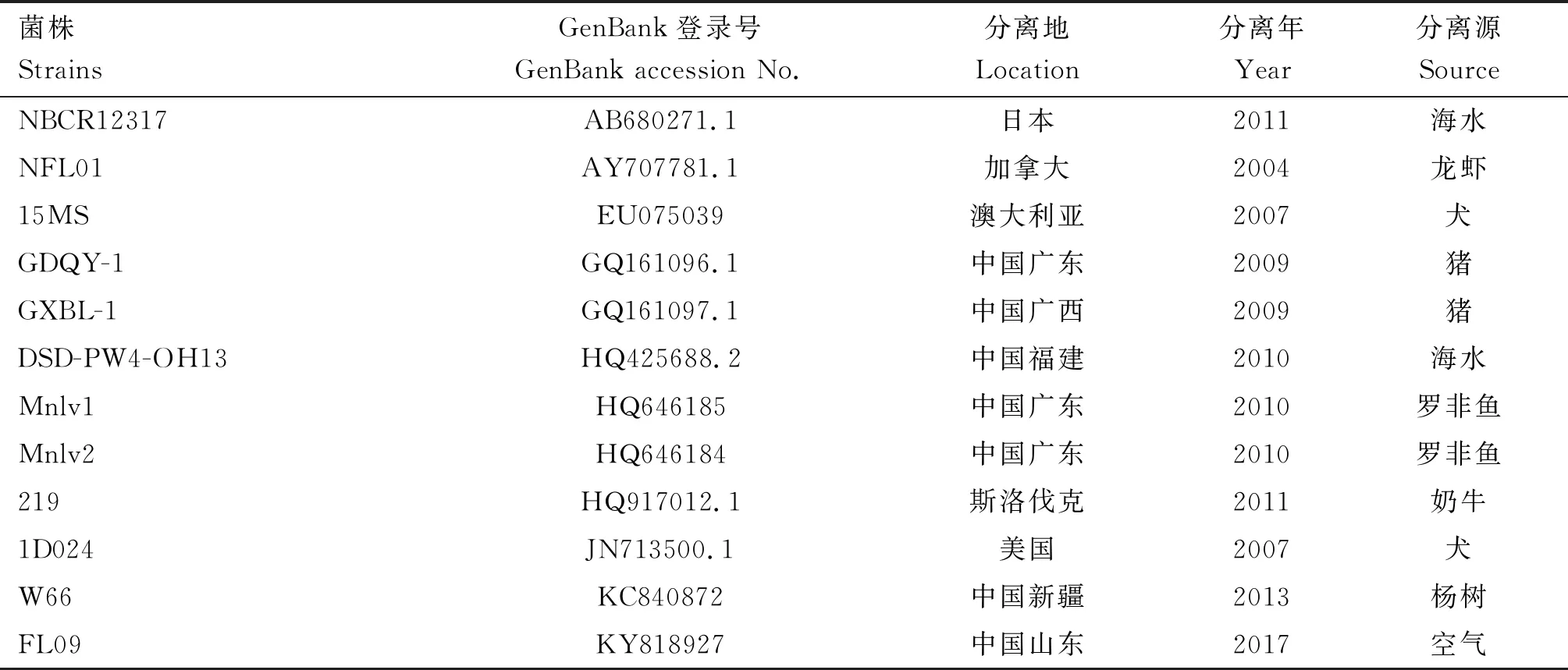
表1 参考菌株信息
1.7 致病性试验
取培养好的分离菌菌落,接种于TSB液体培养基(含5%胎牛血清)中,37 ℃振荡培养24 h,利用平板计数法将菌液浓度调整为5×109CFU/mL,10倍倍比稀释为5×109、5×108、5×107和5×106CFU/mL 4个浓度。试验分5组,每组5只小鼠。对照组腹腔注射0.5 mL无菌TSB液体培养基;试验Ⅰ、Ⅱ、Ⅲ、Ⅳ组分别腹腔注射0.5 mL 5×106、5×107、5×108和5×109CFU/mL分离菌。注射后连续观察7 d,每隔6 h观察并记录小鼠发病表现、死亡数量。对死亡小鼠病变脏器进行细菌分离鉴定,根据试验各组小鼠死亡数量,采用改良寇氏法计算分离菌株的半数致死量(LD50)。
1.8 药敏试验
取纯化菌种于TSB液体培养基中,37 ℃培养24 h,调整菌液浓度为0.5麦氏浊度,取0.5 mL菌液于血平板,用玻棒涂布均匀,取药敏纸片贴在血平板上,37 ℃恒温培养24 h后,使用游标卡尺测量抑菌圈直径(inhibition zone diameter,IZD),并按照药敏纸片说明书的抑菌范围注释标准对细菌的药物敏感性进行判断。
2 结 果
2.1 细菌分离培养
分离菌在鲜血平板上呈乳白色菌落,表面光滑凸起,边缘整齐圆润,较小(图1)。显微镜下观察为革兰氏阳性菌,呈二联或四联排列(图2)。将分离菌命名为Y4。
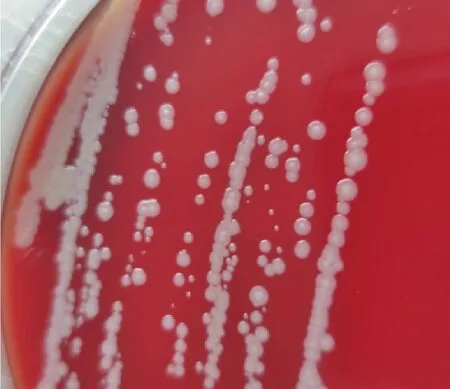
图1 分离菌形态观察
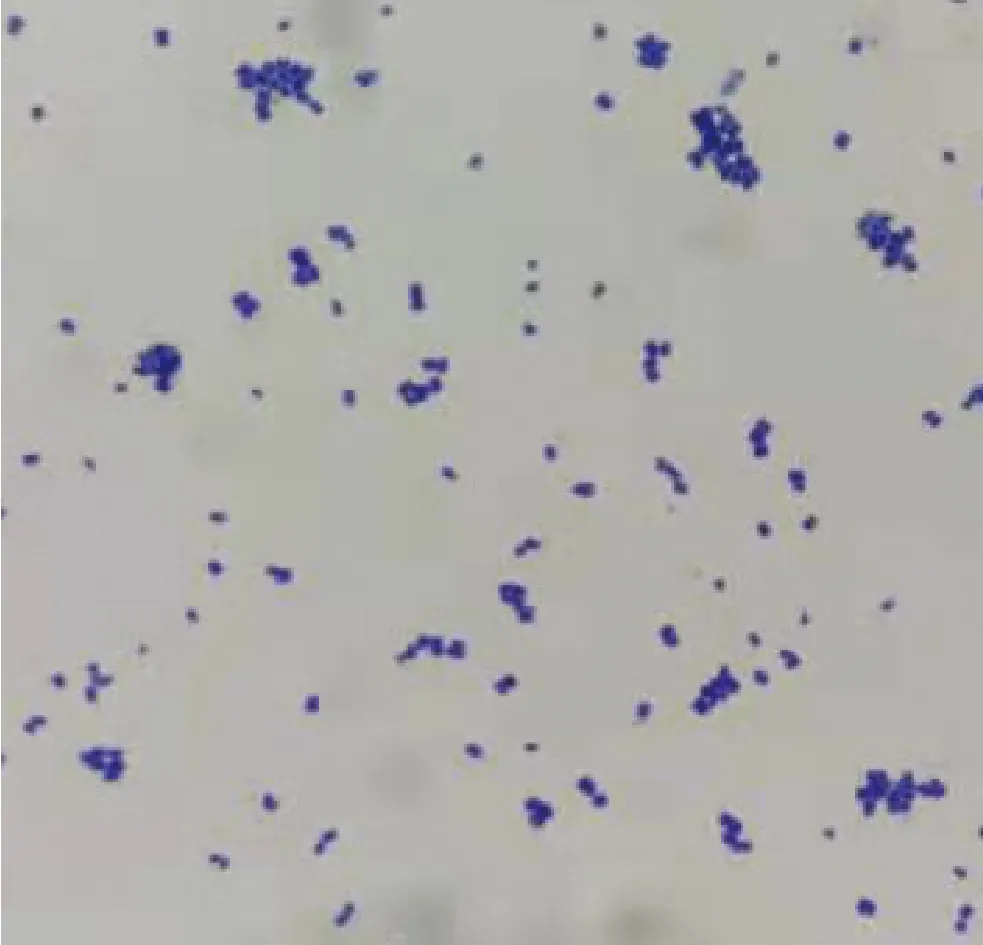
图2 分离菌革兰氏染色镜检图(1 000×)
2.2 生化特性
将疑似菌落进行生化特性鉴定,结果见表2。由表2可知,分离菌能发酵麦芽糖、蔗糖和棉籽糖,不能发酵木糖、乳糖、葡萄糖、山梨醇和甘露醇;硝酸盐还原试验、MP-VP试验呈阳性,甲基红试验呈阴性;与尿素、七叶苷发生反应,不能与硫化氢、苯丙氨酸发生反应;不能利用枸橼酸盐;与赖氨酸脱羧酶、鸟氨酸脱羧酶接触试验均为阳性,与氨基酸脱羧酶接触试验不发生反应。
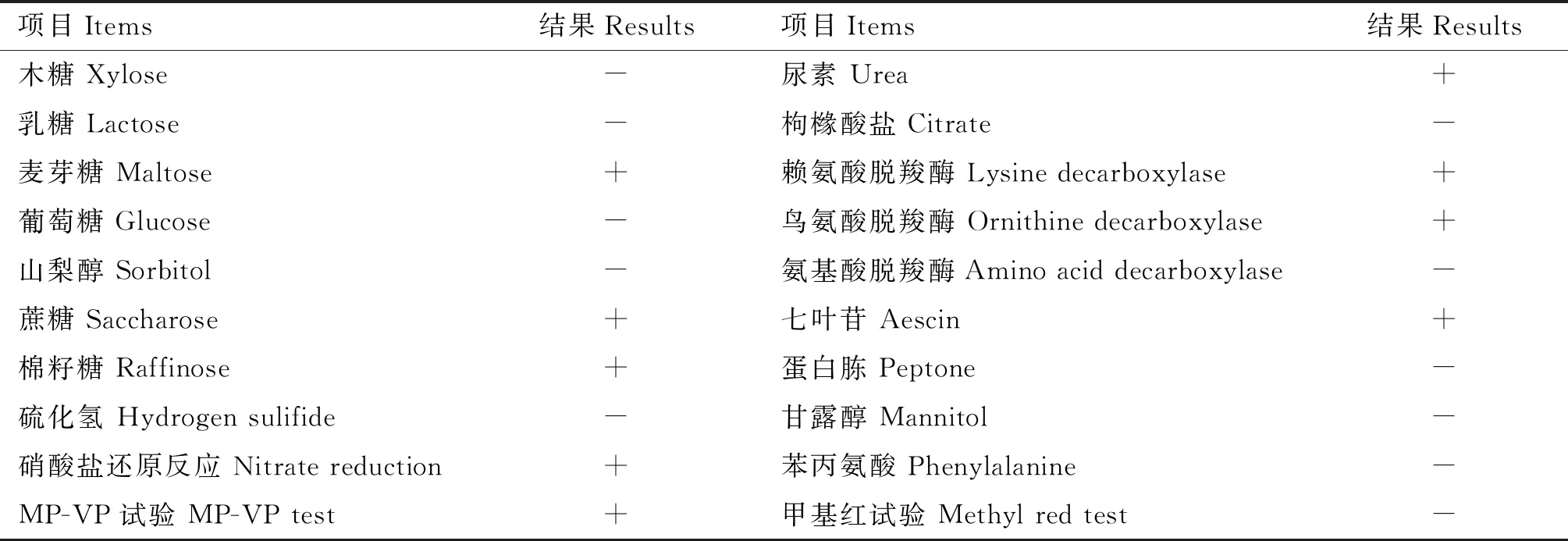
表2 分离菌生化鉴定结果
2.3 16S rRNA鉴定结果
将分离菌纯化后送上海派森诺生物公司测序,结果表明,该菌核苷酸序列全长为1 324 bp,16S rRNA基因PCR扩增结果与测序结果一致(图3)。由图4可知,分离菌与12株分离自猪、犬、奶牛、罗非鱼、龙虾、海水和空气等的绿色气球菌核苷酸相似性在94.8%以上;与菌株NFL01、Mnlv1、Mnlv2、W66和FL09相似性最高,达99.9%;与菌株1D024和219的核苷酸相似性分别为99.6%和99.5%;与菌株GXBL-1核苷酸相似性最低,为94.8%。
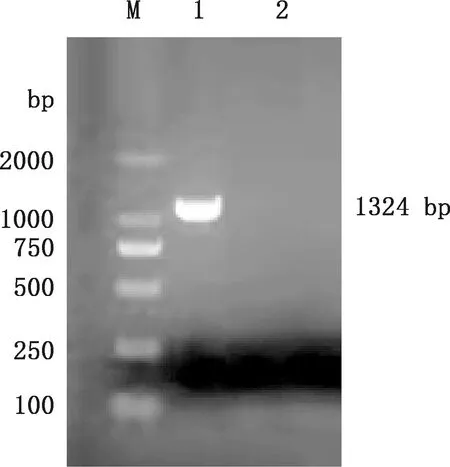
M,DL2000 DNA Marker;1,分离菌;2,阴性对照
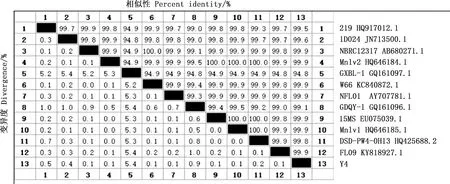
图4 分离菌株16S rRNA基因核苷酸序列相似性分析
由图5可知,分离菌与菌株FL09亲缘关系最近,为一独立的小分支;与菌株15MS、DSD-PW4-OH13和Mnlv2亲缘关系较近,在同一大分支上;与菌株GXBL-1亲缘关系较远。说明不同物种间亲缘关系存在差异性。综合分离菌形态学特征、生化特性鉴定及16S rRNA基因测序分析,判断分离菌为绿色气球菌。
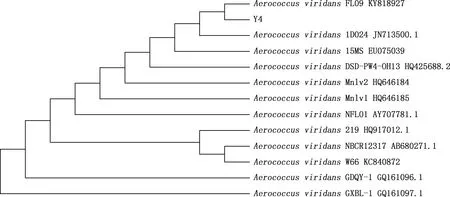
图5 基于16S rRNA基因序列的系统发育树
2.4 致病性试验结果
接种分离菌菌液后6 h,试验Ⅰ、Ⅱ组小鼠精神沉郁,食欲减退,畏寒怕冷;试验Ⅲ、Ⅳ组小鼠精神萎靡,食欲废绝,畏寒怕冷。12 h后,试验Ⅰ、Ⅱ组小鼠精神开始恢复,食欲增加;试验Ⅲ组小鼠死亡2只,试验Ⅳ组小鼠全部死亡。24 h后试验Ⅰ组恢复正常,试验Ⅱ组死亡1只,其余小鼠恢复正常:试验Ⅲ组死亡3只,其余精神开始恢复,食欲增加。48 h后各试验组小鼠恢复正常。对照组小鼠无任何明显的临床症状,均健活。分离菌对小鼠致病性具体结果见表3。

表3 分离菌对小鼠致病性结果
对死亡及发病小鼠剖解发现,小鼠肝脏、脾脏肿大,有出血点,肠道胀气呈透明状,肺脏有出血点,采集其肝脏、脾脏,接种于鲜血平板培养基,37 ℃培养24 h,革兰氏染色观察得到形态单一的阳性球菌。对照组小鼠剖解脏器无明显变化。试验结果表明,绿色气球菌随着接种浓度增大,致病性增强,当菌液浓度达到5×107CFU/mL时具有致死性,通过计算得到该分离菌的LD50为4.8×108CFU/mL。
2.5 药敏试验结果
由表4可知,分离菌对磷霉素、氨苄西林和阿莫西林敏感,对青霉素、新生霉素、阿米卡星、头孢唑林、头孢噻肟、头孢他啶中度敏感;对利福平、新霉素、杆菌肽、红霉素、恩诺沙星、林可霉素、庆大霉素、大观霉素、卡那霉素、链霉素耐药。
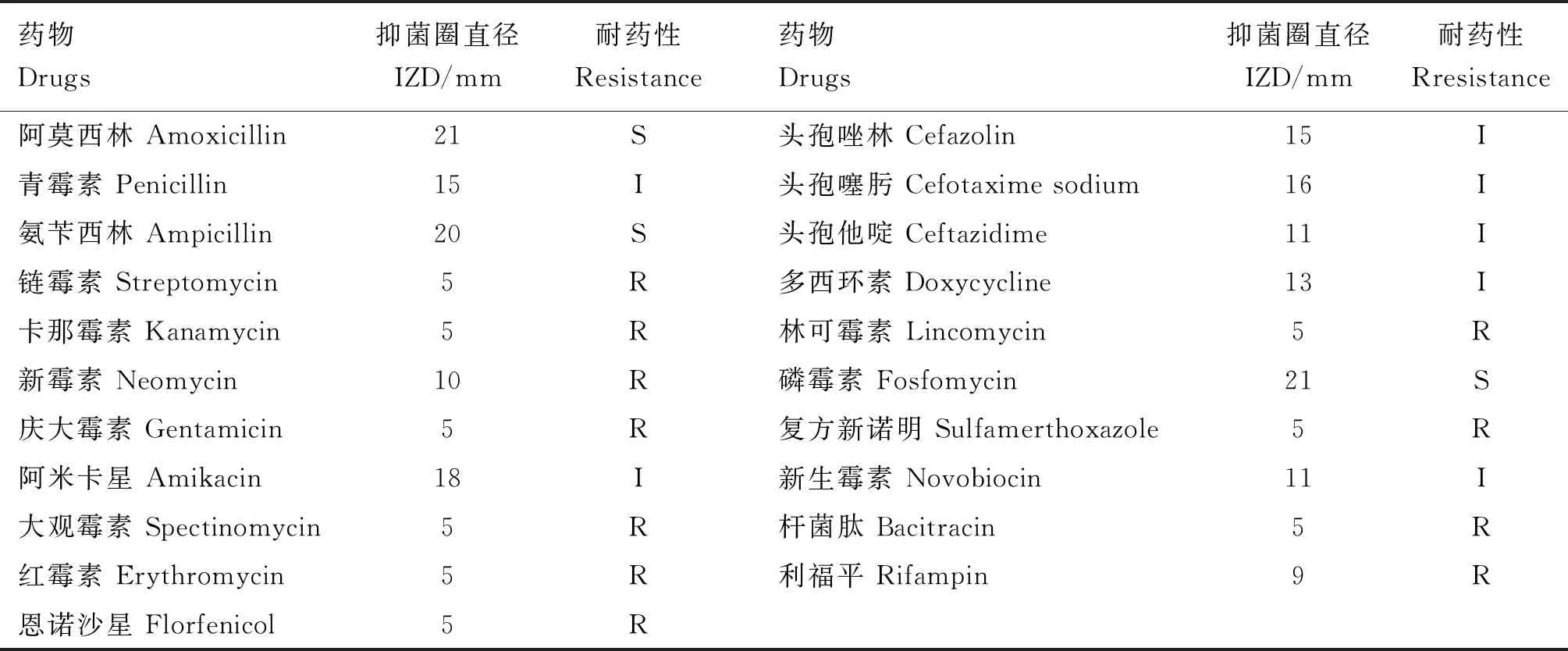
表4 药敏试验结果
3 讨 论
绿色气球菌是一种人畜共患条件性致病菌,已知其可感染人和多种动物,广泛存在于周围环境中。本试验从临床发病鸭病料中分离到1株疑似绿色气球菌,并进行分离培养、生化试验和16S rRNA鉴定。目前,16S rRNA鉴定方法是鉴定动物病原菌的主要方法之一[12]。16S rRNA序列比对结果表明,本试验分离菌与NCBI数据库中11株绿色气球菌的相似性均高达99%以上,结合系统发育树发现分离株与分离自猪、罗非鱼、龙虾、犬、植物、奶牛、环境中的绿色气球菌聚在一簇,鉴定该菌为绿色气球菌。根据构建的系统发育树及核苷酸序列相似性分析结果可知,寄生在不同物种体内的绿色气球菌在进化过程中遗传变异程度较大,但受地域环境、时间等外界影响不明显。目前已从多种动物体内分离到绿色气球菌,表明该菌在自然界环境中广泛存在,提示人们应当注意该菌作为一种条件性致病菌对人和动物的危害。国内外对人和其他动物感染绿色气球菌的病例报道较多,但有关鸭源绿色气球菌的研究较少,对于该菌是否对当前养鸭业存在一定的风险,鸭场感染绿色气球菌的比例有多高,是否存在与其他细菌如鸭疫李默氏杆菌的混合感染等研究较少,因此,未来需对鸭源不同分离株及不同物种之间的分离株进一步研究。
分离菌致病性研究结果表明,该菌具有致病性,且随接种剂量增大,致病性随之增强。阎朝华等[13]首次在竹鼠上分离得到绿色气球菌,结果显示绿色气球菌具有较强致病性;可小丽等[14]首次在罗非鱼上分离得到2株绿色气球菌,结果表明高浓度、大剂量菌液对试验动物具有较强致病性,且随着环境胁迫作用而加强。在水产养殖方面,绿色气球菌引起的最常见的疾病是暴发性龙虾高夫败血症[15-17]及其他各种虾蟹类疾病[18],致病性极强。张乐宜等[9]在广东部分猪场分离得到6猪绿色气球菌,通过动物试验表明,不同分离菌有不同程度的致病性;付琦媛等[19]对小进行鼠致病性试验及回归性试验,结果表明绿色气球菌具有较强致病性,有致死性。本研究与前期报道基本一致,表明该菌对多种动物具有一定的致病性,其致病机理有待于进一步研究。
从20世纪80年代起,随着抗生素的广泛使用,绿色气球菌开始对抗生素出现耐药性。可小丽等[14]研究表明,分离株对β-内酰胺类、喹诺酮类药物敏感;对部分大环内酯类、四环素类抗生素类药物耐药。张乃嘉等[20]发现,分离株主要对头孢类和喹诺酮类抗生素敏感,对部分氨基糖苷类、四环素类抗生素耐药。董文龙等[21]对6株绿色气球菌进行耐药性分析,结果表明分离菌具有多重耐药表型,只对阿米卡星、氟苯尼考、环丙沙星及恩诺沙星较敏感;Chen等[22]发现气球菌对环丙沙星、克林霉素、庆大霉素、磺胺甲噁唑、甲氧苄氨嘧啶和四环素耐药。本试验中绿色气球菌分离菌株对磷霉素敏感,对部分大环内酯类、氨基糖苷类药物和喹诺酮类药物耐药,这与其他地区不同分离源的绿色气球菌株药敏结果不完全一致,显示出时间与地域上的差异[23]。不同环境中的选择性压力及抗生素的长期使用已引起绿色气球菌耐药性的产生,同时也突出了药敏检测的重要性。目前,绿色气球菌的详细耐药机制及相关抗性基因尚且不得而知,但就目前现状来看,对其进行耐药性研究十分必要。
4 结 论
本研究分离得到1株绿色气球菌,致病性试验结果表明该菌具有致死性,遗传进化结果表明不同地域、不同物种分离菌具有差异性。
