神经元特异性烯醇化酶对心肺复苏患者神经功能预后的评估价值
2022-03-02王亚东林金锋田李均
王亚东,林金锋,田李均
(江苏省南通市第三人民医院重症医学科,南通 226006)
不断改善的心肺复苏(cardiopulmonary resuscitation,CPR)技术大大提高了心跳呼吸骤停患者早期自主循环恢复(return of spontaneous circulation,ROSC)率,但脑组织对缺血缺氧耐受性差,易出现再灌注损伤,而脑功能受损程度直接决定着患者预后。因此,需在早期对CPR 患者神经功能预后做出准确评估,以确定可能从重症监护中获益的患者[1]。现已有多种判断神经功能预后的方法,如神经系统评分、神经电生理测试、神经成像技术、脑氧代谢监测和生化标志物检测等[2],但这些方法中没有一种能可靠预测CPR 的神经结局[3]。其中血清生化标志物以其可重复测量、对患者侵袭性小、相对准确等优势被临床接受[4]。神经元特异性烯醇化酶(neuron specific enolase,NSE)是CPR 国际指南推荐的神经系统评估的重要指标[5]。虽然有建议[6]使用CPR 48 h 后NSE 33 ng/mL 作为判断神经功能预后的截断值,但也有研究[7-9]报道NSE>33 ng/mL 的CPR 患者神经功能预后良好。因此,本研究旨在选择一个预测昏迷预后100%特异的NSE 截断值,以帮助临床更准确地评估病情及预后。
1 资料与方法
1.1 一般资料 回顾性分析2019 年1 月—2021 年12 月南通市第三人民医院重症医学科收治的CPR后ROSC 患者的临床资料。纳入标准:(1)年龄>18 岁;(2)各种原因导致的心跳呼吸骤停接受CPR 患者;(3)住院时间>3 d。排除标准:(1)神经源性(如脑外伤、脑血管意外等)心跳呼吸骤停者;(2)肿瘤患者。
共51 例患者纳入研究,其中男34 例,女17 例;年龄(68.96±17.20)岁;发病原因:心源性24 例(心肌梗死6 例,心律失常18 例),呼吸源性17 例(窒息15例,呼吸衰竭2 例),内环境紊乱6 例,毒物中毒2 例,失血性休克2 例;开始CPR 至ROSC 时间(25.78±36.62) min。采用格拉斯哥-匹兹堡脑功能表现分级(cerebral performance category,CPC)来评估CPR 患者的神经功能预后,1 级为脑功能完好:患者清醒警觉,有正常生活和工作能力;2 级为中度脑功能残疾:患者清醒,可在特定环境中部分时间工作或独立完成日常活动;3 级为严重脑功能残疾:患者清醒,但需依赖他人日常帮助,保留有限的认知力;4 级为昏迷及植物状态:患者无知觉,对环境无意识,无认知力;5 级为死亡:患者被确认脑死亡或传统标准认定的死亡。将患者分为清醒组(CPC 1~3 级)和昏迷组(CPC 4~5 级)。
1.2 检测方法 记录患者的ROSC 时间和入科后的急性生理学与慢性健康状况评分Ⅱ(acute physiology and chronic health evaluationⅡ,APACHEⅡ);入院后第7 天停用所有镇静镇痛药物,计算格拉斯哥昏迷评分(Glasgow coma scale,GCS);分别于CPR 后第1、2、3、5、7 天抽取外周静脉血,使用安徽中科中佳公司的LC-4012 低速离心机以4 000 r/min 离心5 min后取上层血清,采用罗氏公司的神经元特异性烯醇化酶测定试剂盒(电化学发光法)检测NSE。
1.3 统计学方法 使用SPSS 20.0 进行统计分析。数值资料(正态分布)以表示,采用t 检验;不服从正态分布的定量资料以M(QL,QU)表示,采用Mann-Whitney U 检验;分类资料采用百分比表示,采用χ2检验;受试者工作特征曲线(receive operator characteristic curve,ROC 曲线)的曲线下面积评估NSE 峰值对患者神经功能预后的预测能力,计算NSE 的截断值(特异性100%、敏感性最高)。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者一般资料的比较 清醒组中CPC 1级6 例,CPC 2 级7 例,CPC 3 级5 例;昏迷组中CPC 4 级18 例,CPC 5 级15 例。两组患者的年龄、性别差异无统计学意义(P>0.05)。与清醒组相比,昏迷组的ROSC 时间更长、APACHEⅡ评分更高、GCS 评分更低(均P<0.05)(表1)。
表1 不同神经功能预后两组患者一般资料的比较[,n,%,M(QL,QU)]
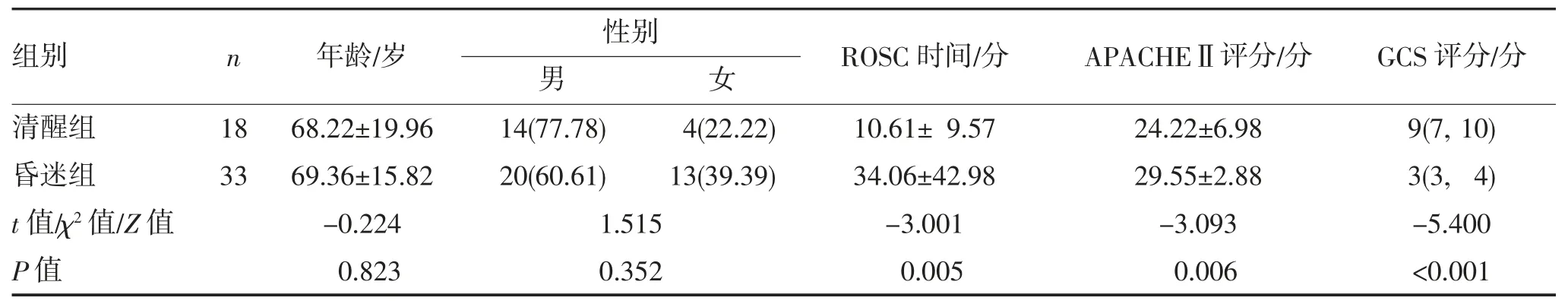
表1 不同神经功能预后两组患者一般资料的比较[,n,%,M(QL,QU)]
2.2 两组患者NSE 的比较 和清醒组相比,昏迷组每个时间点的NSE 值均明显偏高(均P<0.001);7 d中的峰值也明显高于清醒组(P<0.05)(表2)。昏迷组NSE 于入院后第3 天达峰,长于清醒组(第2 天达峰),且波动幅度明显高于清醒组。

表2 不同神经功能预后两组患者不同时间点NSE 值的比较[M(QL,QU),ng/mL]
2.3 NSE 峰值对患者神经功能预后的评估 ROC曲线分析显示NSE 峰预测昏迷预后的曲线下面积为0.814(95%CI:0.698~0.930)(图1);当NSE>70 ng/mL时,其预测昏迷的特异性达100.00%,敏感性57.60%,阳性预测值100.00%,阴性预测值56.25%。
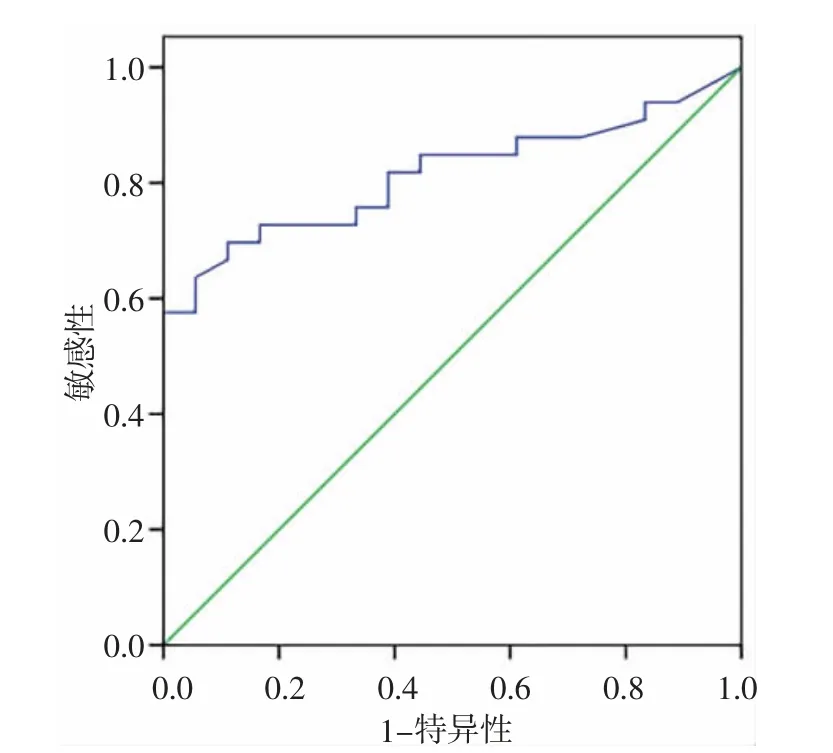
图1 NSE 峰值预测昏迷预后的ROC 曲线
3 讨论
CPR 恢复自主循环后,最重要的是脑复苏。然而,因为大脑对缺血缺氧极度敏感,ROSC 患者中80%存在持续时间与程度不等的昏迷,其中40%的患者将成植物生存状态,80%的患者在1 年内死亡[10-11]。因此,神经功能预后的早期评估,对病情的评估、治疗策略的调整、与家属的沟通等较为重要。
目前针对神经功能预后的评估手段都存在不同程度的缺陷,如神经评分系统易受主观及药物影响、神经电生理易受病房各种仪器的干扰、头颅核磁检查对危重患者而言难以实施,且特异性较差[12]。而生物标志物有其他检查不可替代的优势:(1)不会被镇静剂/肌肉松弛剂的使用所掩盖;(2)可以在评估过程的早期使用,并可连续监测[13]。NSE 是目前研究较多的一种生物标志物,国内外研究[14-16]提示其与神经功能预后密切相关。作为糖酵解酶烯醇化酶(2-磷酸-D-甘油水解酶)的一种同工酶:NSE 来源于神经外胚层的细胞,化学性质相对稳定,受外界环境影响小,血清与脑脊液中浓度也极低[17]。当脑细胞经历缺血缺氧及再灌注损伤后,NSE 从神经元中漏出,通过损伤的血脑屏障进入血液,故在脑损伤时血NSE 浓度会明显增高[18]。
本研究中不同神经功能预后患者的性别构成及年龄差异无统计学意义(P>0.05);但与清醒组相比,昏迷组ROSC 时间更长(P<0.05)、APACHEⅡ评分更高(P<0.05)、GCS 评分更低(P<0.05),说明昏迷组脑缺血缺氧时间长,由此引起的神经功能损害更为严重;在生物标志物方面,昏迷组的NSE 浓度在所有时间点均高于清醒组(P<0.05);同时两组的NSE 变化趋势不同,昏迷组NSE 在第3 天达峰,且NSE 达峰时间较清醒组更长、波动幅度大,说明脑损伤严重程度、神经元细胞破坏程度和NSE 的浓度呈正相关,这与多数研究结果[15-18]一致。
目前,较多研究[6,18-20]选择NSE 25~50 ng/mL 作为截断值,但该截断值预测昏迷预后的特异性达不到100%,而为了更有临床意义,预测ROSC 患者神经功能预后的指标应具有高度的特异性。因此,本研究选择NSE 连续监测的最高值,计算出预测昏迷预后特异性达到100%的NSE 截断值为70 ng/mL,这与K.J.STREITBERGER 等[21]以90 ng/mL 作为高度特异性截断值相近,差距原因可能是人群、检测时间点、试剂等存在差异。选择该截断值作为临床预测神经功能预后的指标,虽然牺牲了部分敏感性,但对于评估患者是否将处于长期昏迷或脑死亡状态,有着较大的临床和现实意义:(1)更多关注生存率高和神经功能预后良好的患者[22];(2)沟通时可给予家属更准确的预后信息,帮助他们做出相关决定;(3)进行医疗资源的适当再分配,减少医疗资源的浪费。
当然,在临床实践中,对患者病情的评估不能仅依赖于单个指标,需结合临床综合判断;评估ROSC患者神经功能预后时需注意颅脑病变、肿瘤、溶血等导致NSE 升高的因素[21]。血清NSE 浓度与脑损伤严重程度呈正相关,1 周内峰值浓度>70 ng/mL,是一种高度特异但仅中度敏感的标志物,可预测ROSC 患者不良的神经功能预后。本研究样本量较小,相关的截断值有待于更多、更大型的研究来进一步确定;未纳入神经系统病变导致的心跳呼吸骤停患者,可能存在选择偏倚。
