IgA 肾病患者血清外泌体中NLRP3 的表达及与疾病严重程度的相关性*
2022-03-02曹英杰顾夏梦陈晓岚郭乃凤
曹英杰,顾夏梦,陈晓岚*,郭乃凤,陈 旭,刘 静
(南通大学附属医院肾脏内科,南通 226001)
免疫球蛋白A(immunoglobulin A,IgA)肾病是全球最常见的原发性肾小球疾病,也是我国进入终末期肾病的主要原发病[1]。目前IgA 肾病的具体发病机制及影响病情发展的因素仍未完全明确。外泌体系活细胞分泌的可携带细胞内多种信号因子的双层脂质膜囊泡,直径30~100 nm,可由不同类型的细胞脱落释放,存在于多种体液中,传递信号并能够放大信号产生的效应。近年来外泌体在自身免疫性疾病中的作用一直是研究热点[2-4]。IgA 肾病患者体内存在免疫异常,NOD 样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)是构成机体防御反应的重要因素,能调控固有免疫系统,在应激和炎性的病理条件下,诱导体内Caspase-1 依赖的细胞焦亡[5-6]。经典的IgA肾病发病机制认为糖基化异常的IgA1 及其复合物的沉积系关键,而活化免疫细胞分泌的外泌体是否对肾脏有直接的影响尚未有具体研究,本研究探讨血清外泌体中NLRP3 的含量与IgA 肾病严重程度的相关性,为其发病机制及临床治疗靶点提供新的理论依据。
1 对象与方法
1.1 研究对象 选取2018 年1 月—2019 年12 月于南通大学附属医院经肾活检及临床指标确诊为原发性IgA 肾病患者60 例;另选择因肾良性肿瘤行手术切除患者15 例为对照组。排除合并其他慢性疾病,包括风湿病、慢性肝病、糖尿病和肿瘤患者。所有患者入组时均未经过系统治疗,未使用过免疫抑制剂等药物。本研究方案由南通大学附属医院伦理委员会批准(伦理号:2018-L036),所有受试对象签署知情同意书。
1.2 临床资料及标本采集 采集患者空腹上臂静脉血15 mL,-80 ℃保存,使用时于37 ℃下快速溶解。统计24 h 尿量,取100 mL 送检。血、尿标本送检验科检测血清肌酐及24 h 尿蛋白定量,内生肌酐清除率按Cockcroft-Gault 公式计算:内生肌酐清除率=(140-年龄)×体质量(kg)/72×血清肌酐(mg/dL),女性按计算结果×0.85。IgA 肾病肾组织标本系由超声引导下行经皮肾穿刺活检术取得。对照组系离肿瘤部位较远的正常肾组织,所有肾组织于术后部分置于10%甲醛中固定,部分置于液氮中,并保存于-80 ℃冰箱。
1.3 血清外泌体的提取与鉴定 清晨抽取空腹入组患者上臂静脉血,待血液完全凝固后,3 000 r/min离心5~10 min,吸出上清,分装备用。按Hieff TM Quick exosome isolation kit(上海翊圣生物科技有限公司,41202ES08)外泌体提取试剂盒操作,外泌体经固定液、锇酸固定,不同浓度乙醇脱水并在环氧树脂浸透过夜、包埋后切片、铅铀染色,至透射电镜下观察摄片。同时,采用流式细胞术检测外泌体表面标志。
1.4 血清外泌体中NLRP3 及CD19 含量的测定提取血清外泌体,PBS 洗涤离心后,向沉淀中加入4 ℃预冷RIPA 裂解液,混匀后置于冰上30 min,4 ℃13 000 r/min 离心15 min,收集上清。按NLRP3 ELISA Kit(江莱生物JL18318-48T),人CD19 ELISA Kit(上海信裕生物科技有限公司,XY-CD19-Hu)试剂盒步骤操作,检测外泌体内NLRP3 及CD19 的含量。
1.5 免疫组织化学法 肾组织于4%甲醛中固定,予脱水、透明、浸蜡包埋,经切片、烘干、脱蜡、抗原修复处理后,于3%H2O2室温孵育10 min,磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗3 min×3 次;加一抗免抗人NLRP3 抗体(Abcam 公司ab263899,1:30 稀释)、兔抗人CD19 抗体(Abcam 公司,ab227688,1:100 稀释) 4 ℃过夜;PBS 冲洗,再滴加辣根过氧化物酶标记的第二抗体(批号:A0208,上海碧云天生物工程有限公司,1:200 稀释),室温孵育30 min;PBS 洗涤,二氨基联苯胺显色,苏木精复染、脱水、封片,采用Image-Pro Plus 6.0 图像分析处理软件测定积分光密度值,计算平均值。
1.6 肾脏病理积分标准 根据IgA 肾病Katafuchi积分标准[7],肾小球病变积分为0~12 分,包括系膜细胞和系膜基质增生程度(0~4 分);节段性肾小球病变,如新月体形成、球囊壁粘连、节段性硬化和节段性毛细血管壁纤维素样坏死(0~4 分);肾小球球性硬化(0~4 分),积分评定标准为:(1)无,0 分;(2)<10%,1分;(3)10%~25%,2 分;(4)>25%~50%,3 分;(5)>50%,4 分。将60 例IgA 肾病患者根据该积分,分为4 组:0~3 分(Ⅰ组)17 例,4~6 分(Ⅱ组)19 例,7~9 分(Ⅲ组)15 例,10~12 分(Ⅳ组)9 例。
1.7 统计学方法 应用SPSS 17.0 软件进行统计分析,计量资料以表示,组间比较行t 检验,多组间比较行方差分析,双变量之间的相关分析行Pearson相关分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 患者的基线资料比较 各组患者年龄、性别差异无统计学意义(P>0.05);随病理积分的增加,患者尿蛋白定量逐渐升高,内生肌酐清除率逐渐降低,两两相比差异有统计学意义(P<0.05)(表1)。
表1 各组患者临床指标比较(n,)
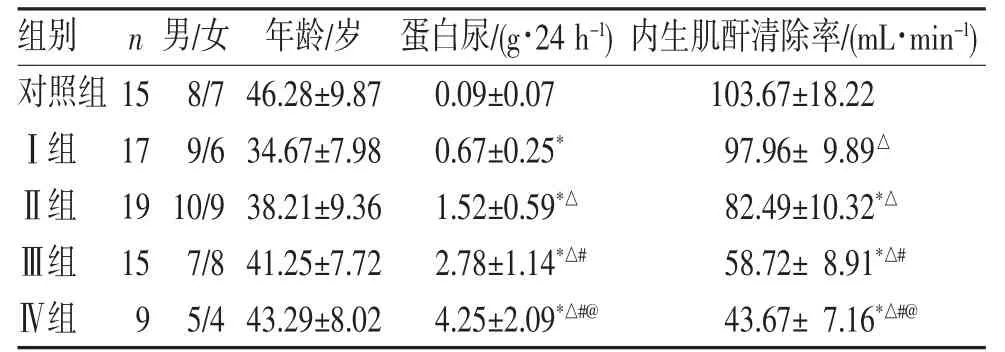
表1 各组患者临床指标比较(n,)
注:与对照组相比,△P<0.05;与Ⅰ组相比,△P<0.05;与Ⅱ组相比,#P<0.05;与Ⅲ组相比,@P<0.05。
2.2 血清外泌体中NLRP3 的含量与肾脏疾病严重程度的相关性 IgA 肾病组血清外泌体中NLRP3 的含量较对照组明显升高(P<0.05),且随病理积分的增加而上升,呈正相关关系(r=0.72,P<0.05)(表2,图1A);而且血清外泌体中NLRP3 的含量与24 h 蛋白尿呈正相关(r=0.58,P<0.05)(图1B),与内生肌酐清除率呈负相关(r=-0.64,P<0.05)(图1C);此外,外泌体中CD19的含量与对照组相比明显上升,且随病理积分的增加而上升(表2)。
表2 血清外泌体中NLRP3 及CD19 的含量()

表2 血清外泌体中NLRP3 及CD19 的含量()
注:与对照组相比,*P<0.05;与Ⅰ组相比,△P<0.05;与Ⅱ组相比,#P<0.05;与Ⅲ组相比,@P<0.05。

图1 血清外泌体及肾脏组织中NLRP3 的表达与各指标的相关关系
2.3 肾脏组织中NLRP3 的相对含量与病情严重程度的关系 IgA 肾病组肾脏组织中NLRP3 的含量较对照组明显升高(P<0.05),且随病理积分的增加而上升(表3,图2,见封二),与病理积分呈正相关(r=0.73,P<0.05)(图1D)。肾脏组织中CD19 的含量与对照组相比亦明显升高,且随病理积分的增加而上升(P<0.05)(表3,图2)。IgA 肾病患者血清外泌体中NLRP3 的含量与肾脏组织中NLRP3 表达呈明显正相关(r=0.61,P<0.05)(图1E)。

图2 肾脏组织中NLRP3 及CD19 的表达(400×)
表3 肾脏组织中NLRP3 及CD19 的表达相对量()

表3 肾脏组织中NLRP3 及CD19 的表达相对量()
注:与对照组相比,*P<0.05;与Ⅰ组相比,△P<0.05;与Ⅱ组相比,#P<0.05;与Ⅲ组相比,@P<0.05。
3 讨论
IgA 肾病的发病机制复杂,涉及免疫反应的多个环节,仍未完全明确,除有创检查肾活检外,尚缺乏有效评估病情的方法,IgA 肾病多数呈进展性,确诊20 年内有20%~40%进入终末期[8-10]。外泌体来源于体内活细胞释放,携带多种脂质、核酸及蛋白质等信息,在细胞与细胞之间进行物质和信息的传递[11-12]。研究[13]表明IgA 肾病的发病机制中存在B 细胞活化及体内炎症介质的反应,而NLRP3 炎症小体作为一种多蛋白复合体,可诱导细胞活化、炎症介质的释放,引起一系列炎症反应,参与机体慢性炎症反应的调控。NLRP3 分子质量大约为700 ku,能感受胞质内多种微生物应激代谢产物,多种信号通路如NFκB 等均参与其激活[14-15]。目前炎症小体在自身免疫性疾病中的作用成为研究的热点,众多疾病均涉及NLRP3 炎症小体的活化[16]。
近年来,多项研究[17-20]表明NLRP3 参与肾脏病的发病。C.ZHANG 等[17]通过体外实验研究,发现肾小球足细胞可表达NLRP3 和凋亡相关斑点样蛋白。J.LICHTNEKERT 等[18]在抗基底膜肾炎大鼠模型肾组织中发现白细胞介素1β 前体、Caspase-1、NLRP3 mRNA 水平上调,且与肾脏病理损伤程度密切相关。A.VILAYSANE 等[19]通过肾脏组织病理检查发现正常肾脏组织中NLRP3 有少量表达,而在肾脏疾病中NLRP3 的表达显著上升,且其表达量与患者血清肌酐水平呈正相关。NLRP3 炎症小体在如骨髓瘤肾病、造影剂肾病、横纹肌溶解症、尿酸盐肾病等晶体类物质相关肾病中亦有表达增加,但NLRP3 炎症小体在肾实质非免疫细胞中的信号传导途径仍然不清楚[20]。
本研究结果显示,与对照组相比,IgA 肾病患者血清外泌体内NLRP3 炎症小体的含量明显升高,且随患者尿蛋白定量增加而上升,呈正相关关系,与内生肌酐清除率呈负相关,且与肾脏病理损害的程度呈正相关,提示血清外泌体内NLRP3 炎症小体的含量与IgA 肾病的病情相关。另外,本研究发现外泌体中CD19 的表达亦增加,CD19 系B 细胞表面特有标志,推断NLRP3 含量增加的外泌体有可能来源于B细胞。通过对IgA 肾病患者肾组织内NLRP3 的检测发现,与对照组相比,IgA 肾病患者肾组织内NLRP3的表达明显升高,主要集中于系膜区,且与肾脏病理损害程度呈正相关,CD19 在系膜区的表达也有增强。患者血清外泌体内NLRP3 含量与肾脏组织内NLRP3 含量有一致性。由此推断血清外泌体内NLRP3 参与IgA 肾病的发生及发展。
课题组前期研究[21]显示IgA 肾病患者中B 淋巴细胞刺激因子的水平明显升高,导致B 细胞的异常活化,同时发现B 细胞可向肾脏迁移,推测B 细胞外泌体亦可通过血液循环作用于肾脏。本研究显示肾组织内NLRP3 及CD19 的表达主要沉积于系膜区,推测B 细胞外泌体可能与系膜细胞作用参与IgA 肾病发生,此为下一步研究的重点。
综上所述,IgA 肾病患者血清外泌体和肾脏组织中NLRP3 表达均升高,血清外泌体及肾脏组织中NLRP3 表达趋势具有一致性,且与IgA 肾病的严重程度相关,由此,血清外泌体NLRP3 表达可作为IgA肾病病情变化的检测指标,也为临床IgA 肾病治疗提供新的靶点。
