微囊藻毒素-LR 诱导NLRP3 炎症小体活化的肝组织细胞类型鉴定*
2022-03-02赵肖仪张艳巧尹可函张亚莉
赵肖仪,张艳巧,尹可函,赵 楠,夏 迪,樊 星,张亚莉*
(南通大学医学院生物化学与分子生物学系,南通 226001)
随着全球气候变化和人类活动的增加,饮用水体中蓝藻水华污染在全世界范围内逐年增长,微囊藻毒素-LR(microcystin-LR,MC-LR)是蓝藻细胞产生的分布最为广泛、毒性最强的细胞内毒素,被国际癌症研究机构定义为2B 类致癌物[1-2]。由于肝细胞高表达介导MC-LR 吸收所必须的有机阴离子转运多肽(organic anion transporting polypeptides,OATP)OATP1B1 和OATP1B3,因此肝脏被认为是最易受MC-LR 攻击的器官[3]。MC-LR 暴露能够导致肝脂质代谢紊乱[4]、非酒精性脂肪性肝炎[5]和肝癌[6]发生。流行病学调查[7]显示,人血清MC-LR 的浓度和肝癌的发生明显相关。此外,MC-LR 的暴露能够增强乙型肝炎病毒(hepatitis B virus,HBV)和黄曲霉素B1(aflatoxin B1,AFB1)结合诱导的肝损伤程度,MC-LR和HBV、AFBs 一起被认为是引起肝脏损伤的三大危险因素[8]。因此,研究MC-LR 肝毒性机制对人类健康至关重要。
炎症小体是一类位于胞内的多蛋白复合体,参与人体的炎症和免疫反应,其中核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)是目前研究最为充分的炎症小体。NLRP3 炎症小体被活化后,引起pro-Caspase-1 自剪切,形成有活性的Caspase-1,活化的Caspase-1 不仅将白细胞介素(interleukin,IL)-1β 和IL-18 前体转化为有活性的IL-1β 和IL-18,发挥其生物学作用,还在细胞膜上形成孔道,释放细胞内容物,造成炎症型细胞死亡,即焦亡[9-10]。越来越多研究[11-14]显示NLRP3 炎症小体的活化在外源物导致的肝损伤、非酒精性或酒精性脂肪性肝炎和肝纤维化中起重要作用。然而,以往研究[15-16]大多将MC-LR 诱导细胞损伤的方式归因于凋亡,NLRP3 炎症小体介导的焦亡是否参与MC-LR 诱导的肝毒性很少被关注。
本课题组前期研究[17]表明,NLRP3 炎症小体活化在MC-LR 诱导的小鼠肝组织炎性损伤中起重要作用。本研究在此基础上,从小鼠肝组织分离原代肝实质细胞和肝脏固有巨噬细胞——Kupffer 细胞,从NLRP3 炎症小体活化视角分析比较MC-LR 对这两种细胞的毒性作用,明确MC-LR 诱导肝组织NLRP3炎症小体活化发生的细胞类型,旨在为MC-LR 肝毒性的机制研究提供新的思路。
1 材料与方法
1.1 材料来源1.1.1 实验动物 15 只4 周龄雄性C57BL/6 小鼠,体质量约20 g,饲养于南通大学实验动物中心无特定病原体(specific pathogen free,SPF)级动物房内。动物房室温20~25 ℃,相对湿度40%~70%,自由饮食,昼夜各半循环照明。动物实验通过南通大学动物伦理委员会审查(2012-0031)。
1.1.2 主要试剂 MC-LR(ENZO,ALX-350-012),Ⅳ型胶原酶(Sigma,C5138),Anti-NLRP3 抗体(Abcam,AB263899),Anti-pro-Caspase1+p10+p12 抗体(Abcam,AB179515),Anti-IL-1β(Proteintech,16806-1-AP),Anti-Albumin 抗体(Abcam,AB207327),Anti-F4/80 抗体(Cell signal,#30325),FAM-FLICA Caspase Assay Kits(Immuno Chemistry Technologies);DMEM/F12(Gibco,A4192001)。
1.2 实验方法
1.2.1 小鼠肝实质细胞和Kupffer 细胞的分离和培养 参照文献[18]从同一只小鼠肝脏分离肝实质细胞和Kupffer 细胞。将4 周龄雄性C57BL/6J 小鼠麻醉,开腹暴露下腔静脉和门静脉,注射针刺入下腔静脉,固定。以0.38 mL/min 的速度推注Hanks′平衡盐溶液(Hanks′ balanced sodium solution-EGTA,HBSSEGTA),待肝脏肿胀并变色,调节速度为1.7 mL/min,剪断门静脉,持续推注15~20 mL HBSS-EGTA,使肝脏保持膨大状态,整个肝脏颜色快速变成奶油色。之后,换胶原酶继续灌注(速度同上)。灌注完成后,游离肝脏,将肝脏转移至盛有冰冷的15 mL HBSS-CaCl2溶液的培养皿中,移走胆囊,轻柔切肝叶,释放肝细胞,用30 mL 冰冷的HBSS-CaCl2,100 μm 的细胞滤网过滤细胞至50 mL 离心管,50 g,5 min,4 ℃离心,肝实质细胞在沉淀,Kupffer 细胞在上清。将含有Kupffer 细胞的上清轻柔转入提前准备好的Percoll gradient。30 mL HBSS-CaCl2溶液重悬肝实质细胞沉淀,50 g,3 min,4 ℃离心(重复3 次),弃上清,用含15%胎牛血清(fetal bovine serum,FBS)的DMEM/F12培养3~4 h 贴壁后,换10% FBS 的DMEM/F12 培养(此为肝实质细胞)。将转至Percoll gradient 的Kupffer 细胞200 g,30 min,4 ℃离心,小心收集中间层,将其转移至新的50 mL 离心管,加磷酸盐缓冲液(phosphase buffered saline,PBS)到20 mL,离心,将沉淀用培养基RPMI 重悬,静置30 min,用PBS 洗涤去除未贴壁的细胞,并加入新的培养液置培养箱培养(此为肝Kupffer 细胞)。
1.2.2 Western Blot 检测NLRP3 炎症小体相关蛋白表达 提取肝实质细胞和Kupffer 细胞蛋白后,采用BCA 蛋白定量法进行定量检测。取50 μg 蛋白进行SDS-PAGE 电泳,移至PVDF 膜,相关一抗4 °C 孵育过夜,辣根过氧化物酶(horseradish peroxidase,HRP)标志的二抗室温孵育2 h,TBST 洗膜3 次,使用分子成像仪进行曝光显影,拍照。
1.2.3 免疫荧光检测NLRP3 在肝实质细胞和Kupffer 细胞的定位 分别将肝实质细胞和Kupffer 细胞接种于24 孔板内(事先放入鼠尾胶原包被的玻片),培养24 h 后,加入不同浓度的MC-LR 染毒处理,之后吸弃培养基,PBS 洗2 次,4%多聚甲醛固定,室温15 min。加入10%FBS/PBS,室温封闭20 min。稀释一抗于0.2% Triton X-100/10%FBS/PBS,4 ℃孵育过夜。10%FBS/PBS 洗3 次,二抗室温孵育1 h,加DAPI 染细胞核,激光共聚焦显微镜下拍照。
1.2.4 焦亡率检测 将接种于6 孔板的Kupffer 细胞用不同浓度MC-LR 处理24 h 后,胰酶消化收集细胞,PBS 洗涤,分别用1×FAM-FLICA(一种标志活化的Caspase-1 的荧光染色剂)和碘化丙啶(propid ium iodide,PI)(作为细胞膜孔道形成的标志)染色细胞,流式细胞仪检测,分析细胞焦亡的情况。
2 结果
2.1 肝实质细胞和Kupffer 细胞的鉴定 肝实质细胞提取4 h 后,贴壁生长,部分呈现双核,表明细胞状态良好;Kupffer 细胞提取48 h 后,细胞伸出伪足,呈梭形。为进一步明确细胞类型,用肝实质细胞的标志蛋白Albumin 或Kupffer 细胞的标志蛋白F4/80分别对两种细胞进行免疫荧光染色,结果显示:肝实质细胞全部被其标志蛋白Albumin 染色,表明提取纯度高;Kupffer 细胞被其标志蛋白F4/80 染色,纯度尚可(图1A)。此外,经Western Blot 鉴定Albumin 仅标志肝实质细胞而非Kupffer 细胞,而F4/80 正好相反(图1B),表明Albumin 和F4/80 对肝实质细胞和Kupffer 细胞的鉴定具有特异性。
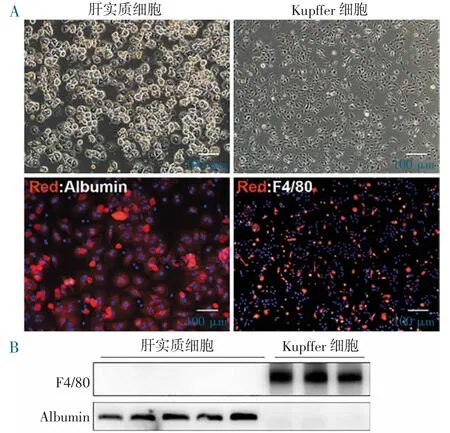
图1 小鼠肝脏提取肝实质细胞和Kupffer 细胞的鉴定
2.2 MC-LR 对肝实质细胞和Kupffer 细胞中NLRP3 炎症小体活性的影响 由于MC-LR 可以通过共价结合蛋白磷酸酶2A(protein phosphatase 2A,PP2A)的催化C 亚基从而在细胞中进行生物积累,因此本实验用抗MC-LR 抗体检测MC-LR(1 ku)和PP2Ac(36 ku)形成的复合物(约37 ku)来鉴定MC-LR是否进入细胞。如图2A 所示,在10 nmol/L 组就可发现MC-LR 在肝实质细胞中聚集,并随浓度增加MC-LR 的聚集量增加。NLRP3 炎症小体活化后可剪切pro-Caspase-1 形成有活性的Caspase-1(p10),活化的Caspase-1 切割pro-IL-1β 为有活性的IL-1β(p17)。因此,通常用裂解的Caspase-1(p10)和IL-1β(p17)的表达来检测NLRP3 炎症小体的活性。在30、50 nmol/L MC-LR 处理3 h 后,肝实质细胞中NLRP3及裂解的Caspase-1(p10)表达明显增加,在50 nmol/L处理组出现IL-1β(p17),同时pro-Caspase1 和pro-IL-1β 表达减少(图2A~B)。同样,本研究也检测了MC-LR 在Kupffer 细胞中的聚集以及MC-LR 对Kupffer 细胞中NLRP3 表达和活性的影响。结果表明,MC-LR 可以进入Kupffer 细胞,但是相比肝实质细胞,Kupffer 细胞对MC-LR 的敏感度下降,直到10 μmol/L MC-LR 处理24 h 方可检测到代表NLRP3 炎症小体活化的Caspase-1(p10)和IL-1β(p17)表达增加(图2C~D)。

图2 MC-LR 对肝实质细胞和Kupffer 细胞中NLRP3 炎症小体活性相关蛋白的影响
2.3 NLRP3 在肝实质细胞和Kupffer 细胞中的定位表达 用免疫荧光双标法检测NLRP3 分别与肝实质细胞标志蛋白Albumin、Kupffer 细胞标志蛋白F4/80 的共定位,结果显示,在30、50 nmol/L MC-LR 处理组,NLRP3(绿色)的荧光强度依次增强,且和Albumin(红色)的荧光融合(黄色),表明经MC-LR 处理后NLRP3 在肝实质细胞中表达升高(图3A,见封二)。同样,NLRP3 和F4/80 共定位检测发现,经MC-LR处理后,相比对照组,NLRP3(绿色)的荧光强度增高,更重要的是NLRP3 主要表达于F4/80 标志(红色)的Kupffer 细胞(黄色),而在未被F4/80 标志的细胞中表达较弱(图3B,见封二)。
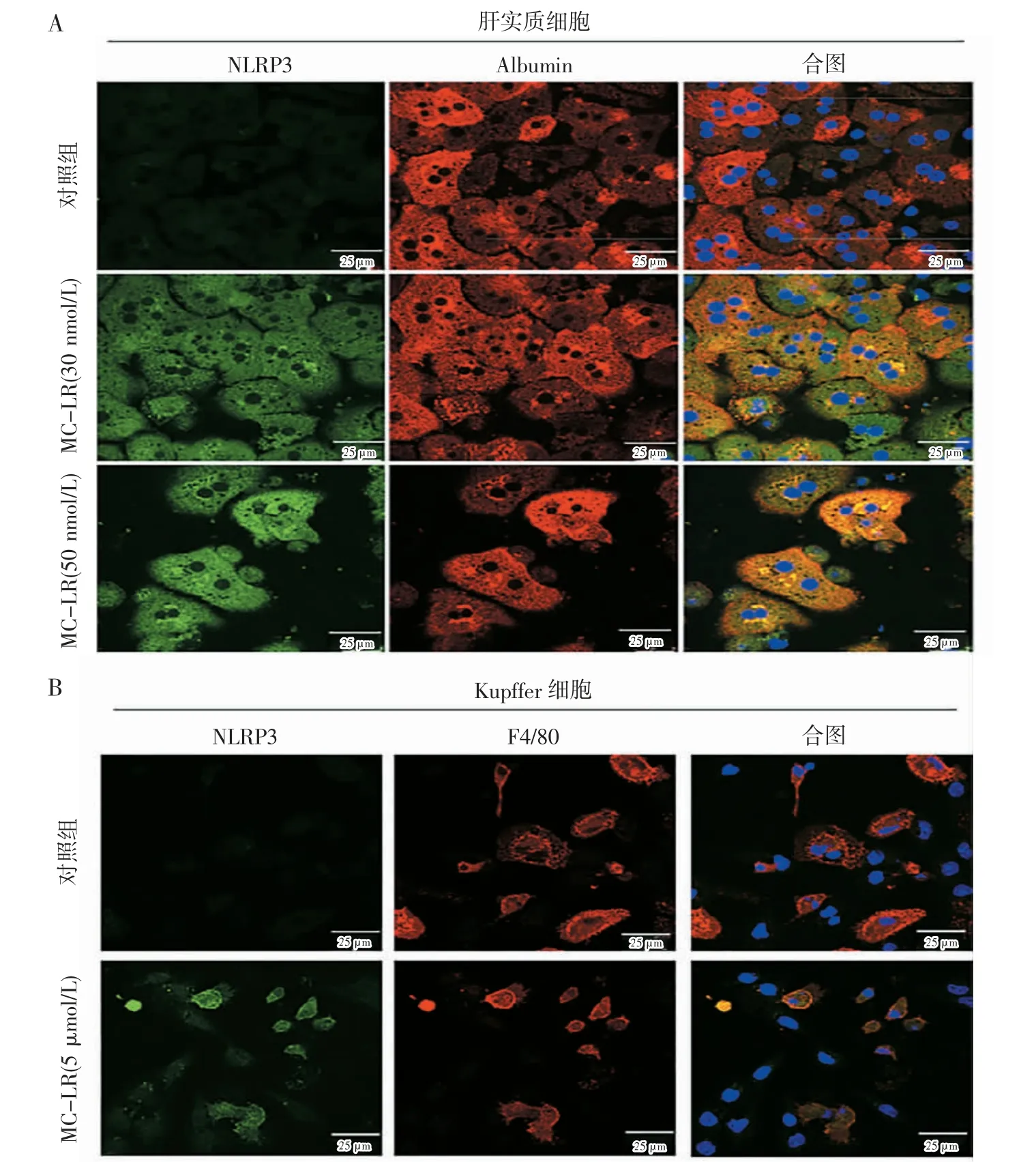
图3 NLRP3 在肝实质细胞和Kupffer 细胞中的定位研究
2.4 MC-LR 诱导Kupffer 细胞焦亡率升高 流式细胞术检测细胞焦亡率(FAM-FLICA 和PI 双阳性表示焦亡细胞),结果显示:在5 μmol/L 和10 μmol/L MC-LR 处理组,Kupffer 细胞的焦亡率相比对照组(15.6%)明显增加,分别为33.9%和49.5%,同时用NLRP3 激活剂nigericin 作为焦亡率检测的阳性对照(图4A~B)。

图4 MC-LR 诱导Kupffer 细胞焦亡率升高
3 讨论
本课题组前期研究[17]发现:以灌胃的方式将MCLR 暴露于小鼠后,MC-LR 主要在肝组织聚集并诱导肝组织发生NLRP3 炎症小体活化介导的炎性损伤。NLRP3 炎症小体在巨噬细胞高表达,以往大多数研究[19-22]将NLRP3 炎症小体的功能分析聚焦于巨噬细胞;而肝实质细胞占肝细胞群体的60%~80%并且高表达MC-LR 吸收所必须的有机阴离子转运多肽。因此,本研究在前期研究基础上,从小鼠肝脏分离肝实质细胞和肝固有巨噬细胞,即Kupffer 细胞,检测MC-LR 处理后NLRP3 以及NLRP3 炎症小体活性相关蛋白的表达,意欲明确MC-LR 诱导NLRP3 炎症小体活化发生的肝组织细胞类型。结果表明,MC-LR 可进入肝实质细胞和Kupffer 细胞,并诱导肝实质细胞和Kupffer 细胞发生NLRP3 炎症小体活化。然而,不论从MC-LR 处理的浓度和还是从作用的时间分析,肝实质细胞对MC-LR 的吸收和敏感程度均明显高于Kupffer 细胞。因此,对于MC-LR而言,肝实质细胞可能是NLRP3 炎症小体活化发生的主体细胞。后续研究将从MC-LR 染毒小鼠中分离肝实质细胞和Kupffer 细胞,进一步明确MC-LR诱导肝损伤中NLRP3 炎症小体活化的细胞类型。
本课题前期研究[17]在MC-LR 诱导的NLRP3 炎症小体活化的小鼠肝组织中发现,具有活性的炎症因子IL-1β(P17)显著增高。众所周知,IL-1β 主要由Kupffer 细胞分泌,提示Kupffer 细胞的活化参与了MC-LR 诱导的NLRP3 炎症小体肝损伤。本研究从小鼠肝组织中分离肝Kupffer 细胞,虽然经过鉴定采用本方法提取的肝Kupffer 细胞中含有其他的非实质细胞,但是经免疫荧光双标法检测发现,MC-LR 诱导后NLRP3 主要在肝Kupffer 细胞中表达增高;相反,其他未被肝Kupffer 细胞标志蛋白F4/80 染色的细胞NLRP3 表达较低。这一结果提示,MC-LR 诱导NLRP3 炎症小体的活化发生在肝Kupffer 细胞而非其他肝脏非实质细胞。与其他程序性死亡方式不同,焦亡主要是由炎症小体蛋白复合物活化Caspase-1介导的促炎性细胞死亡。本研究在发现MC-LR 诱导肝Kupffer 细胞发生NLRP3 炎症体活化裂解Caspase-1 的基础上,进一步证实MC-LR 可诱导该细胞焦亡。上述结果表明NLRP3 炎症小体介导肝Kupffer 细胞焦亡参与了MC-LR 诱导的肝脏炎性损伤。
综上所述,肝实质细胞和Kupffer 细胞是MC-LR诱导肝组织NLRP3 炎症小体活化依赖性肝损伤的主要细胞类型。鉴于肝实质细胞对MC-LR 的敏感性推测机制为:MC-LR 经灌胃的方式染毒小鼠,首先诱导肝实质细胞发生NLRP3 炎症小体活化,继而通过释放少量炎症因子IL-1β 激活Kupffer 细胞,活化的Kupffer 细胞释放大量的IL-1β,进一步加重MC-LR 诱导肝实质细胞的损伤,即肝实质细胞和Kupffer 细胞通过IL-1β 介导的“crosstalk”效应,将MC-LR 诱导肝脏炎性损伤效应放大。在后续实验将从正常小鼠和MC-LR 损伤模型鼠分别提取肝实质细胞和Kupffer 细胞,通过建立co-culture 模型,研究肝实质细胞和Kupffer 细胞之间的“crosstalk”效应以及IL-1β 对该效应的介导作用。
