卡瑞利珠单抗联合阿帕替尼治疗晚期肝癌的疗效与安全评价
2022-03-02付吕平刘卫红杨晨祁卫华崔芹玲魏琦张贵平郭志远
付吕平 刘卫红 杨晨 祁卫华 崔芹玲 魏琦 张贵平 郭志远
根据2018年的全球癌症统计数据,2018年全球共有80余万新发肝癌病例,中国肝癌发病例数占全球的46.71%,而5年生存率仅为10%左右[1],是发病率及死亡率均较高的恶性肿瘤之一。肝癌常见的治疗方式有手术、介入、消融、放疗、化疗、靶向治疗等,虽然治疗方式多种多样,但留给晚期肝癌患者的选择并不多。肝癌作为富血供肿瘤,多种抗血管生成药物均取得了一定疗效。其中甲磺酸阿帕替尼是抗VEGFR-2小分子靶向药物,卡瑞利珠单抗作为国产抗PD-1抗体,在肝癌的治疗上取得一定疗效,两者的联合治疗也已被列入指南推荐。本研究主要观察卡瑞利珠单抗和阿帕替尼联合治疗在晚期肝癌患者中的疗效和安全性。
1 资料与方法
1.1 一般资料 本研究回顾性分析2019年8月至2020年9月邯郸市中心医院的晚期原发性肝癌患者22例。本研究经邯郸市中心医院医学伦理委员会批准,所有患者及其家属均签署知情同意书。
1.2 纳入与排除标准 纳入标准:(1)经本院确诊为肝癌晚期患者;(2)根据实体肿瘤的疗效评价标准RECIST 1.1,有≥1个可测量病灶。排除标准:(1)既往接受过其他免疫治疗药物;(2)转移性肝癌;(3)合并有严重内科疾病;(4)对卡瑞利珠单抗和阿帕替尼过敏者;(5)随访时间少于1年的患者。
1.3 治疗方法 所有患者给予卡瑞利珠单抗(苏州盛迪亚生物医药有限公司,200 mg/瓶,和甲磺酸阿帕替尼(江苏恒瑞医药股份有限公司,250 mg×10片)联合治疗。甲磺酸阿帕替尼250 mg/次,1片/d,口服;卡瑞利珠单抗200 mg,静脉滴注,21 d为1个疗程,最少持续3个疗程,1个疗程治疗后评估患者效果,3个月后随访。给药过程中密切监测并记录药物不良反应。
1.4 观察指标 肿瘤疗效评估根据RECIST 1.1标准,分别为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)及疾病进展(PD),病灶完全消失且良性结果维持 4 周以上为CR;肿瘤缩小一半以上且良性结果维持 4 周及以上为PR;肿瘤体积缩小<50%或增大<20%SD;肿瘤体积增大≥20%为PD。疾病缓解率(ORR)定义为CR+PR/总人数×100%,疾病控制率(DCR)定义为CR+PR+SD/总人数×100%。评估无进展生存期(PFS)和总体生存率(OS),PFS定义为应用卡瑞利珠单抗联合阿帕替尼开始至肿瘤进展或死亡的时间。不良反应评估:记录用药期间高血压、免疫性肺炎、皮肤毛细血管增生症、乏力等不良反应发生率。
1.5 随访 随访时间自首治日期至患者死亡或末次随访日期。随访方式包括门诊复查、 再次入院、电话、信访等。随访截止日期为2020年9月16日。
1.6 统计学分析 应用SPSS 21.0统计软件,Kaplan—Meier法计算PFS、OS,Log-rank检验进行单因素分析,多因素Cox回归模型进行多因素分析,P<0.05为差异有统计学意义。
2 结果
2.1 患者基线资料 22例晚期肝癌患者中,男患者13例,女9例;年龄43~78岁,其中≥60岁15例,<60岁7例;有乙肝病史者为21例,无乙肝病史者为1例;肿瘤直径≤5 cm者5例,5~10 cm者12例,>10 cm者5例;Child-pugh分级:A级12例,B级10例;甲胎蛋白基线水平(AFP)≥400 μg/L 6例,<400 μg/L 16例;既往接受过局部治疗者为12例,未接受过局部治疗者为10例;有癌栓者为10例,无癌栓者为12例。见表1。
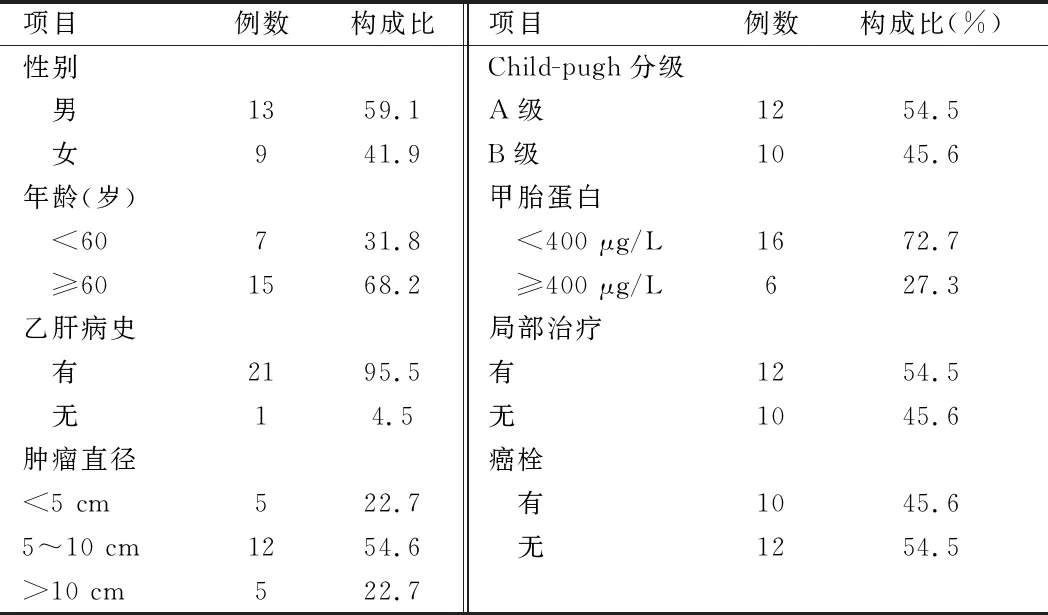
表1 患者基线资料
2.2 临床疗效
2.2.1 疗效:患者均为接受卡瑞利珠单抗联合甲磺酸阿帕替尼治疗后1年,其中疗效评价PR 6例,SD 6例,PD 10例;ORR为27.3%(6/22),DCR为54.5%(12/22)。见表2。

表2 22例晚期肝癌患者联合治疗后的疗效评价
2.2.2 生存曲线:22例患者的mPFS为 7.9个月,多数患者仍在随访中,中位生存时间尚未达到,绘制Kaplan-Meier 生存曲线。见图1。
2.3 不良反应 22例患者中有发生不良反应20例,发生率90.9%;其中3级及以上不良反应发生率为59.1%(13/22),包括高血压3例、手足综合征1例、乏力4例、皮肤毛细血管增生症5例。因不良反应减少药量10例,无患者因毒性反应停药或死亡。
3 讨论
近年来,靶向治疗和免疫治疗作为新兴的癌症治疗方式,越来越受到重视。现阶段,已应用在肝癌治疗的免疫治疗主要有免疫检查点抑制剂、过继细胞免疫治疗、肿瘤疫苗等。免疫检查点抑制剂通过解除免疫细胞与肿瘤细胞的受体配体结合,激活免疫细胞的免疫活性,从而达到杀伤肿瘤细胞的目的。在肝癌的免疫检查点抑制剂中,主要靶点为程序性死亡受体 1(PD-1)/PD-L1 和细胞毒性T淋巴细胞相关抗原4(CTLA-4)。程序性死亡受体通过调节PD-1和PD-L1之间的相互作用,恢复淋巴细胞的活性,抑制肿瘤细胞的生长和增殖。程序性死亡受体在头颈部肿瘤、淋巴瘤、黑色素瘤等癌种上,已有多项成熟的研究并获批准[2,3]。
PD-1抑制剂通过抑制免疫检查点通路中程序性细胞死亡蛋白-1(programmed death-1,PD-1),上调T细胞的生长和增殖,增强 T细胞对肿瘤细胞的识别,激活其攻击和杀伤功能,通过调动人体自身的免疫功能实现抗肿瘤的作用[4,5]。多项研究均显示,PD-1抑制剂在晚期肝癌的治疗上起到较好的效果。其中CheckMate 040研究显示,使用纳武单抗治疗的晚期肝癌患者ORR达20%[6],KEYNOTE-224研究也显示,帕博利珠单抗在晚期肝癌的ORR可达17%[7]。部分患者甚至可以达到长时间的疾病缓解状态。并且相对于传统治疗,不良反应少,且对肝功能的要求更低。因此,多项指南均批准PD-1抑制剂用于肝癌治疗。卡瑞利珠单抗是国产的PD-1抗体,该药于2019年批准上市,是首个批准于肝癌治疗的国产PD-1抑制剂[12]。卡瑞利珠单抗也被2019版国家肝癌诊疗规范纳入推荐[13],现已被批准治疗的肿瘤有霍奇金淋巴瘤、晚期肝细胞癌、晚期食管鳞癌、非小细胞肺癌等[14,15],并且都具有很好的疗效。
靶向治疗和免疫治疗两种治疗方式的结合有较明确的理论基础。肿瘤的靶向治疗是在癌细胞的分子层面作用于细胞信号转导通路、抑癌基因、原癌基因等环节,从而逆转癌细胞的生长。肝癌的靶向治疗主要有血管生成抑制剂类和多激酶抑制剂类。众所周知,原发性肝癌为富血供肿瘤,肿瘤细胞通过生成血管内皮生长因子促进血管的生成,从而为肿瘤细胞的生长传递大量营养,大量新生血管也为肿瘤细胞的转移制造了便利。血管生成抑制剂可以延缓甚至抑制肿瘤新生血管的生成,达到抑制肿瘤细胞生长的目的。肝癌的靶向治疗虽然为晚期肝癌患者延长了生存时间,但其劣势在于副作用大,有效率不够高以及耐药的问题。于是,多种药物的联合应用乃至多学科的参与才是晚期肝癌治疗的新希望。有研究显示,抗血管生成药安罗替尼与免疫治疗的联用可改善肿瘤患者的预后[12],但阿帕替尼与卡瑞利珠单抗的组合在肝癌患者的研究尚不多见。
免疫抑制剂对多种肿瘤都带来了一定的效果,改善了患者的生存。但伴随的免疫相关不良反应也为治疗带来一定的隐患,通常可影响多个脏器,较严重的有免疫性心肌炎、免疫性肺炎等[13,14]。而皮肤毛细血管增生症是卡瑞利珠单抗最常见的不良反应之一,其主要影响皮肤真皮层的毛细血管,虽发病机制尚不明确,但有研究称可能与血管生成促成剂和抑制剂之间的不平衡有关[15]。本研究中皮肤毛细血管增生症发生率约为30%,且不影响患者生存质量。高血压也是免疫治疗联合靶向治疗中常见的不良反应之一。于是要求患者治疗前监测基础血压,治疗过程中持续监测血压,若出现药物不能控制的高血压,需要减少联合用药剂量或者更换方案。
本研究初步显示,PD-1抑制剂卡瑞利珠单抗联合阿帕替尼治疗晚期肝癌的临床疗效好,不良反应尚可耐受,是安全有效的方案。但本研究为回顾性研究,各组患者基线水平未完全匹配,且样本量较少,治疗时间短,仍需扩大样本量深入研究。此外,大部分患者在截止随访时仍处于存活或者有效状态,OS需进一步随访观察。因此,卡瑞利珠单抗联合阿帕替尼治疗晚期肝癌的疗效尚需要进一步证实。
