miR-27b-3p调控OPA1表达对心力衰竭模型心肌细胞线粒体融合的影响
2022-03-02郝春媛李同华任洋张誉洋
郝春媛 李同华 任洋 张誉洋
心力衰竭,是不同类型心血管疾病的终末阶段,其发病率和死亡率高,且有逐年增加的趋势,对人类健康威胁极大[1]。研究表明线粒体结构和功能的异常与心力衰竭的发展有关,而线粒体融合与分裂的动态平衡是线粒体发挥正常功能的基础[2]。心力衰竭的主要病理过程是心肌重构,而线粒体分裂时氧化能力及三磷酸腺苷(ATP)的降低是导致心肌重构发生的主要原因[3]。文献显示微小RNA(miRNA)不仅能够参与调控心肌细胞的生物学行为,还能影响心血管疾病的进程[4]。miR-27b-3p是miR-27家族的一员,其在癌细胞中研究较多,只有袁淑菁等[5]发现miR-27b-3p过表达可促进心肌成纤维细胞纤维化。生物信息学预测发现视神经萎缩蛋白1(optic atrophy protein-1,OPA1)与miR-27b-3p可能存在靶向关系。OPA1是线粒体融合蛋白的一种,研究表明OPA1在心力衰竭模型心肌细胞中下调表达[6]。因此,本研究通过建立心力衰竭模型,观察miR-27b-3p的表达情况,并探讨其对心肌细胞线粒体融合的影响及可能的作用机制,以期为心力衰竭的临床治疗提供新的靶点和参考依据。
1 材料与方法
1.1 主要试剂与仪器 miR-27b-3p antagomir及阴性对照antagomir NC、miR-27b-3p inhibitor及阴性对照inhibitor NC、miR-27b-3p mimics及阴性对照mimics NC、OPA1 siRNA及其对照siRNA NC由上海生工生物公司提供;戊巴比妥钠购自海江莱生物科技有限公司;台氏液、无钙台氏液购自上海抚生实业有限公司;DMEM培养基、实时荧光定量PCR(qRT-PCR)试剂盒购自北京索莱宝生物公司;Lipofectamine 2000转染试剂购自上海笃玛生物科技有限公司;双荧光素酶检测试剂盒购自上海翌圣生物公司;ATP、ROS、JC-1试剂盒购自上海懋康生物科技有限公司;OPA1、线粒体融合蛋白(mitofusion,MFN)1、MFN2、电压依赖性阴离子通道1(voltage-dependent anion channel 1,VDAC-1)、细胞色素C氧化酶Ⅳ亚型(Cytochrome C oxidase Ⅳ subtype,COXⅣ)、线粒体转录因子A(Mitochondrial transcription factor A,Tfam)、过氧化物酶体增殖物激活受体Y辅激活因子1(peroxisome proliferator-activated receptor-γ coactivator-1α,PGC-1α)、自噬标志蛋白Beclin-1、B淋巴细胞瘤-2基因/腺病毒E1B相互作用蛋白3(B lymphocytoma-2 gene/adenovirus E1B interaction protein 3,Bnip3)一抗及对应二抗购自美国ABCam公司。透射电镜购自北京欧波同光学技术有限公司;超薄切片机购自沈阳恒松科技有限公司;二氧化碳培养箱购自山东博科科学仪器有限公司;qRT-PCR仪购自美国ABI公司;小型动物呼吸机购自上海玉研科学仪器有限公司;凝胶成像仪购自北京鸿涛基业科技发展有限责任公司;荧光分光光度计购自上海仪电分析仪器有限公司。
1.2 实验动物 清洁级健康SD雄性大鼠60只,体重为(200.14±10.37)g,由康泰医学检验服务河北有限公司提供,实验动物许可证号为SYXK(冀)2021-006。大鼠均饲养于我院清洁级动物实验中心。本研究通过医院动物伦理委员会许可。
1.3 动物分组、造模与干预方法 大鼠适应性喂养3 d 后,随机分成Sham组、model组、antagomir NC组和miR-27b-3p antagomir组,每组15只。Sham组除外,其他3组大鼠均按照Lu等[7]的研究方法制备心力衰竭大鼠模型:将麻醉后的大鼠与心电图连接进行肢体导联,然后打开左侧胸腔,于左心耳根部结扎左冠状动脉前降支,心电监测显示ST段弓背型抬高,说明模型制备成功。手术后为预防感染,所有大鼠每天肌内注射15×104U/kg青霉素,连续3 d。Sham组大鼠仅开胸但不结扎,其他操作与上述方法一致。造模完成后,antagomir NC组和miR-27b-3p antagomir组大鼠于尾静脉分别注射antagomir NC和miR-27b-3p antagomir,而Sham组和model组大鼠注射等量的质量体积分数为9%的氯化钠溶液,2次/周,连续4周。
1.4 透射电镜观察心肌组织线粒体结构变化 4周后,4组大鼠实施安乐死,把心脏取出,剪取心尖位置的心肌组织,快速进行固定,备成70 nm左右的石蜡切片,分别用2%醋酸双氧铀和柠檬酸铅进行染色,室温下晾干,最后在透射电镜下观察各组大鼠心肌组织线粒体结构并拍照保存。
1.5 细胞实验
1.5.1 大鼠心肌细胞的分离与培养:将大鼠心脏取出,去除心包膜的心脏主动脉与离体心脏灌流装置进行插管连接,依次进行台氏液、无钙台氏液灌流,待心脏跳动停止后使用胶原酶Ⅱ和含胎牛血清的无钙台氏液对胶原组织进行消化,等到心脏颜色变淡时,取其左心室组织并放置在KB液中,通过移液枪吸打将单个心肌细胞分离出来。在37℃下,将心肌细胞置于DMEM培养基上,在5%二氧化碳培养箱中培养。
1.5.2 心力衰竭细胞模型构建与分组:在心肌细胞中加入100 μl体积分数为0.8%的戊巴比妥钠[8](用不含胎牛血清的DMEM培养基溶解),培养10 min,显微镜下观察,细胞停止搏动说明心力衰竭细胞模型制备成功。将模型构建成功的心肌细胞随机分成model组(不转染)、inhibitor NC组(转染inhibitor NC)、miR-27b-3p inhibitor组(转染miR-27b-3p inhibitor组)、miR-27b-3p inhibitor+siRNA NC组(共转染miR-27b-3p inhibitor和siRNA NC)和miR-27b-3p inhibitor+OPA1 siRNA组(共转染miR-27b-3p inhibitor和OPA1 siRNA),另取正常培养的细胞作为Control组。
1.5.3 qRT-PCR检测miR-27b-3p和OPA1 mRNA水平:分别提取1.3中大鼠心肌组织与1.5.2中大鼠心肌细胞的总RNA,然后反转录成cDNA,按照qRT-PCR试剂盒和仪器的使用说明进行PCR扩增。miR-27b-3p正向引物5’-GGGGTTCACAGTGGCTAAG-3’,反向引物5’-CAGTGCGTGTCGTGGAGT-3’;U6引物序列为:正向引物5’-CTCGCTTCGGCAGCACA-3’,反向引物5’-AACGCTTCACGAATTTGCGT-3’;OPA1正向引物5’-TCACTGCGGGTACACCTGG-3’,反向引物5’-CTGACACCTTCCTATAGTGCTTGT-3’;GAPDH引物序列为:正向引物5’-GGCAAGTTCAACGGCACAG-3’,反向引物5’-CGCCAGTAGACTCCACGACAT-3’。根据2-ΔΔCt法计算miR-27b-3p和OPA1 mRNA的相对表达量,U6或GAPDH为内参基因。
1.5.4 双荧光素酶实验检测miR-27b-3p和OPA1的靶向关系:Targetscan 7.2在线网站预测发现OPA1是miR-27b-3p的潜在靶基因。构建野生型(WT-OPA1)和突变型(MUT-OPA1)载体,利用Lipofectamine 2000转染试剂将其分别与mimics-NC或miR-27b-3p mimics共转染至心肌细胞,孵育48 h。然后使用双荧光素酶报告基因检测系统检测其酶活。
1.5.5 荧光素酶发光法检测线粒体ATP合成活力:差速离心法分离4组心肌细胞线粒体,制备成悬液,根据试剂盒的说明书方法处理,并使用荧光分光光度计检测其荧光强度,并计算ATP合成活力。
1.5.6 DCFH-DA荧光染料检测线粒体ROS水平:按照ROS试剂盒方法处理线粒体悬液,加入DCFH-DA试剂,分别在488 nm和525 nm波长处检测其荧光强度,以其荧光强度的比值代表ROS水平。
1.5.7 JC-1荧光探针法检测线粒体膜电位:将JC-1染色液与线粒体悬液均匀混合,10 min后分别检测590 nm及527 nm处的荧光强度,并计算膜电位变化(ΔΨm)值,以两处波长处的荧光强度比值表示。
1.5.8 Western blot检测线粒体动力蛋白及心肌相关蛋白表达:各组心肌细胞裂解后,提取其中总蛋白,定量后经凝胶电泳将蛋白分离,然后进行转膜和封闭,分别加入稀释后的OPA1、MFN1、MFN2、VDAC-1、COXIV、Tfam、PGC-1α、Beclin-1、Bnip3一抗,次日再加入稀释后的二抗,静置1 h,添加化学发光试剂进行显影,最后使用Image J软件分析蛋白表达情况。

2 结果
2.1 miR-27b-3p antagomir对大鼠线粒体结构的影响 与Sham组相比,model组大鼠线粒体呈不规则排列,且有明显的肿胀,大多数线粒体嵴出现模糊、断裂或者缺失的现象,antagomir NC组大鼠线粒体的形态与model组大鼠类似;与model组和antagomir NC组相比,miR-27b-3p antagomir组大鼠线粒体明显增多,线粒体膜和嵴的结构均恢复完整。见图1。


Sham组model组antagomir NC组miR-27b-3p antagomir组
2.2 miR-27b-3p、OPA1 mRNA在4组大鼠心肌组织中的表达水平 与Sham组比较,model组大鼠心肌组织中miR-27b-3p表达明显增加,OPA1 mRNA表达明显减少(P<0.05);与model组和antagomir NC组比较,miR-27b-3p antagomir组大鼠心肌组织中miR-27b-3p表达明显减少,OPA1 mRNA表达明显增加(P<0.05)。见表1。

表1 miR-27b-3p、OPA1 mRNA在4组大鼠心肌组织中的表达水平
2.3 miR-27b-3p、OPA1 mRNA在4组大鼠心肌细胞中的表达水平 model组大鼠心肌细胞中miR-27b-3p表达低于Control组高,OPA1 mRNA表达比Control组低(P<0.05);miR-27b-3p inhibitor组大鼠心肌细胞中miR-27b-3p表达高于model组和inhibitor NC组明显变低,OPA1 mRNA表达比model组和inhibitor NC组(P<0.05)。见表2。

表2 miR-27b-3p、OPA1 mRNA在4组大鼠心肌细胞中的表达水平
2.4 miR-27b-3p靶向调节OPA1蛋白表达 Targetscan 7.2在线网站预测结果显示,miR-27b-3p和OPA1存在互补的结合位点,与mimics NC+WT-OPA1组相比,miR-27b-3p mimics+WT-OPA1组相对荧光素酶活性明显变低(P<0.05);与mimics NC+MUT-OPA1组相比,miR-27b-3p mimics+MUT-OPA1组相对荧光素酶活性变化不大(P>0.05)。与mimics NC组比较,miR-27b-3p mimics组OPA1蛋白显著上调(P<0.05);与inhibitor NC组比较,miR-27b-3p inhibitor组OPA1蛋白显著下调(P<0.05)。见图2、3,表3、4。

图2 miR-27b-3p和OPA1的作用位点
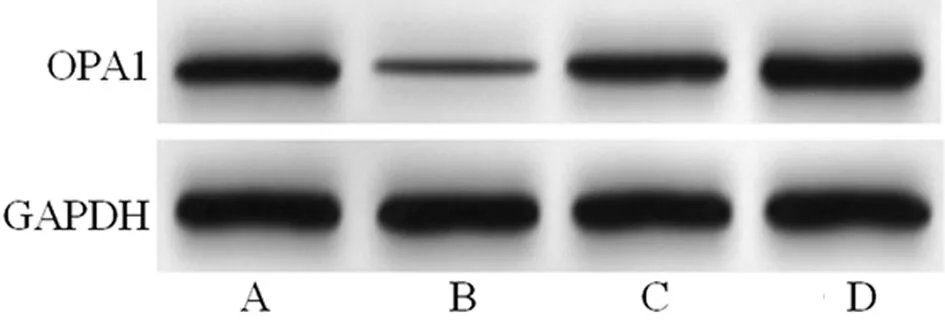
图3 4组大鼠心肌细胞中OPA1蛋白表达比较;A mimics NC组;B miR-27b-3p mimics组;C inhibitor NC组;D miR-27b-3p inhibitor组

表3 双荧光素酶实验

表4 miR-27b-3p靶向调节OPA1蛋白表达
2.5 miR-27b-3p inhibitor及OPA1 siRNA对6组心肌细胞中ATP、线粒体ROS及ΔΨm的影响 与Control组相比,model组线粒体ROS水平显著上升,ATP和ΔΨm显著下降(P<0.05);与model组和inhibitor NC组比较,miR-27b-3p inhibitor组线粒体ROS水平明显下降,ATP和ΔΨm明显上升(P<0.05);与miR-27b-3p inhibitor+siRNA NC组和miR-27b-3p inhibitor组相比,miR-27b-3p inhibitor+OPA1 siRNA组线粒体ROS水平明显增加(P<0.05),ATP和ΔΨm明显减小(P<0.05)。见表5。

表5 miR-27b-3p inhibitor及OPA1 siRNA对6组心肌细胞中ATP、线粒体ROS及ΔΨm的影响
2.6 miR-27b-3p inhibitor及OPA1 siRNA对6组心肌细胞中线粒体动力蛋白表达的影响 model组OPA1、MFN1、MFN2蛋白水平均显著低于Control组(P<0.05);miR-27b-3p inhibitor组OPA1、MFN1、MFN2蛋白水平显著高于model组和inhibitor NC组(P<0.05);miR-27b-3p inhibitor+OPA1 siRNA组OPA1、MFN1、MFN2蛋白水平明显比miR-27b-3p inhibitor+siRNA NC组低(P<0.05),而miR-27b-3p inhibitor+siRNA NC组和miR-27b-3p inhibitor组间蛋白表达差异无统计学意义(P>0.05)。见图4,表6。

图4 6组心肌细胞中线粒体动力蛋白表达比较;A Control组;B model组;C inhibitor NC组;D miR-27b-3p inhibitor组;E miR-27b-3p inhibitor+siRNA NC组;F miR-27b-3p inhibitor+OPA1 siRNA组
2.7 miR-27b-3p inhibitor及OPA1 siRNA对6组心肌细胞中心肌相关蛋白表达的影响 与Control组相比,model组VDAC-1、COXIV、Tfam、PGC-1α蛋白表达明显下调,Beclin-1、Bnip3蛋白表达明显上调(P<0.05);与model组和inhibitor NC组比较,miR-27b-3p

表6 miR-27b-3p inhibitor及OPA1 siRNA对6组心肌细胞中线粒体动力蛋白表达的影响
inhibitor组VDAC-1、COXIV、Tfam、PGC-1α蛋白表达明显上调,Beclin-1、Bnip3蛋白表达明显下调(P<0.05);与miR-27b-3p inhibitor+siRNA NC组和miR-27b-3p inhibitor组相比,miR-27b-3p inhibitor+OPA1 siRNA组VDAC-1、COXIV、Tfam、PGC-1α蛋白表达显著下调,Beclin-1、Bnip3蛋白表达显著上调(P<0.05)。见图5,表7。
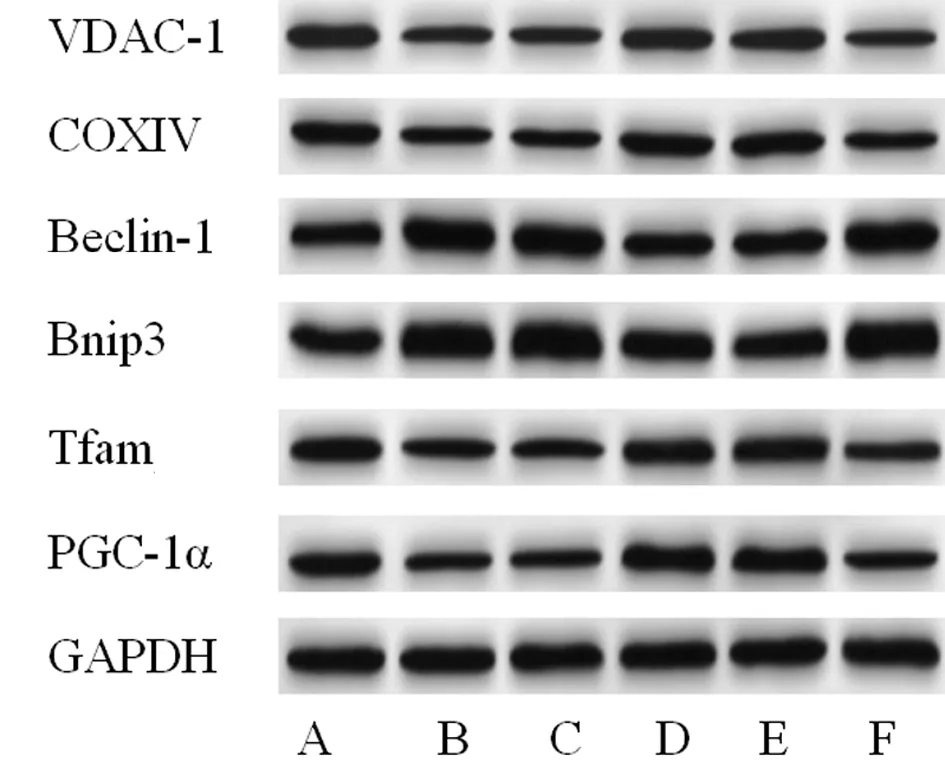
图5 6组心肌细胞中心肌相关蛋白表达比较;A Control组;B model组;C inhibitor NC组;D miR-27b-3p inhibitor组;E miR-27b-3p inhibitor+siRNA NC组;F miR-27b-3p inhibitor+OPA1 siRNA组

表7 miR-27b-3p inhibitor及OPA1 siRNA对6组心肌细胞中心肌相关蛋白表达的影响
3 讨论
心力衰竭是心血管疾病发展至严重阶段的一种临床综合征,主要由呼吸道感染、心律失常等引起,临床上的症状为呼吸困难、乏力、咳嗽等。目前临床上常通过手术或者药物治疗缓解心力衰竭患者的病症,但无法将其治愈。因此,寻找合适的靶点、降低心力衰竭患者的病死率是临床上治疗心力衰竭的关键。
据报道,miR-27b-3p可作为生物标志物,在肾纤维化[9]、心肌梗死后血管再生[10]、心房纤维化[11]等方面起调控作用。相关研究显示,线粒体结构改变和功能障碍不仅对心脏功能有损害作用,还能加速心力衰竭发展[12]。线粒体融合能使受损的线粒体得到修复,从而恢复心脏功能,减缓心力衰竭过程。本研究结果显示,心力衰竭模型大鼠心肌组织中miR-27b-3p显著上调,线粒体结构损伤严重;通过miR-27b-3p antagomir下调miR-27b-3p表达后,线粒体形态得到恢复,数量也明显增加,提示miR-27b-3p下调表达可促进心肌细胞线粒体融合,从而保护心脏功能。
线粒体是向心肌细胞提供能量和产生ROS的重要场所,心力衰竭时线粒体结构被破坏,功能也受到阻碍,导致ROS过度聚集,ATP大量流失,进而刺激心肌细胞凋亡。研究发现心肌细胞线粒体跨膜电位的降低能够使心脏功能受损,从而促进心力衰竭[13]。本研究通过构建心力衰竭细胞模型发现,model组miR-27b-3p表达明显升高,该结果与miR-27b在缺氧复氧心肌细胞中的结果[14]类似;miR-27b-3p inhibitor处理能够显著降低model组心肌细胞线粒体ROS水平,升高ATP和ΔΨm(P<0.05),揭示抑制miR-27b-3p表达可通过恢复线粒体功能保护心肌细胞免受损伤。VDAC-1定位于线粒体外膜,参与调节细胞代谢、线粒体凋亡等过程。研究发现VDAC-1在急性心肌梗死大鼠模型中明显降低[15]。牟连伟等[16]发现COXIV上调表达有助于改善阿尔兹海默病模型小鼠中枢神经元线粒体通透性转换孔功能。PGC-1α参与调节线粒体生物合成,能够激活下游靶基因表达。Bnip3、Beclin-1是调控线粒体自噬的关键蛋白,二者表达升高,自噬水平增强[17]。本研究结果显示,model组OPA1、MFN1、MFN2、VDAC-1、COXIV、Tfam、PGC-1α蛋白显著降低,Beclin-1、Bnip3蛋白表达显著升高(P<0.05);miR-27b-3p inhibitor干预后,上述蛋白水平均得到逆转,说明miR-27b-3p沉默能够通过调节相关蛋白表达保护线粒体功能,抑制自噬,进而缓解心力衰竭。
Targetscan 7.2网站预测结果显示OPA1是miR-27b-3p的靶基因。有研究发现OPA1表达提高有助于改善线粒体功能,对压力过载诱导的心力衰竭有保护作用[18]。本研究结果显示,心力衰竭模型心肌细胞中OPA1均显著下调表达,这可能使导致线粒体断裂的原因之一,提示OPA1对线粒体融合有非常重要的作用。双荧光素酶实验结果显示,共转染miR-27b-3p mimics和WT-OPA1至心肌细胞时相对荧光素酶活性显著降低;此外,上调或下调miR-27b-3p时,OPA1蛋白表达明显降低或升高(P<0.05),提示miR-27b-3p直接负向调控OPA1蛋白表达。在抑制miR-27b-3p表达的基础上沉默OPA1表达,戊巴比妥钠诱导的心肌细胞OPA1、MFN1、MFN2、VDAC-1、COXIV、Tfam、PGC-1α下调,Beclin-1、Bnip3上调,线粒体ROS升高,ATP和ΔΨm降低(P<0.05),上述各项指标差异均有统计学意义,提示抑制miR-27b-3p对心力衰竭模型心肌细胞线粒体融合的促进作用与靶向负调控OPA1蛋白表达有关。
综上所述,miR-27b-3p在心力衰竭模型心肌组织中高表达,抑制miR-27b-3p促进心肌细胞线粒体融合,其机制与负向调节OPA1蛋白水平有关,为心力衰竭的临床治疗提供参考依据。
