沉默miR-210对非小细胞肺癌大鼠的干预效果及作用机制研究
2022-03-02贾依登肯加别克罗琴曹国磊叶斯波力塔斯恒
贾依登·肯加别克 罗琴 曹国磊 叶斯波力·塔斯恒
非小细胞肺癌是指除小细胞肺癌以外的所有肺上皮癌的疾病。现在医学将肺癌分为非小细胞肺癌和小细胞肺癌两种,其中比较多见的是鳞状细胞癌、大细胞癌以及腺癌等等[1,2]。其发病的因素主要是受到吸烟行为的影响,由于其对放疗、化疗等治疗敏感度较低,所以治疗效果不甚理想,目前对于该病的治疗一般采用手术方式切除[3,4]。非小细胞肺癌的发病速度、癌症扩散速度与小细胞癌相比较慢,但是一般发现即是晚期,非常难以控制和治疗[5]。近年来非小细胞肺癌的发病率越来越高,对于该病的治疗引起了众多学者的研究[6]。微小RNA(miRNA)在该病的发生发展中具有重要作用,miR-210是目前已知的可能与miR-210相关mRNA,目前关于miR-210与非小细胞肺癌病情的相关研究鲜少[7]。基于上述背景,在本文中分析上调微小RNA-210(miR-210)对非小细胞肺癌模型大鼠的影响,以明确miR-210是否参与此病的发生进展,为临床上此病的诊治提供参考。
1 材料与方法
1.1 材料 本研究选取40只SD健康雄性大鼠[河北中旭检验检测技术有限公司,动物使用许可证号:SYXK(冀)2020-009],鼠龄7~10周,平均(8.6±1.2)周;体重216~240 g,平均(227.9±9.6)g。所有大鼠于(23.8±3.1)℃、湿度50%左右、循环12 h灯光(光照/黑暗)环境中喂养。
1.2 方法
1.2.1 建模及分组:随机挑选10只大鼠为正常组,不做任何处理。其余30只分别建立鳞状细胞癌、腺癌、大细胞癌大鼠肺癌模型,用Hank’s液将鳞状细胞癌、腺癌、大细胞癌细胞调至浓度为1×106/ml的细胞混悬液,并在每只大鼠背经脉注射0.2 ml,以制备3种非小细胞肺癌模型各15只,连续饲养7 d。模型动物分为模型组、上调组和沉默组,每组筛选9只。模型组予背静脉注射0.9%氯化钠1 ml;上调组大鼠尾部静脉注射30 mg/kg agoCARD9,下调组大鼠尾部静脉注射30 mg/kg antagoCARD9,均连续给药7 d。
1.2.2 HE染色:实验结束后,采集静脉血,离心,取上清,-20℃保存备用。立即处死大鼠,取肺组织,4%多聚甲醛中固定,置于-80℃冰箱中保存待用。肺组织制备常规石蜡切片后每组取部分切片经脱蜡、水化处理后,苏木精染色,盐酸乙醇分化至返蓝,乙醇伊红复染后脱水,透明,封片固定,光学显微镜观察。
1.3 指标观察
1.3.1 血清VEGF及肺转移灶最长径测定:采用酶联免疫吸附法测定VEGF水平,试剂盒均购自山东一达生物科技有限公司。严格按照ELISA试剂说明书步骤操作,将标本血清室温放置30 s,备置标准血清及溶液,配置300 μl洗板液洗板30 s,倒出,微孔拍干,将50 μl检测缓冲液、50 μl标准液及样本和检测抗体放置微孔里,封板,1 000 r/min震荡,(37℃)孵育2 h,洗板,酶标记物100 μl导入检测孔,封板,1 000 r/min转速震荡,放置恒温室温内45 min,洗板,100 μl底物液导入微孔,遮光孵育30 min,加入100 μl终止液,摇晃均匀,使用酶标仪在450 nm处测吸光值。

1.3.3 miR-210表达检测:采用实时荧光定量PCR法测定。细胞转染成功,Trizol法提取细胞中总RNA,应用mRNA逆转录试剂盒行逆转录获得cDNA,GAPDH为内参,提取细胞总RNArimer5.0软件设计引物反应条件:96℃ 5 min、96℃ 30 s、55℃退火 30 s,72℃延伸,35个循环,2-ΔΔCt方法计算目的基因相对表达量。实验重复3次,取平均值。miR-210上游引物:5’-ATGGTTCGTGGGAGCCCCTGCCCACCGCA-3’;下游引物:5’-GTGCAGGGTCCGAGGT-3’。以U6为内参,U6上游引物:5’-CTCGCATCGCGTAAGGCACA-3’;下游引物:5’-AACGCTACTCGAATTAGCGT-3’。
1.3.4 PI3K/Akt/HIF-1a通路蛋白相对表达量对比:采用Western Blot法测定,对所有收集并培养的细胞进行离心、蛋白提取,然后使用BCA做蛋白定量测定,将50 μg蛋白加入至2×SDS凝胶缓冲液中,转膜、取膜、固定、做电泳1.5 h封闭处理,以1∶1 000的比例将TBST稀释的PI3K/Akt/HIF-1a一抗,在4℃的环境中孵育过夜,TBST反复3次洗膜,将1∶10 000 TBST稀释的二抗加入,摇动孵育1 h,TBST反复3次洗膜,DAB做显色处理,对此并分析蛋白表达水平,以GAPDH蛋白为内参。

2 结果
2.1 4组大鼠非小细胞肺癌组织病理学观察 正常组大鼠肺组织细胞结构完好,无充血、水肿等病理变化,无炎性细胞浸润;模型组、上调组大鼠肺组织细胞排列无规则,且大量坏死,充血、水肿、炎性细胞浸润情况较明显;下调组大鼠肺组织细胞坏死、充血、水肿、炎性细胞浸润等病理变化明显减轻。见图1。


正常组模型组上调组沉默组
2.2 转染效率鉴定 模型组、上调组、沉默组miR-210表达量与正常组相比,差异有统计学意义(P<0.05);上调组、沉默组大鼠miR-210表达量与模型组相比,差异有统计学意义(P<0.05);沉默组miR-210表达量与上调组相比,差异有统计学意义(P<0.05),说明miR-10a转染成功。见表1。

表1 转染效率鉴定
2.3 4组大鼠血清VEGF及肺转移灶最长径变化 与正常组相比,模型组、上调组、沉默组大鼠VEGF水平和肺转移灶最长径均升高(P<0.05);上调组、沉默组大鼠VEGF、肺转移灶最长径水平与模型组相比,差异有统计学意义(P<0.05);与上调组相比,沉默组大鼠VEGF、肺转移灶最长径水平降低(P<0.05)。见表2。

表2 4组大鼠血清VEGF及肺转移灶最长径变化
2.4 4组大鼠肿瘤标志物水平变化 与正常组相比,模型组、上调组、沉默组大鼠SCC-Ag、CEA、CYFRA21-1水平,差异有统计学意义(P<0.05);上调组、沉默组大鼠SCC-Ag、CEA、CYFRA21-1水平与模型组比较差异有统计学意义(P<0.05);与上调组相比,沉默组大鼠SCC-Ag、CEA、CYFRA21-1水平降低,差异有统计学意义(P<0.05)。见表3。

表3 4组大鼠肿瘤标志物水平变化
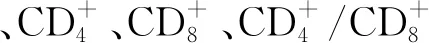

表4 4组大鼠免疫功能指标比较
2.6 4组PI3K/Akt/HIF-1a通路蛋白表达对比 模型组、上调组、下调组大鼠PI3K/Akt/HIF-1a表达与正常组比较,差异有统计学意义(P<0.05);与模型组相比,上调组、下调组大鼠PI3K/Akt/HIF-1a表达下降,差异有统计学意义(P<0.05);与上调组相比,下调组PI3K/Akt/HIF-1a表达降低(P<0.05)。见表5,图2。

表5 4PI3K/Akt/HIF-1a通路蛋白表达比较

图2 PI3K/Akt/HIF-1a通路蛋白表达WB图;A 正常组;B 模型组;C 上调组;D 沉默组
3 讨论
肺癌在我国男、女性中的发病率较高,死亡率也是第一位[8]。非小细胞肺癌占肺癌疾病的比例较大,而且在68%的肺癌患者确诊的时候已经是晚期,五年生存率<5%[8]。研究显示,促进癌细胞凋亡,抑制癌细胞增殖是治疗前列腺癌研究热点[9]。

研究结果说明,基于PI3K/Akt/HIF-1a信号通路沉默miR-210表达干预非小细胞肺癌大鼠,显示大鼠PI3K/Akt/HIF-1a蛋白表达降低。PI3K是一种位于胞质的脂质激酶,在生物学组织、细胞、癌衰老等方面起着重要的调节作用,是重要的信号传递信使能够参与Akt依赖性信号通路的活化;Akt是一种丝氨酸激酶,是PI3K的中心下游效应因子,PIP3能逐渐磷酸化AKT蛋白参与调节VEGF等活性因子,进而参与细胞生长、发育和血管调节的作用[17,18]。有研究发现,VEGF是促血管活性因子,与肺癌的发展侵袭密切相关[19]。研究表明,肿瘤细胞的生长与新生血管的形成之间存在一定的关系[20]。HIF-1a在缺血性疾病、肿瘤血管生成、胚胎血管化的病理生理过程中期重要作用[21]。本研究中显示,通过沉默miR-210进而干预对非小细胞肺癌大鼠进行治疗,VEGF、肺转移灶最长径水平降低,此结果提示,沉默miR-210可以抑制非小细胞癌细胞,主要是通过激活PI3K/Akt/HIF-1a信号通路,随着肿瘤发生而随之在血液细胞中出现的一些指标被称为肿瘤标志物,SCC-Ag、CEA、CYFRA21-1是诊断、反映肺癌病情严重程度、预后的肿瘤标志物。在本研究中显示,经沉默miR-210表达使非小细胞肺癌大鼠SCC-Ag、CEA、CYFRA21-1水平降低,提示沉默miR-210可能激活PI3K/Akt/HIF-1a信号通路可阻止疾病进展,诱导癌细胞凋亡。
综上所述,本文研究发现,沉默非小细胞肺癌大鼠miR-210表达,能够改善大鼠免疫功能,抑制肿瘤标志物的表达,可通过升高血清中VEGF水平,促进血管新生,其作用机制可能与激活PI3K/Akt/HIF-1a通路相关。
