益母草碱基由CaMKⅡ/Cx36信号对七氟醚诱导幼鼠突触可塑性的改善作用
2022-03-02肖志博金辉谢海符少川葛树胜
肖志博 金辉 谢海 符少川 葛树胜
认知功能损伤是幼儿术后常见并发症,如何保护患者避免损伤一直是研究重点。益母草碱 (Leonurine,SCM-198,Leo) 是益母草中提取分离的生物碱,研究显示Leo是一种增强 BDNF/TrkB/CREB 信号传导并促进神经元存活的药物,对阿尔兹海默病模型小鼠行为学和生化指标具有正向调节作用[1]。此外,Leo可通过 c-Jun N 末端激酶途径发挥抗氧化作用,减轻脑出血中的水肿和神经炎症[2]。因此,Leo具有明显的中枢神经保护作用,然而,Leo对七氟醚麻醉幼鼠认知功能的保护作用和潜在的分子靶点仍不清楚。哺乳动物脑组织中,神经元之间的缝隙连接与其旁路蛋白形成了类似化学突触的“电突触”,维持了神经元活动的阈上和阈下同步,成为突触回路中重要组成部分。缝隙连接的分子底物是连接蛋白36 (connexin 36,Cx36),其表达受钙调蛋白激酶 Ⅱ (calmodulin-dependent protein kinase Ⅱ,CaMKⅡ)调控,具有促进突触间小分子如环磷酸腺苷、三磷酸肌醇和 Ca2+的跨膜转运的功能[3]。研究显示,Cx36敲除会导致海马和皮质中神经元缝隙连接丢失,影响神经元振荡活动[4]。此外,在认知功能障碍的老龄大鼠海马中可见明显的Cx36表达减少[5]。因此,本研究拟采用出生后7日龄幼鼠,吸入七氟醚麻醉后检测Cx36的表达。通过益母草碱给药,探究其对七氟醚诱导幼鼠认知功能的改善作用与机制。
1 材料与方法
1.1 实验动物 健康的SPF级SD大鼠母鼠及其所产乳鼠,乳鼠约7 d龄,体重10~15 g,60只,由海南药物研究所有限责任公司提供。饲养条件:温度(25±2)℃,湿度(55±5)%,昼夜循环12/12 h,订制孕鼠饲料,自由饮水,母鼠与其乳鼠同窝喂养。
1.2 实验分组与方案 乳鼠在7日龄时以3%七氟醚麻醉,持续6 h。将麻醉后乳鼠随机分为七氟醚组、益母草碱-低剂量组(益母草碱-L,2.5 mg/kg)、益母草碱-中剂量组(益母草碱-M,5 mg/kg)、益母草碱-高剂量组(益母草碱-H,10 mg/kg),对照组乳鼠仅吸入载体空气,持续3 h,每组12只。乳鼠麻醉后每日腹腔注射对应剂量的益母草碱,连续给药28 d,对照组与七氟醚组分别给予等体积0.9%氯化钠溶液。幼鼠约35 d时,开展水迷宫测试,期间持续给药。水迷宫完成后取脑组织分别开展电生理测试评估长时程增强,采用HE染色评估神经元状态,通过高尔基染色检测神经元树突棘状态,利用Western blot检测CaMKⅡ/Cx36信号通路蛋白表达。
1.3 实验试剂与仪器 益母草碱(美国MCE公司,规格:25 mg,纯度≥ 99.0%);七氟醚(江苏恒瑞医药股份有限公司,批号:H20190206);人工脑脊液(artificial cerebrospinal fluid,ACSF,南京亿迅生物科技有限公司);高尔基染色试剂盒(美国Hitobiotec公司);Anti-Cx36、Anti-p-CaMKⅡ、Anti-CaMKⅡ、β-actin抗体(美国Abcam公司);HRP标记山羊抗鼠/兔抗体(上海碧云天生物科技公司);Morris水迷宫设备与系统(江苏赛昂斯生物科技有限公司,型号:SA201);膜片钳放大器系统(瑞士Axon公司,型号:MultiClamp 700B,MultiClamp 1550B);激光共聚焦显微镜(美国Thermo公司,型号:CellInsight CX7 LZR);电泳仪(美国Bio-rad公司,型号:Mini-PROTEAN Tetra);显影仪(上海天能科技有限公司,型号:1600/1600R)。
1.4 水迷宫测试 水迷宫装置是一个直径1.2 m,深0.5 m的圆形水池,分为4个象限,第Ⅰ象限设置一个半径6 cm的圆形平台。正上方固定一个摄像机,记录幼鼠的游泳线路。训练期间,将幼鼠投入水中,自由游泳90 s,当幼鼠登上逃生平台,记录这段时间为逃避潜伏期;若幼鼠未找到平台,则引导至平台。训练4 d,撤去平台,将幼鼠投入第Ⅲ象限中,记录90 s内幼鼠游泳轨迹,软件分析获得幼鼠逃避潜伏期、穿越平台次数、第Ⅰ象限停留时间。
1.5 电生理测试 将幼鼠处死,以预冷氧饱和高糖缓冲液经体外循环灌注,取出脑组织,包埋后制备横向脑组织切片,厚度约400 μm。将切片转移至32℃的氧饱和ACSF中平衡以维持神经元状态。定位脑组织海马 CA1 区,插入聚四氟乙烯涂层的钨丝电极(A-M Systems),刺激 Schaffer collateral-commissural通路引发场兴奋性突触后电位 (field excitatory postsynaptic potential,fEPSP),以充满 ACSF 的玻璃微电极记录信号。在此期间,调整刺激强度以引发不同的fEPSP,设基线为200 μA电流下诱导的最大值的40%。固定电极与刺激强度,稳定记录20 min,更换高频刺激诱发长时程电位增强(long term potentiation,LTP),连续20串刺激,每串包含200个脉冲,频率为200 Hz,波宽200 μs,串间隔30 s,记录60 min。
1.6 高尔基染色 根据试剂盒说明书开展高尔基染色。将幼鼠处死,以预冷的PBS经体外循环灌注。取脑组织浸泡于试剂盒中的溶液1、2混合液(溶液1、2及以下的溶液3、4、5均来自于试剂盒)中,4℃避光储存14 d。取出脑组织浸入5倍体积的溶液3中,4℃避光孵育48 h。取出脑组织放入预冷的异戊烷中冷冻并切成约10 μm的切片,转移至滴有溶液3的载玻片上贴片。将切片放入溶液4、5混合液中反应30 min,以蒸馏水冲洗玻片。再通过梯度乙醇脱水,以二甲苯Ⅰ与二甲苯Ⅱ透化,使用中性树胶封片。显微镜下捕获突触图像,对树突棘密度和长度统计。
1.7 Western blot 幼鼠处死后取海马组织,加入RIPA裂解液研磨成单细胞悬液,离心后上样缓冲液。开展SDS-PAGE凝胶电泳,电压条件:60 V,30 min;120 V,60 min。截取目标蛋白条带,通过湿法转膜将凝胶上蛋白转移至PVDF膜上,转膜条件:2 Ma,60 min。取出PVDF膜,4%脱脂牛奶,以一抗稀释液孵育,4℃过夜,包括Anti-Cx36、Anti-p-CaMKⅡ、Anti-CaMKⅡ(1∶1 000)。次日,取出PVDF膜,滴加HRP标记IgG(H+L)二抗稀释液(1∶5 000),室温避光孵育2 h。将ECL发光液滴加的PVDF膜上,显影获得蛋白条带。

2 结果
2.1 Morris水迷宫试验评估幼鼠认知功能结果 训练期间,自第2天开始,与对照组相比,七氟醚组幼鼠水迷宫训练期间逃避潜伏期明显增加(P<0.05);自第3天起,与七氟醚组相比,益母草碱-H组幼鼠逃避潜伏期明显减少(P<0.05);与此同时,与益母草碱-L组相比,益母草碱-H组逃避潜伏期也明显减少(P<0.05)。测试期间,与对照组相比,七氟醚组逃避潜伏期明显增加(P<0.05),第Ⅰ象限停留时间和穿越平台次数明显减少(P<0.05);与七氟醚组相比,益母草碱-H组逃避潜伏期明显减少(P<0.05),第Ⅰ象限停留时间与穿越平台次数明显增加(P<0.05)。见表1、2。

表1 水迷宫训练期间幼鼠逃避潜伏期比较

表2 水迷宫测试期间幼鼠各项指标比较
2.2 电生理检测长时程电位增强结果 与对照组相比,七氟醚组幼鼠长时程增强电位水平明显降低(P<0.05),与七氟醚组相比,益母草碱-M/H组长时程电位水平明显增加(P<0.05),且与益母草碱-L组相比,益母草碱-H组长时程电位水平明显增加(P<0.05)。见图1。

图1 5组幼鼠长时程增强电位的变化;a表示与对照组相比P<0.05;b表示与七氟醚组相比P<0.05;c表示与益母草碱-L组相比P<0.05;F=3.76,P=0.005
2.3 高尔基染色评估神经元树突棘状态结果 对照组幼鼠海马神经元树突棘形态比较规则、排列整齐、密度大、蘑菇状树突棘数目较多;与对照组相比,七氟醚组树突棘分支数量明显减少、形态不规则、排列松散、长度缩短;在益母草碱治疗的3组中,与七氟醚组相比,益母草碱-L组树突棘形态、总量和蘑菇状树突棘变化均不显著(P>0.05);而益母草-H组树突棘密度与长度明显增加(P<0.05)。见图2,表3。

图2 5组幼鼠神经元树突棘高尔基染色
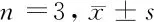
表3 5组幼鼠神经元树突棘密度与长度比较
2.4 Western blotting 检测CaMKⅡ与Cx36蛋白表达结果 与对照组相比,七氟醚组幼鼠海马组织中p-CaMKⅡ与Cx36表达明显减少(P<0.05);与七氟醚组相比,益母草碱-M/H组p-CaMKⅡ与Cx36表达明显增加(P<0.05);此外,与益母草碱-L组相比,益母草碱-H组p-CaMKⅡ与Cx36表达明显增加(P<0.05)。见图3,表4。

图3 5组幼鼠CaMKⅡ与Cx36蛋白电泳图
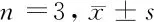
表4 5组幼鼠CaMKⅡ与Cx36蛋白表达量化统计比较
3 讨论
随着社会进步,越来越多患有先天性疾病的婴幼儿可通过手术矫正。七氟醚相比于其他麻醉药物,具有效能高、易控制、恢复快、刺激小的优势,在婴幼儿手术中广泛应用[6]。然而,七氟醚麻醉期间脑组织中葡萄糖代谢会不同程度降低[7]。相比脑组织成熟发育的成年人,婴幼儿患者更易受到葡萄糖代谢紊乱的影响,在全麻手术后近期或远期出现不同程度的认知功能损伤。
认知功能障碍是幼儿手术后常见的一种中枢神经并发症,主要表现为记忆力、抽象思维及定向力障碍。文献中显示,七氟醚麻醉会对刚出生幼鼠少突胶质细胞成熟和髓鞘的形成产生不可逆的影响,成年后表现出减少的探索行为与增加的焦虑样症状[8]。为了模拟临床,本研究通过3%七氟醚麻醉7 d龄幼鼠6 h。结果显示,Morris水迷宫训练与测试期间七氟醚组幼鼠逃避潜伏期明显增加,穿越平台次数与第Ⅰ象限停留时间减少。Morris水迷宫是一种评估啮齿类动物行为记忆、空间探索功能的研究方法。训练期间逃避潜伏期的减少与动物学习能力相关,而测试期间空间探索中穿越平台次数及第Ⅰ象限停留时间反映了动物记忆能力[9]。因此,以上结果提示本研究POCD模型构建成功。此外,益母草碱-M/H组幼鼠逃避潜伏期明显低于七氟醚组,且穿越平台次数与第Ⅰ象限停留时间明显增加,但益母草碱-L组各项指标没有明显改变,说明益母草碱治疗可以改善七氟醚麻醉幼鼠的认知功能,且存在剂量依赖性。
突触是指神经元之间或与其他细胞之间相互连接的接触点。树突棘是建立突触联系的基本结构,Cx36是突触缝隙连接的主要底物,两者共同构成突触结构,诱导兴奋性信号传导[10]。POCD模型大鼠脑中常见明显的树突棘萎缩,蘑菇状结构消失,树突棘密度降低的病理特征[11]。本研究结果与文献中POCD模型动物病理症状一致,5组七氟醚诱导幼鼠海马组织中树突棘萎缩,密度降低。此外,七氟醚诱导幼鼠海马组织中Cx36表达与p-CaMKⅡ表达明显减少。Cx36作为突触间缝隙连接底物,影响着突触间神经递质的传递效率。在MPTP点燃的癫痫小鼠模型中,通常可见明显的Cx36表达增加,造成突触传递过度兴奋,产生连续的去极化与超极化,导致异常放电[12]。CaMK Ⅱ属于丝氨酸/苏氨酸特异性蛋白激酶家族,受Ca2+调控,通过磷酸化与Cx36结合,在神经元与其他蛋白之间形成“电突触”,促进兴奋性信号的传导[13]。已有研究表明CaMK Ⅱ在海马区密集分布,抑制CaMK Ⅱ信号会影响小鼠海马区突触可塑性,继而影响小鼠的空间学习及记忆能力[14]。
突触可塑性是基于树突棘结构与缝隙连接蛋白改变产生的传递效能变化[15]。LTP是突触可塑性的量化表现,是在短暂快速重复性刺激下,突触间电位持续性增强的现象,反映了动物的学习和记忆功能[16]。由于大脑边缘系统海马组织对葡萄糖代谢障碍最为敏感,是POCD患者受损最早且最易受累的脑区,其LTP损害与学习记忆的缺损高度相关[17]。因此海马区LTP诱导操作容易,已成为LTP研究的典型区域。本研究显示,七氟醚刺激下,LTP水平降低,提示七氟醚造成海马突触可塑性损伤。此外,与七氟醚组相比,益母草碱-H组树突棘状态明显改善,LTP水平明显增加,且海马组织中p-CaMKⅡ与Cx36表达明显增加。因此,益母草碱对树突棘和缝隙连接构成的突触可塑性具有明显的调节作用。
综上所述,益母草碱可以逆转七氟醚造成的树突棘密度与长度的减少,增加LTP水平,提高幼鼠海马组织神经元突触可塑性,改善幼鼠的学习、记忆功能,且该保护作用可能涉及CaMKⅡ/Cx36信号的激活。然而,本研究也存在一定的局限性,本研究仅检测了p-CaMKⅡ与Cx36表达,却没有通过抑制剂或激动剂探究CaMKⅡ/Cx36信号对海马神经元突触可塑性的影响。此外,幼鼠全麻后出现认知功能损伤往往与神经元新生抑制相关[18],进一步研究中应继续探讨CaMKⅡ/Cx36信号对神经元新生的影响。
