肝豆状核变性合并中重度脾功能亢进患者脾切除术后并发症发生的相关因素分析
2022-03-02钱洋潘晋方黄龙王振经文善于庆生
钱洋,潘晋方,2,黄龙,2,王振,2,经文善,2,于庆生,2
1安徽中医药大学第一附属医院普外一科,合肥 230000;2安徽省中医药科学院中医外科研究所
肝豆状核变性是一种常染色体隐性遗传的铜代谢障碍疾病,发病机制为基因突变导致铜转运ATP酶的功能受损甚至消失,从而引起铜经胆汁排泄障碍,沉积在人体的各种组织中[1]。肝脏是铜沉积的主要场所,大量的铜沉积于肝细胞中引起愈来愈重的肝硬化,继而引起门静脉高压、脾大、脾功能亢进,从而加剧了脾脏对全血细胞的隔离与破坏,最明显的是血小板(PLT)的减少[2]。肝豆状核变性的主要治疗手段是驱铜、保护肝功能,但一线驱铜药物——二巯基丙磺酸钠、D-青霉胺等均有骨髓抑制的不良反应,会进一步导致患者PLT和白细胞(WBC)的减少,增加出血风险[3]。我们之前的研究证实,脾切除可显著提升肝豆状核变性患者血细胞并改善肝功能[4-5],为排铜治疗创造条件。随着精准外科的发展,脾切除术的精细化操作逐渐为临床所应用,脾切除术术后并发症较前明显降低,但仍有必要对术后并发症影响因素进行探讨。因此本研究旨在分析行脾切除术的166例肝豆状核变性患者的临床资料,探讨术后并发症的相关危险因素。现报告如下。
1 资料与方法
1.1 临床资料 选择2016年3月—2020年12月在安徽中医药大学第一附属医院普外一科行脾切除术的166例肝豆状核变性合并中重度脾功能亢进患者,其中男90例、女76例。纳入标准:①肝豆状核变性诊断明确;②经彩色多普勒超声、实验室检查诊断为脾大、中重度脾功能亢进,骨髓检查示增生性骨髓象;③所有患者Child-Pugh分级为A或B级,麻醉科评估ASA分级均为Ⅱ级或Ⅲ级。排除标准:①肝硬化伴轻度脾功能亢进,无明显临床症状;②严重心肺功能疾病或凝血功能障碍;③患者术后早期出院或转院,记录不完善;④患者神经精神症状较重,治疗依从性差。肝豆状核变性诊断标准[6]:有家族遗传史;锥体外系损害和(或)肝功能异常;眼部“K-F环”;血清铜蓝蛋白<200 mg/L,尿液中铜<1.6 μmoL/24 h。脾功能亢进诊断标准[7]:WBC(3.0~4.0)×109,RBC(2.5~3.5)×1012,PLT(7.0~10.0)×109,脾静脉<1.0 cm,脾长度<12 cm,脾厚度<6 cm,符合3项以上者定义为轻度脾功能亢进;WBC(2.0~3.0)×109,RBC(1.5~2.5)×1012,PLT(5.0~7.0)×109,脾静脉1.0~1.5 cm,脾长度12~16 cm,脾厚度6~8 cm,符合3项以上者定义为中度脾功能亢进;WBC<2.0×109,RBC<1.5×1012,PLT<5.0×109,脾静脉>1.5 cm,脾长度>16 cm,脾厚度>8 cm,符合3项以上者定义为重度脾功能亢进。本研究已通过医院伦理委员会审查,所有患者知情同意。
1.2 手术方法 术前准备:术前常规行4~6个疗程的驱铜治疗,改善肝功能和凝血功能。脾切除术常规采用静吸复合麻醉,手术要点[8]:①暴露脾动脉、结扎脾动脉,脾血回输;②充分游离脾脏,脾蒂分束结扎;③脾脏创面浆膜化。
1.3 术后并发症判定标准 术后14 d以内出现的与手术有关的并发症定义为术后并发症,统一采用Clavien-Dindo分级标准[9],Ⅰ、Ⅱ级为轻度,Ⅲ级为中度,Ⅳ、Ⅴ级为重度。当同一患者住院期间出现多个并发症时,则只统计较高的分级。并发症判定标准如下。①静脉血栓及脾窝积液。在术后7、14 d行肝胆胰脾彩超(含门静脉),采用Prosound α6全数字化彩超专人检测门静脉主干及分支血栓形成情况以及有无脾窝积液。②胰瘘。参考国际胰瘘研究小组(ISGPF)[10]制定标准,须同时满足以下2个条件:术后≥3 d;腹腔引流液淀粉酶>3倍正常上限。不记录生化漏。③肺部感染。满足以下3条及以上的标准[11]:胸片提示肺纹理增粗,肺部渗出、实变影;体温>38 ℃;WBC>10 000/mm3或<3 000/mm3;痰培养出病原菌。④腹腔出血[12-14]。符合以下2条或以上者诊断为腹腔出血:术后短期内(<24 h)出现原因不明的休克征象,临床表现有意识淡漠,烦躁不安,四肢皮肤湿冷,面色苍白,唇甲发绀,心率加快≥120次/分,呼吸急促,脉搏细速,血压下降(收缩压<90 mmHg,脉压差<20 mmHg)等;脾窝引流管引出鲜血>800~1 000 mL/24 h,伴或不伴腹部膨隆;腹部彩超或CT检查可见大量腹腔积液,腹腔穿刺出不凝固血液;Hb(<70 g/L)进行性降低,输血后不回升或回升不明显且很快下降。⑤切口感染。参考医院感染诊断标准[15],满足以下3条:原因不明的持续性高热,>38 ℃;切口愈合不佳有脓性渗出或存在急性炎症表现;细菌培养结果阳性。
1.4 术后并发症影响因素分析 采用自行设计的临床资料登记表,统计166例肝豆状核变性合并脾功能亢进患者的临床资料,包括性别、年龄、BMI、术前消化道出血史、PLT、凝血酶原时间(PT)、Child-Pugh分级、ASA分级、脾长、贫血分级、术中出血量、腹水、手术时间,分析脾切除术后并发症的影响因素。
1.5 统计学方法 采用SPSS21.0统计软件。计数资料先行χ2检验,纳入有统计学意义的因素进行Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 肝豆状核变性合并中重度脾功能亢进患者脾切除术后并发症发生情况 术后共有42例患者发生并发症,发生率为25.3%(42/166),其中静脉血栓18例、肺部感染11例、脾窝积液7例、胰瘘4例、切口感染1例、腹腔出血1例。Clavien-Dindo分级Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ级并发症分别有9、32、1、0、0例。
2.2 肝豆状核变性合并中重度脾功能亢进患者脾切除术后并发症单因素分析 见表1。
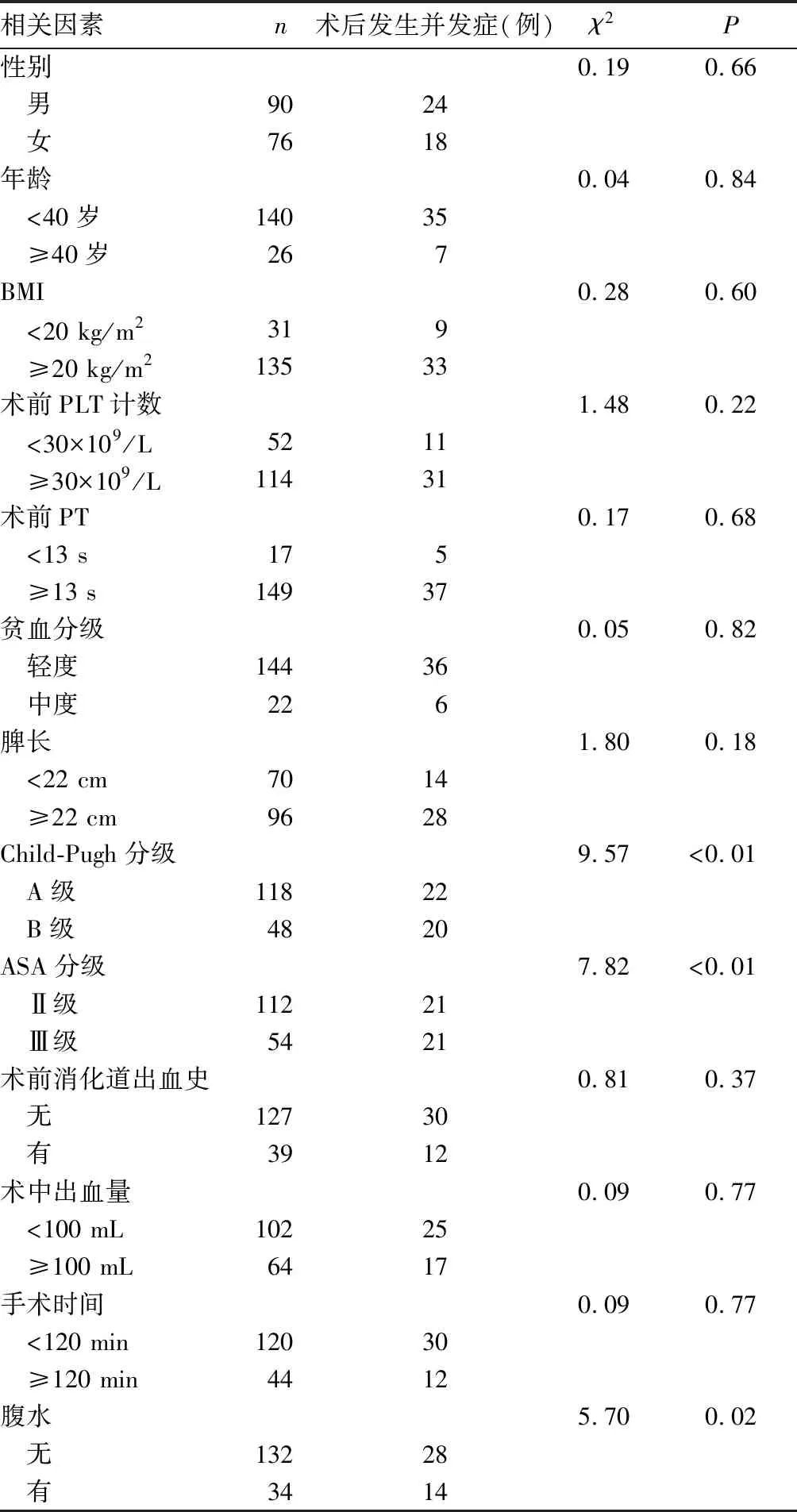
表1 肝豆状核变性合并中重度脾功能亢进患者脾切除术后并发症发生影响因素的单因素分析
2.3 肝豆状核变性合并中重度脾功能亢进患者脾切除术后并发症发生多因素分析 见表2。
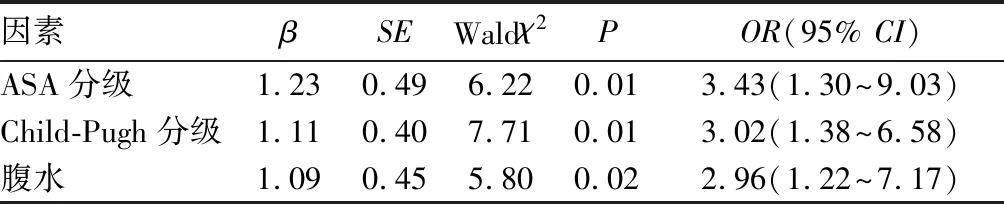
表2 肝豆状核变性合并中重度脾功能亢进患者脾切除术后并发症发生影响因素的多因素Logistic回归分析
3 讨论
肝豆状核变性是一种常染色体隐性遗传性疾病,发病率相对较低,属罕见疾病。由于其常在青少年时期发病且由于铜沉积引起的肝硬化和神经系统症状,往往给患者的正常生活学习带来巨大的负面影响。驱铜治疗是目前唯一有效的治疗方法[16]。脾脏是重要的淋巴器官,主要产生淋巴细胞对抗感染和监控体内细胞,清除血液中的异物、病原性微生物以及衰老死亡的细胞。血液中衰老凋亡的细胞,特别是WBC和PLT会随血液流入脾脏时被清除,当肝硬化引发门静脉高压时,脾脏会发生淤血性肿大,引起脾功能亢进,加速对血细胞的清除[17-18]。临床上一线具有驱铜作用的药物又普遍具有骨髓抑制作用,进一步使患者PLT减少加重,许多肝豆状核变性患者因为PLT过低而影响了正常的驱铜治疗。1941年RABINER观察到肝豆状核变性脾切除后易导致神经系统症状迅速恶化;1970年WALSHE报告9例肝豆状核变性合并食管静脉曲张出血且行脾切除,8例由于神经系统症状加重而死亡。因此,早年国内外绝大多数学者对肝豆状核变性行脾切除均持否定态度。对于这种情况,在20世纪90年代初杨任民等[19]术前给予强力驱铜,尽可能地恢复了原本异常的脏器功能,术后再行强力驱铜,在防治神经症状恶化方面取得了初步成效,发现脾切除治疗并不增加病死率,且可保证患者能接受长期驱铜治疗,开辟了肝豆状核变性继发脾功能亢进外科手术切除脾脏的先河,并迅速应用于临床,至今积累了丰富的经验。大量临床研究[20-22]表明,在术前准备充分的前提下,肝豆状核变性患者行脾切除术治疗是安全可靠的,术后近期疗效更令人满意,但术后并发症较高的发生率仍是困扰外科医生的一大难题。为了更好地预防并发症的发生,进行了此项研究。
本研究中166例行脾切除的肝豆状核变性合并中重度脾功能亢进患者术后出现并发症42例(25.3%),根据Clavien-Dindo分级系统,主要以轻、中度并发症为主,没有Ⅴ级并发症(手术相关死亡病例),证明了脾切除精细化操作的临床安全性。静脉血栓是脾切除术后常见的并发症,主要发生在门静脉及其属支(脾静脉及肠系膜上静脉),目前研究[23]认为与术后PLT爆发性增高、门静脉血流动力学改变、静脉血管内膜炎症有关。肺部感染可能是由于脾切除采用气管插管麻醉,插管对呼吸道的损伤和麻醉药物等会刺激呼吸道分泌大量痰液而未能及时排出。同时腹部创伤较大、胃管留置、术后免疫力降低也可间接导致感染的发生[24]。胰瘘是脾切除术后较为严重的并发症,多因解剖因素或术中操作不当致胰尾损伤所致[25]。对13项因素的单因素分析结果显示,ASA分级、Child-Pugh分级、腹水可能与脾切除术后并发症有关,Logistic回归分析结果显示ASAⅢ级、Child-Pugh B级、腹水是影响术后并发症的独立危险因素。一般认为术后并发症多与患者自身和手术创伤两个因素密切相关。肝脏具有解毒、代谢合成、分泌胆汁等功能,几乎所有的凝血因子都由肝脏制造,在凝血和抗凝两个动态系统中,肝脏扮演重要的角色。Child-Pugh评分从肝性脑病、腹水、总胆红素、白蛋白、凝血酶原延长时间五个方面较为全面地描述了肝功能的状态。Child-Pugh评分越高,肝脏的合成与储备功能越差,对凝血和抗凝两个动态系统的调控能力越差。有研究[26]显示,Child-Pugh评分高会明显提升手术风险,增加术后并发症的发生率。有文献[27-28]指出,Child-Pugh A级患者术后1~5年新诊断的门静脉系统血栓形成(PVST)发生率为4.6%,而在肝功能B级患者中这一概率则达到了10.7%,表明Child-Pugh评分对PVST具有一定的影响意义。也有研究结果[29]表明,由于肝硬化导致的肝功能不同程度减退和凝血因子缺乏所致的凝血功能异常,即使没有手术创伤的打击,这样的患者本身就存在PVST风险,但是PVST发生概率波动的范围不固定,最高可达15%。腹水是肝硬化最常见的并发症之一,其机制主要是肝硬化门静脉高压、血浆胶体渗透压降低引起水、钠过量潴留以及前列腺素等激素代谢异常。腹水作为Child-Pugh评分中的一项指标,多出现于肝硬化失代偿期,与肝功能密切相关,术前出现腹水的患者术后也往往更易出现脾窝和腹腔积液。ASA分级在临床上广泛应用于术前对患者全身多器官功能的评估和手术时机的确立,ASA分级越高,手术的风险越大,术后并发症概率与术后病死率也越高,这也与MENKE等[30]的研究相符合。
针对上述危险因素,结合临床实际情况,可围绕手术的三个阶段有目的性地实施干预措施。术前常规驱铜疗程结束后,根据情况应用丁二磺酸腺苷蛋氨酸、谷胱甘肽、人血白蛋白等药物尽可能使肝功能达到A级;术中保证精细化操作,离断血管韧带时尤其注意,减少术中出血;加强术后补液抗感染,密切关注生命体征及引流液淀粉酶,及时应用抗凝药物。
综上所述,脾切除术是外科解除肝豆状核变性合并中重度脾功能亢进患者脾功能亢进直接且安全有效的治疗手段,但术后并发症的防治也是不容忽视的重要内容。ASAⅢ级、Child-Pugh B级、腹水患者易发生术后并发症。因此术前应对患者相关指标进行详细的评估,积极改善患者的肝功能和其他系统功能,术后应主动早期监测,早期发现,早期处理。
