基于GEO芯片评价乳品中胰岛素生长因子-I、维生素D3和雌二醇联合对乳腺癌标志因子效应的研究
2022-03-02李金娟张耀广李兴佳卢曼会刘哲赵海晴李耘
李金娟,张耀广,李兴佳,卢曼会,刘哲,赵海晴,李耘
(1.农业农村部农产品质量安全重点实验室,北京 100081;2.中国农业科学院农业质量标准与检测技术研究所,北京 100081;3.石家庄君乐宝乳业集团,石家庄 050000)
0 引言
2020年世界卫生组织癌症研究中心(IARC)发布癌症研究报告指出,全球乳腺癌新发病例高达226万例,约占所有新确诊癌症人数的11.7%,占女性新确诊癌症人数的24.5%,乳腺癌已然居女性癌症发病率之首[1]。有研究指出患者摄入动物性食品(乳品,肉)比例与乳腺癌死亡率负相关,摄入动物性食品可提高癌症病人免疫力,增加存活率[2]。随着癌症存活率的不断提高,越来越多研究表明乳腺癌患者需要改善生活方式,补充各类常量、微量营养素以维持机体长期处于健康水平。此外,由于癌细胞增殖或迁移过程耗费大量营养素,造成病人缺乏多种营养素,经化疗治疗的癌症病人尤其需要通过多种方式补充外源营养因子[3]。乳品是自然界中营养最全面的食物,富含蛋白质、脂类、乳糖及多种具抗癌功效的生物活性成分(如雌二醇、维生素D3、胰岛素生长因子-I)[4]。已有研究证实提高日常乳品摄入比例可有效降低乳腺癌复发和迁移的几率[5]。然而,迄今为止的研究数据还不足以给乳腺癌治愈患者提出具体的乳品补充建议。
本研究基于“物质-靶点”策略,以MCF-7细胞系为研究模型,预测分析乳品中典型营养物质雌二醇(E2)、维生素D3(VD3)、胰岛素生长因子-I(IGF-I)联合作用靶点,探究其对乳腺癌标志因子MUC1调控机制,为后期更加完整的功能实验和机制研究进行奠基。
1 材料与方法
1.1 芯片筛选
通过GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)以E2、VD3、IGF-I为关键词,限定物种为“Homo”,选择基于MCF-7细胞系的效应芯片,选取基因芯片GSE160497、GSE27220、GSE26834,如表1所示。

表1 E2、VD3、IGF-I研究芯片
1.2 数据预处理和差异基因分析
利用R软件中各芯片平台的注释包进行参考基因注释,排除非E2、VD3、IGF-I作用样本,并将探针名转化为标准基因名;利用sva软件包[8]进行批次效应消除,Limma数据包[9]筛选实验组和对照组差异表达基因,筛选标准为P.Value<0.05,差异倍数|log2FC|>1。选出三芯片共表达基因,根据log2FC值进行排序。
1.3 PPI网络构建及关键基因(DEGs)筛选
利用STRING[10](http://www.string-db.org)数据库构建差异基因互作网络,Cytoscape3.7.2[11]进行可视化处理。进一步利用MCODE插件(MCODE分数>3)分析基因关联度。模块筛选标准:Degree Cutoff=2,Kcore=2,Maximum Depth=100,Node Score Cutoff=0.2。为了提高预测结果的可靠性,运用不同算法探索本研究关键基因(DEGs)并绘制热图。
1.4 基因功能富集和注释
利用R软件中的clusterProfiler[12]、pheatmap软件包进行KEGG/GO功能富集分析及结果可视化,得到关键基因(DEGs)作用通路,筛选标准为pvalueCutoff=0.01,qvalueCutoff=0.05。
1.5 关键基因(DEGs)与乳腺癌生物标志物因子调控作用研究
利用CPDB数据库(http://cpdb.molgen.mpg.de/CPDB/),分析关键基因(DEGs)与乳腺癌标志因子(MUC1)作用通路。
2 结果
2.1 差异基因筛选及PPI网络分析
分别选取三芯片实验组和对照组,进行基因筛选GSE160497(上调561,下调581)、GSE27220(上调12,下调35)、GSE26834(上调162,下调193)。应用sva软件包进行批次矫正,限定|log2FC|>1。根据log2FC值做降序处理,通过limma软件包进行limFit差异分析获得三芯片共表达基因157个,导入STRING绘制基因拓扑网络,利用Cytoscape3.7.2优化处理。MOCODE插件筛选结果显示,PPI网络中存在2个重要的基因簇如图1,表2所示,24个关键基因(DEGs)如图2所示。

图2 基于MOCED筛选的关键基因热图

表2 基于MOCED筛选的关键基因
图1中阴影部分为基于MOCODE筛选的两个DEGs簇。
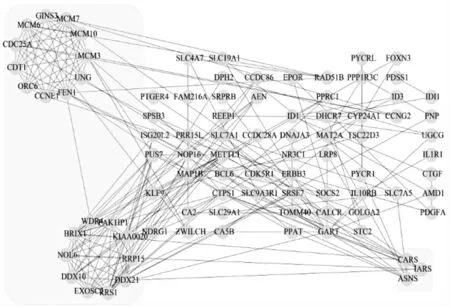
图1 3套芯片共表达差异基因PPI网络
第1个基因簇关键cluster1有21个DEGs,DDX10(DEAD-box解旋酶10)、BRIX(核糖体生物发生器BRIX)、FEN1(活瓣核酸内切酶1)、UNG(尿嘧啶DNA糖基化酶)、DDX21(DEAD-box解旋酶21)、WDR4(WD重复域4)、CCNE1(细胞周期蛋白E1)、EXOSC2(外泌体成分2)、PAK1IP1(PAK1相互作用蛋白1)、GINS3(GINS复杂亚基3)、MCM10(微小染色体维持蛋白10)、RRP15(核糖体RNA加工15同源物)、MCM6(微小染色体维持蛋白6)、MCM7(微小染色体维持蛋白7)、MCM3(微小染色体维持蛋白3)、RRS1(核糖体生物发生调节因子1同源物)、CDT1(染色质和DNA复制因子1)、KIAA0020(Pumilio RNA结合家族成员3)、NOL6(核仁蛋白6)、CDC25A(细胞分裂周期激酶25A)、ORC6(起源识别复合物亚基6)。该基因簇主要功能为调节细胞周期、DNA复制以及染色体合成。
第2个基因簇cluster2有3个DEGs,ASNS(天冬酰胺合成酶)、CARS(半胱氨酰tRNA合成酶)、IARS(异亮氨酸-tRNA合成酶),该基因簇功能主要有促进氨基酸合成。
根据关键基因(DEGs)热图可知,当E2、VD3、IGFI作用于同一基因时,VD3对该类基因作用程度较弱,且E2与IGF-I对于同一基因的调控方向相反。
2.2 关键基因(DEGs)功能富集及通路分析
使用R软件,对157个关键基因(DEGs)进行GO富集,主要包括生物过程(BP)、细胞组成(CC)和分子功能(MF)。根据基因富集数目与显著程度,将P值做降序处理,筛选P<0.01的GO条目,如图3所示。
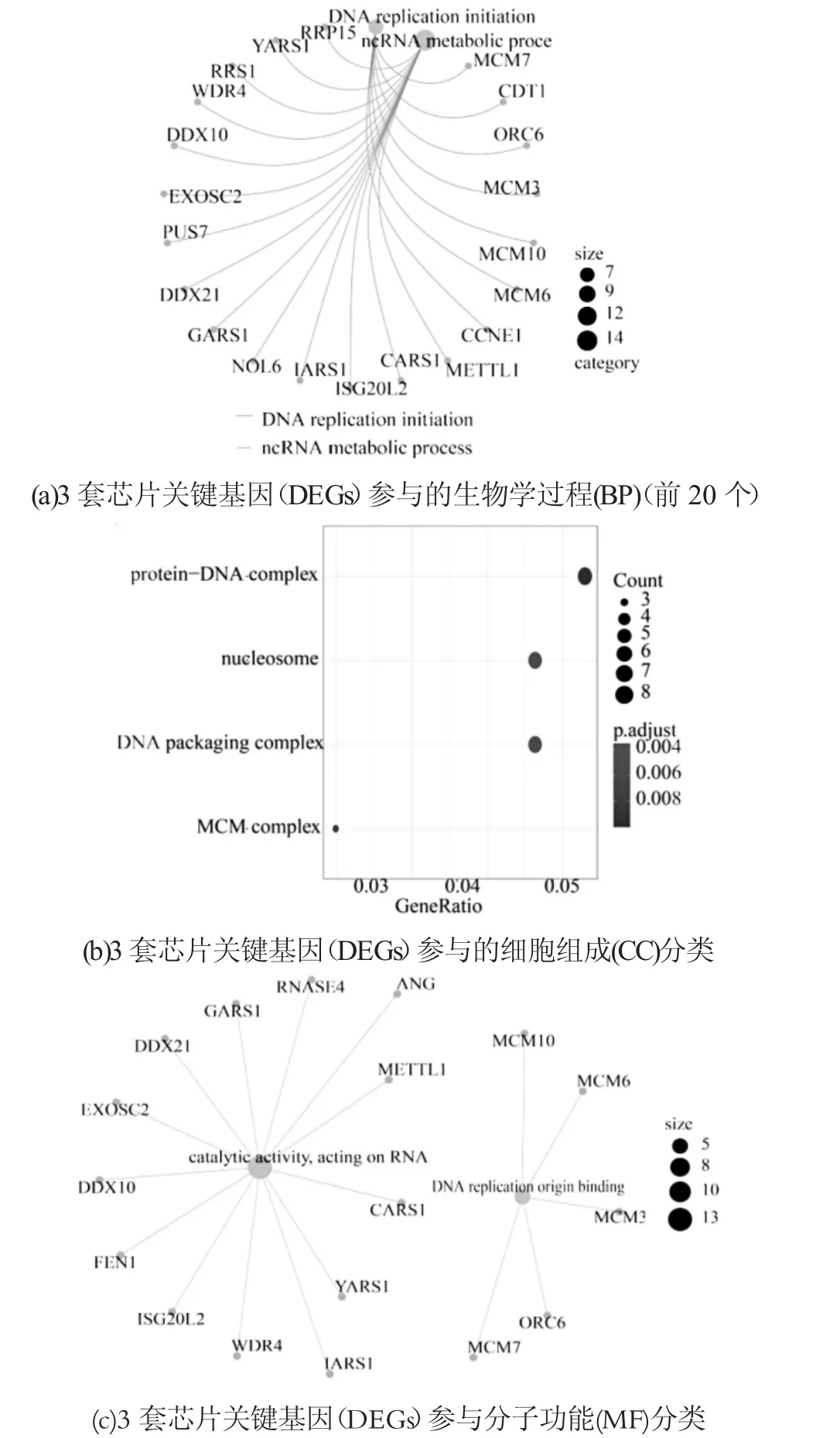
图3 3套基因芯片共同表达显著差异基因GO富集分析图
结果显示,E2、VD3、IGF-I主要作用DNA复制起始,ncRNA代谢过程等生物学过程,可影响细胞内蛋白质-DNA结构复杂化,核小体,DNA合成复杂化,以及微小染色体蛋白复杂化,具有影响RNA催化活性,DNA复制位点稳定的分子功能。
KEGG通路富集分析结果显示,DEGs在DNA复制和细胞周期通路上显著富集。
根据PPI网络筛选出,E2、VD3、IGF-I主要通过MCM家族蛋白、RRP家族蛋白互相作用。因此根据CPDB数据库筛选出MCM,RRP与MUC1复合蛋白作用最短通路,如图4所示。
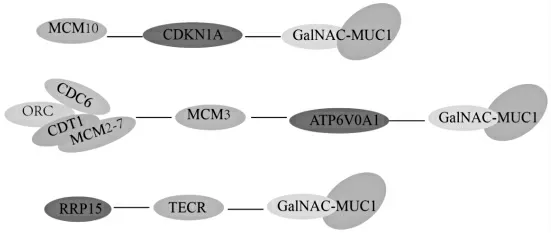
图4 MCM家庭蛋白与MNC1互作通路
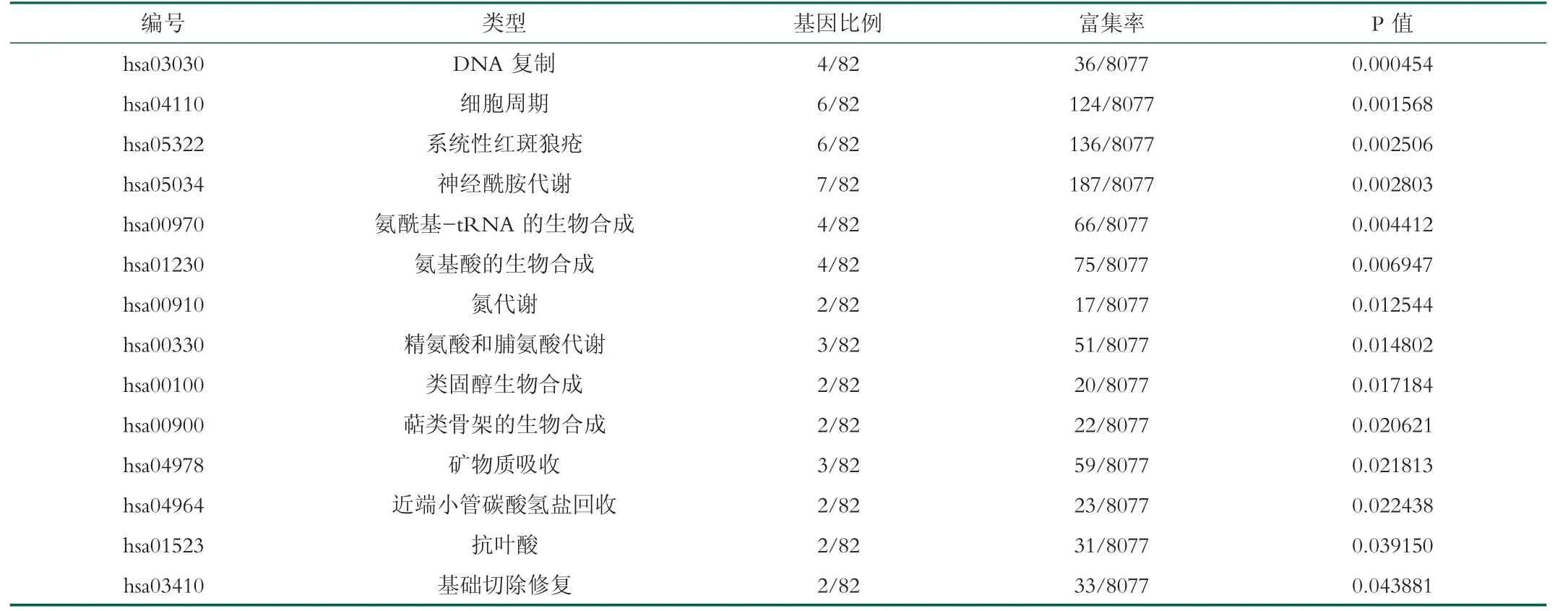
表3 3套芯片共表达差异基因KEGG信号通路分类
由于MCM3、MCM6、RRP15在E2作用下显示下调,而MCM2、MCM7、MCM10在E2、VD3以及IGF-I作用下显示出上调,因此适度补充E2可抑制MUC1的表达。
3 讨 论
乳品营养成分超过2 000种,其中300多种可调节机体生长发育,维持乳腺癌患者术后代谢平衡,进而抑制乳腺癌迁移[4,13]。其中,胰岛素生长因子-I(IGFI)是牛初乳中含量最丰富的生长因子,可调节血糖和胆固醇代谢,促进肌肉组织形成,具有延缓机体老化和功能[14]。研究证实乳品中的17-β-雌二醇(E2)介导IGF-IMAPK通路促进子宫发育,相反IGF-I可促进子宫肌层释放E2,进而刺激子宫内膜腺上皮和间质增生,稳定机体激素代谢水平,预防促进性成熟[15]。此外,乳品还含有较多VD3,可调节血清钙水平,相应的IGF-I可促进惰性的25-羟基维生素D转化为活性1,25-羟基维生素D(VD3),进一步促进成骨细胞发育[16]。然而,过量补充E2、VD3、I GF-I不仅会使机体代谢失衡,还可能会诱导乳腺癌调控基因过表达,增加乳腺癌迁移扩散的风险[17]。
为探究乳品中E2、VD3、IGF-I对乳腺癌标志因子的调控作用,本研究基于GEO数据库筛选出与E2、VD3、IGF-I作用相关并独立的3个芯片数据,采用生物信息学手段分析生理浓度下E2、VD3、IGF-I共同调节的信号通路,并挖掘该通路对乳腺癌标志因子的调控作用。结果表明,MCM10、MCM3、RRP15为E2(10 nmol/L)、VD3(0.5 nmol/L)、IGF-I(100 ng/mL)联合介导的乳腺癌标志因子(MUC1)反应的关键基因。基因功能如下:(1)MCM家族蛋白:该家族蛋白具有结构相似、功能相似的特点。其中,MCM3可调节核苷酸库的稳定性,调节新合成的MCM和亲代MCM的平衡,进而保护基因组复制稳定性[18]。MCM10微小染色体维持蛋白10的作用是诱导DNA应激复制,调节复制叉延伸,促进S期细胞基因组复制等[19]。WeiDong Yang[20]等研究指出MCM10是乳腺癌治疗的潜在预后标志物,其可通过Wnt/β-黏连蛋白途径诱导乳腺癌转移。因此,联合暴露E2、VD3、IGF-I有乳腺癌迁移的风险。Takahiko Murayama[21]指出,E2可诱导c-Myc-MCM10表达降低,在保证正常细胞的生长率的同时降低乳腺癌干细胞生长率,这与本研究结果显示一致如图3所示。此外,Han Jeong Lim[22]研究指出,E2介导的MCM10反应可维持DNA复制延伸及细胞分裂的非冗余功能,确保胚胎着床、发育稳定,高剂量则会使桑葚期胚胎发育停滞。Mengying Zhang[23]等研究指出,低剂量E2有子宫营养作用,高剂量E2则会促进癌症迁移。Mary Waterhouse[24]等指出VD3介导的MCM6反应可维持体重指数正常水平,根据个体发育水平及吸收率差异,应及时调整补充剂量,老年个体可适量补充VD3。本研究结果表明E2、VD3、IGF-I三者通过维持MCM家族蛋白平衡来控制DNA复制叉稳定性,使MUC1表达沉默。然而,E2单独可使MCM3和MCM6表达沉默,E2与VD3、IGF-I联合使用可使MCM2、MCM7和MCM10表达上调。因此,细胞微环境内若存在高浓度E2会导致MCM家族蛋白表达失衡,进而使MCM-MUC1信号通路过表达,增加罹患乳腺癌的风险。另有报道指出,E2可降低女性罹患乳腺癌的风险,但与其他药物联用(如高剂量异黄酮)可能通过其雌激素作用提高敏感个体的乳腺癌发病率,这与本研究结果显示一致[25]。所以,E2为关键调控因素,并与VD3、IGF-I起互逆作用。(2)RRP15:核糖体RNA加工15同源物RRP15可干扰核仁应力,影响细胞核仁形成、核糖体生物效应,干扰G1-G1/S期细胞分裂,延迟S-G2/M期进展,最终导致细胞死亡[26]。有研究表明,RRP15可调控β-黏连蛋白与非编码区RNA作用,进而调控癌细胞增殖[27]。Giorgio Giurato[28]等证实,E2介导的ERβ反应通过对细胞RRP15基因转录调控来抑制乳腺癌发生。Zhixiong Dong[26]等研究表明,生理浓度VD3作用使得MCF7细胞RRP15表达上调,致使细胞ATRChk1-gH2AX轴的DNA复制/损伤检查反应被激活,延迟S-G2/M期进展,促进乳腺癌细胞发生自噬。Dan Hanson[29]等发现IGF-I缺乏可能导致RRP15-P53泛素化不足,进而导致机体发育不足,增加成年女性罹患乳腺癌的风险,补充生理浓度的IGF-I可有效降低患癌风险。本研究结果表明,生理浓度的E2、VD3、IGF-I共 同 调 节RRP15介 导 的TECRMUC1信号通路,通过TECR甾体还原酶作用细胞脂质代谢,下调乳腺癌标志因子MUC1的表达,降低乳腺癌发生的风险。
本研究运用多芯片联合分析,发现MCM10、MCM3、RRP15是乳腺癌标志因子MUC1的关键调控基因。合相关数据再次验证了在E2、VD3、IGF-I调控下的关键基因,可调节机体生长发育,同时具有抗癌效应。研究结果为阐明乳品中E2、VD3、IGF-I的联合机制提供了新思路,也为筛选乳腺癌的治疗药物提供了新的靶点。但本研究的研究主体为乳源性E2、VD3、IGF-I,需要进一步实验进行研究。不同批次乳品中多种营养成分含量层次不齐。乳腺癌患者或处于生长发育阶段的青少年在食用乳品时,应谨慎摄入外源营养补充剂,以防其中的微量雌激素与乳品中其他营养素互作产生不良效应。
