婴幼儿配方粉生产中克罗诺杆菌溯源研究
2022-03-02苏秀敏张艳陈佳陈进秦明倩甘辛李凤琴杨保伟
苏秀敏,张艳,陈佳,陈进,秦明倩,甘辛,李凤琴,杨保伟
(1.西北农林科技大学食品科学与工程学院,陕西杨凌 712100;2.富平县检验检测中心(陕西省羊乳产品质量监督检验中心),陕西富平 711700;3.石家庄学院化工学院,石家庄 050035;4.国家食品安全风险评估中心,北京 100022)
0 引言
克罗诺杆菌(Cronobacter,原称阪崎肠杆菌),是一种革兰氏阴性无芽孢杆菌,广泛分布于自然界,存在于淡水、土壤、污水、蔬菜、动物和人类的粪便中。克罗诺杆菌为食源性条件致病菌,对大多数人而言不致病,但对于特殊人群、尤其是早产婴儿和免疫力低下的婴幼儿危害极大,往往导致新生儿脑膜炎、坏死性小肠结肠炎和菌血症,并可引起严重的神经系统后遗症,甚至死亡[1]。研究表明,婴幼儿配方乳粉是克罗诺杆菌感染婴幼儿的主要源头[2]。
克罗诺杆菌抗干燥能力极强,室温下,在被污染的乳粉中存在两年半以上依然保持活性[3],不仅流行于婴幼儿乳粉、甜点等食品之中,也存在于食品加工厂以及家庭环境[4-7]。在我国,已有在临床、食品、学生宿舍和食堂环境中检出克罗诺杆菌的报道[8]。自1961年由克罗诺杆菌引起的脑膜炎病例被首次报道后,在我国安徽阜阳引起“大头娃娃”事件的劣质婴幼儿配方乳粉以及相关卫生检疫样品中陆续检出了该菌,并推测其主要来源于环境[9-11]。2012-2014年间,重庆、温州、上海和四川等地也相继报道了克罗诺杆菌污染引起的病例,对源于四川的菌株采用脉冲场凝胶电泳(Pulse field gel electrophoresis,PFGE)溯源分析后,表明污染来源于奶粉冲调环境[12-15]。因此,对克罗诺杆菌污染的全方位预防与监控尤为重要。
本研究基于陕西省两家婴幼儿配方粉生产企业,结合其生产工艺,采集其婴配粉生产所用原材料到成品的所有样品及生产环境样品,参考国标GB 478940-2016对其中的克罗诺杆菌进行分离,对分离株进行鉴定和分型,以期追溯出克罗诺杆菌对生产造成污染的关键点,为制定有的放矢、切实有效的克罗诺杆菌污染防控提供依据。
1 材料与方法
1.1 材料
1.1.1 样品来源
针对企业生产中遇到的克罗诺杆菌污染问题,2016年7月起至2017年6月,对陕西省两个婴幼儿配方乳粉加工厂(分别命名为YT和SF)从原料到成品及其生产环境每月采样一次,共计1 246份,进行克罗诺杆菌污染追溯。其中YT厂采样1 051份,SF厂采样195份。样品分为平皿沉降样(P)、涂抹样(T)、粉末样(F)、液态样(Y)4种类型。采样对象主要为配方粉加工用原辅料(包括:原料羊乳、浓缩乳、低聚果糖等),成品粉,车间环境(包括:洁净区与非洁净区门把手、内包人员鞋底、净化系统与洁净车间、排风口等),加工车间设备(包括:流化床、成品传送带、混料罐罐体等)以及工厂周边土壤等。样品按照厂家+样品类型+采样地+平行号进行编号(例:YTF01-1)。
1.1.2 主要仪器与试剂
高速离心机,德国Eppendorf公司;培养箱,北京科伟实验仪器有限公司;基因扩增仪,美国Bio-Rad公司;电泳仪,美国Bio-Rad公司;凝胶成像系统,美国Bio-Rad公司;-80℃超低温冰箱,日本三洋公司。
缓冲蛋白胨水(BPW)、磷酸盐缓冲液(PBS)、胰蛋白胨大豆琼脂(TSA)、克罗诺杆菌显色培养基等购自北京陆桥技术股份有限公司;Taq DNA聚合酶、dNTPs、DNA Maker、PCR buffer均购自宝生物工程(大连)有限公司(TaKaRa)。
1.2 克罗诺杆菌分离鉴定
克罗诺杆菌分离参考GB 478940-2016《食品微生物学检验克罗诺杆菌属(阪崎肠杆菌)检验》进行。称取检样100 g(mL)加入到900 mL BPW增菌液中,36 °C培养18 h;吸取1 mL增菌液转于10 mL mLST-Vm肉汤培养基,44 °C培养24 h;取增菌培养物1环,划线接种于克罗诺杆菌显色培养基平板;挑取1~5个蓝绿色可疑单菌落,划线接种于TSA平板,25 °C培养48 h;以棉签涂抹,而后将菌体悬浮于LB-甘油(50%/50%)中,-80 °C保存,备用。
对于空气沉降样,将取样用TSA琼脂平板置于25 °C培养48 h,挑取1~5个黄色可疑菌落,分别将其划线于克罗诺杆菌显色培养基培养,将蓝绿色菌落划线于TSA平板培养,保存,待鉴定。
对于环境涂抹样,涂抹后将棉拭子头部用无菌剪刀剪断,保存于装有20 mL BPW的无菌离心管中。36℃培养18 h后,分别使用mLST-Vm肉汤、克罗诺杆菌显色培养基和TSA分离得到疑似菌,保存、备用。
1.3 PCR鉴定
1.3.1 基因组DNA提取
用接种环蘸取保存于LB/甘油的疑似克罗诺杆菌,划线接种于LB平板,37 °C过夜培养。挑取少量菌体,使其均匀分散于无菌蒸馏水中,100°C裂解10 min,12 000 r/min离心10 min,取上清液备用。
1.3.2 PCR扩增用引物和条件
使用克罗诺杆菌特异性基因ompA扩增引物ompA-F(5’-GGATTTAACCGTGAACTTTTCC-3’)和ompA-R(5’-CGCCAGCGATGTTAGAAGA-3’)扩增ompA基因[16],对疑似克罗诺杆菌进行PCR鉴定。PCR产物大小为469 bp。PCR扩增ompA鉴定时以ATCC29544作为阳性对照。
1.3.3 琼脂糖凝胶电泳
吸取5 μL PCR产物进行琼脂糖凝胶电泳,凝胶浓度为1%。电泳结束后用凝胶成像系统进行成像,记录结果。
1.4 脉冲场凝胶电泳分型
按照美国疾病预防控制中心(the Center for Disease Control and Prevention,CDC)制定的克罗诺杆菌PFGE分型标准操作程序进行[17]。制胶、酶切、电泳和染色处理后使用BioNumerics软件对DNA酶切图谱进行处理及聚类分析。
1.5 数据分析
采用Excel 2010软件对试验数据进行处理,用Minitab进行显著性差异分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 克罗诺杆菌阳性样品检出情况
1 246份样品中共检出克罗诺杆菌阳性样品14份,检出率为1.12%,分离得到33株克罗诺杆菌。YT厂共检出6份阳性样品,分离得到20株克罗诺菌株;SF厂共检出8份阳性样品,分离得到13株克罗诺杆菌,如表1所示。

表1 克罗诺杆菌阳性样品检出情况
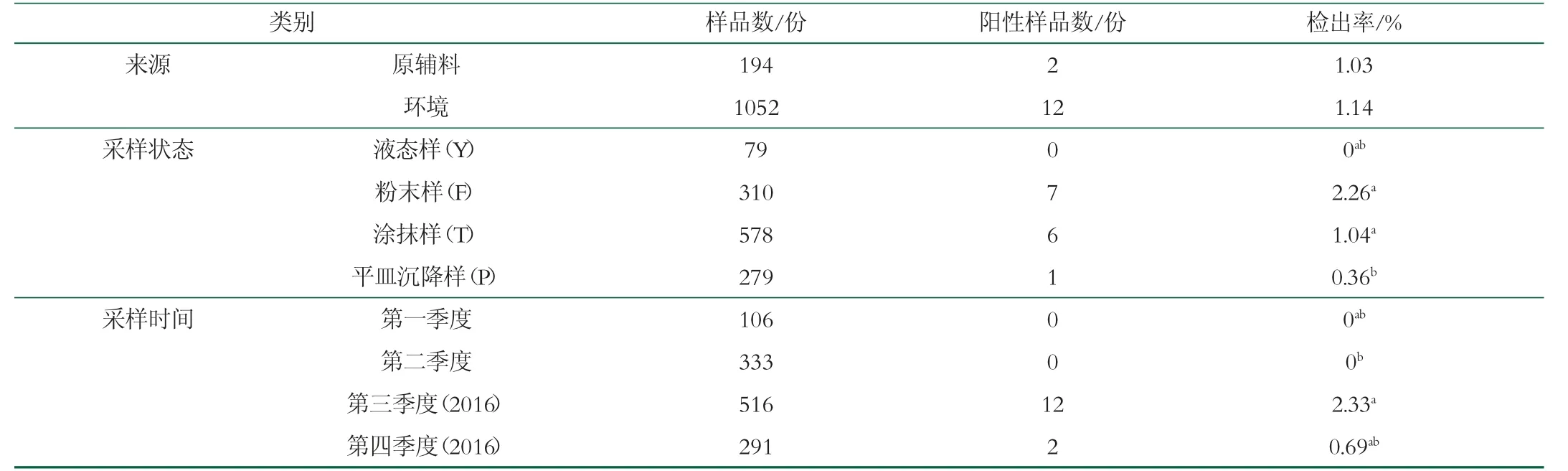
(续表1)
2.1.1 不同厂家克罗诺杆菌阳性样品检出情况
SF厂采集的样品中克罗诺杆菌阳性样品检出率极显著高于YT工厂(P<0.01),见图1。
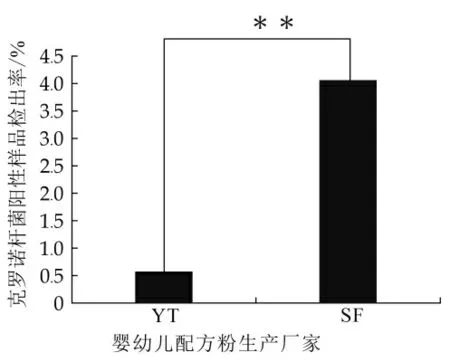
图1 不同厂家克罗诺杆菌阳性样品检出情况
2.1.2 不同来源样品中克罗诺杆菌检出情况
原辅料中克罗诺杆菌阳性样品检出率为1.03%,环境样品中阳性样品检出率为1.14%,检出率间无显著性差异(P>0.05),见表2。
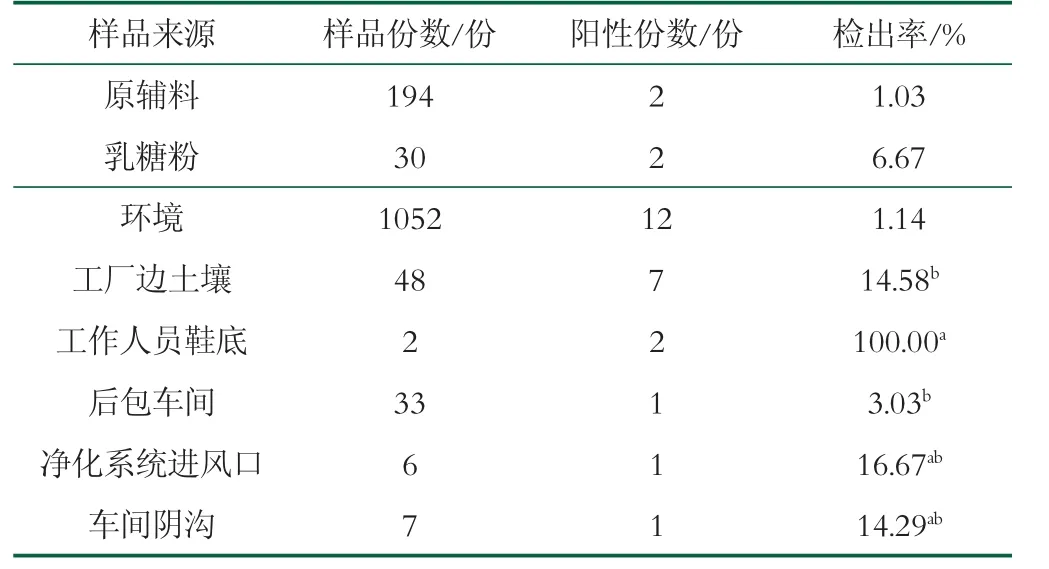
表2 不同来源样品中克罗诺杆菌检出情况
原辅料中检出的2份克罗诺杆菌阳性样品均为乳糖粉,均来自YT工厂。12份阳性环境样品中,7份为工厂边土壤,3份来源于YT工厂,4份来源于SF工厂,见表3。在工作人员鞋底、后包车间、净化系统进风口和车间阴沟环境中均检出克罗诺杆菌阳性样品。其中,工作人员鞋底(100.0%)克罗诺杆菌阳性样品的检出率显著高于后包车间样品(3.03%)。克罗诺杆菌阳性土壤、后包车间、净化系统进风口和车间阴沟样品检出率间无显著性差异,如表2所示。结果表明,乳糖粉、乳粉生产内外部环境中的克罗诺杆菌可能是导致该菌污染成品的重要原因之一。
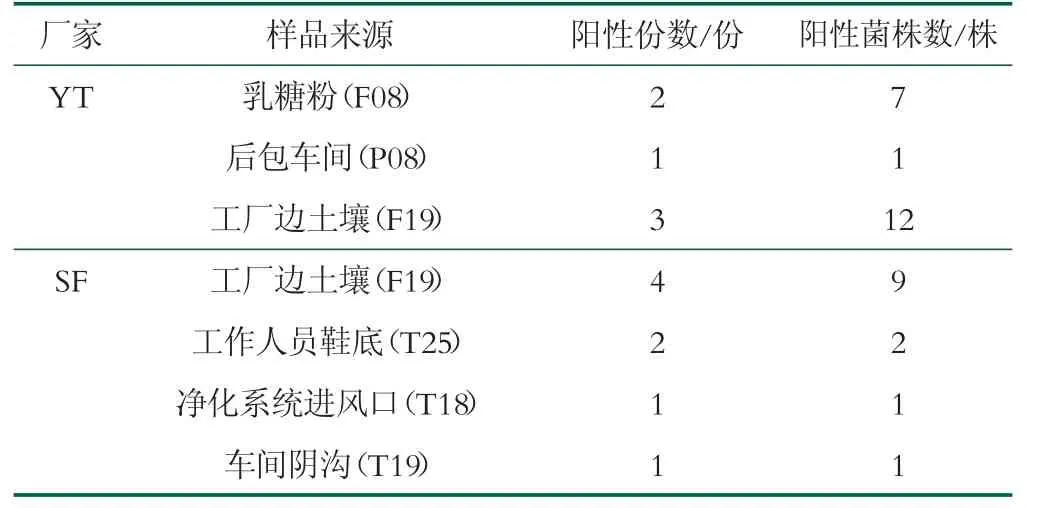
表3 不同厂家来源样品中克罗诺杆菌检出情况
2.1.3 不同状态样品中克罗诺杆菌检出情况
粉末样和平皿沉降样中克罗诺杆菌检出率间存在显著差异(P<0.05),其他状态样品检出率间无显著差异,如图2所示。液态样中未检出阳性样品,粉末样多为乳粉加工辅料,阳性样品检出率最高2.26%,表明乳粉生产过程中使用的粉末状原辅料可能是导致克罗诺杆菌污染的重要原因之一。
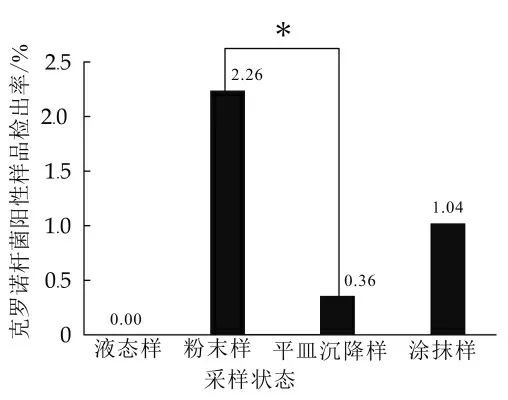
图2 不同状态样品中克罗诺杆菌检出情况
2.1.4 不同采样时间克罗诺杆菌检出情况
2016到2017年间,4个季度克罗诺杆菌阳性样品检出率有差异,如表1所示。2016年第3季度阳性样品检出率最高(2.33%),第1季度和第2季度均无克罗诺杆菌阳性样品检出。第2季度和第3季度克罗诺杆菌检出率有极显著差异(P<0.01),其他季度间样品检出率无显著差异,如图3所示。
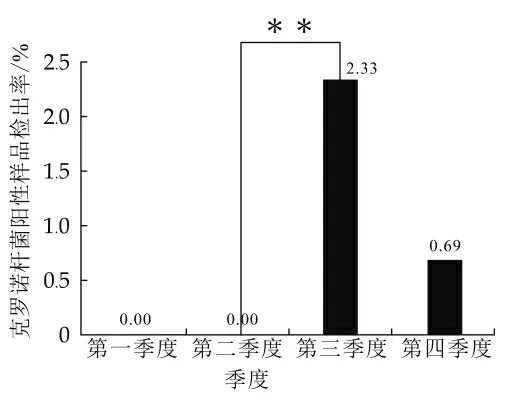
图3 不同季度克罗诺杆菌检出情况
2.2 克罗诺杆菌PFGE分子分型结果
33株克罗诺杆菌Xba I酶切、PFGE电泳、BioNumerics软件聚类分析后,共得到14种DNA指纹图谱,菌株间相似度为85.9%~100.0%,见图4。按92%的相似度,33株菌的基因型可以分为2个大簇、5个小簇和1个单独的基因型,分别为IA、IB、IC、ID、IE、IF、IG、IH。IG簇内各菌株的同源性较高。尽管分离的克罗诺杆菌来源于不同厂家、不同时间、不同样品,但却有较高的同源性。表明该2个工厂的生产环境可能已被克罗诺杆菌污染。
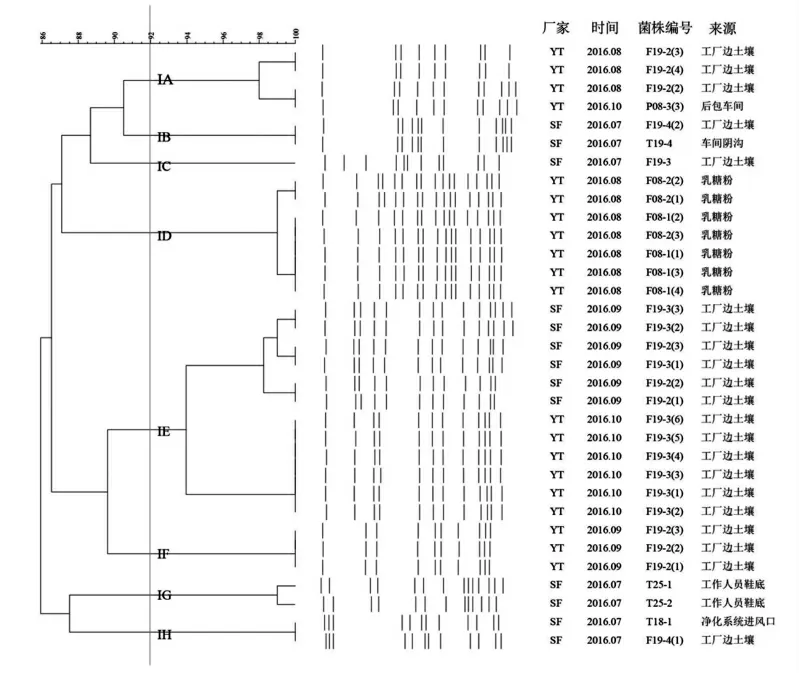
图4 33株阳性克罗诺杆菌PFGE图谱聚类分析
3 讨论
由于新生儿被克罗诺杆菌感染后死亡率很高(40%~80%)[18],且该菌在食品加工过程中易形成生物膜,具有较强的耐热性,因此,近年来克罗诺杆菌被广泛关注[19-20]。对包括克罗诺杆菌在内的致病菌进行分子分型溯源,精确定位污染来源,切断传播途径,可为有效应对致病菌污染、保障食品安全提供技术支持。脉冲场凝胶电泳是食源性致病菌溯源应用最广泛的技术之一,其具有特异性高、重复性好、结果可靠等优点,已成功应用于克罗诺杆菌分型溯源研究[21-23]。
本研究中,2个婴幼儿配方乳粉加工厂克罗诺杆菌阳性样品检出率为1.12%,说明2厂均有一定程度的阪崎克罗诺污染,存在潜在的危害。陈曦[20]等在贵州采集市售婴儿配方乳粉350份,分离出21株克罗诺杆菌,污染率为6%。胡静等[24]调查了中国6个省份婴幼儿配方羊乳粉中克罗诺杆菌的流行情况,检出率为2.18%。虽然该2项调查研究的对象为成品婴幼儿配方粉,但克罗诺杆菌阳性样品检出率均与此次调查结果接近。
SF厂克罗诺杆菌阳性样品检出率(4.10%)明显高于YT厂(0.57%),虽然这一结果可能与采样样本数量有关,也可能由于2个工厂生产规模不同,大型企业对原料、生产、运输等环节管控较严,卫生情况较好所致[25]。SF工厂检出的13株克罗诺杆菌中有9株来自于土壤,YT厂家检出20株克罗诺杆菌中有12株来自于土壤,这一现象也证实了林学海等[26]关于婴幼儿食品作为克罗诺杆菌污染途径之一,最主要的特征是外源性,即外部环境的影响这一观点。因此,两个工厂均需要对生产的外部环境严加把控和管理。YT厂检出的5份阳性样品中有2份为乳糖粉,可能与该月份供货商提供原辅料相关,提醒该企业对于原辅料的质量把关要加紧。不同季度克罗诺杆菌阳性样品检出率有差异,与周厚德等[25]的调查结果不一致,分析可能与采样量差异有关。
PFGE结果表明,2016年9月和10月分离自工厂边土壤的阳性菌株聚类后几乎都处于一大簇,表明环境中存在的克罗诺杆菌亲缘关系较近。一般而言,如菌株DNA图谱相似性为100%,则它们属于同一PFGE型别,基因同源性很高。本研究发现多株菌相似性为100%,表明两个婴幼儿配方粉加工厂家受污染的克罗诺杆菌类型相对集中。YT厂IA簇源于后包车间的一株阳性菌株(P08)与另一株源于工厂边土壤的阳性菌株(F19)呈现高度相似性,表明其在生产过程中可能来自同一污染源。ID簇来自乳糖粉(F08)的7株菌相似度大于98%,表明分离于同一辅料的菌株具有较高同源性。IE簇中SF厂中6株菌呈现高度相似性,这些菌株均来自于2016年9月的工厂边土壤样本。SF厂IB簇源于工厂边土壤的一株阳性菌株(F19)与源于车间阴沟的一株阳性菌株(T19),IH簇源于工厂边土壤的一株阳性菌株(F19)与源于净化系统进风口的一株阳性菌株(T18),它们两两之间均分别呈现出高度相似性,表明其可能存在共同的污染源或存在交叉污染。
本研究初步发现陕西省2家婴幼儿配方粉加工厂原辅料与环境均存在不同的污染,SF厂家污染相对较严重。乳粉糖、工作人员鞋底、工厂边土壤、后包车间、净化系统进风口和车间阴沟等均可能是克罗诺杆菌污染的关键点。本研究可为SF和YT 2个婴配粉生产工厂对克罗诺杆菌污染预防提供数据和理论参考,也可为其他同类食品生产厂家克罗诺杆菌防控提供依据。
