凋落物自毒作用对米槁幼苗生长的影响
2022-03-02唐子燕陈敬忠刘济明廖小锋
唐子燕,陈敬忠,刘济明,廖小锋
(1.贵州大学 林学院,贵州 贵阳 550025;2.贵州大学森林生态研究中心,贵州 贵阳 550025;3.贵州省科学院山地资源研究所,贵州 贵阳 550002)
自毒作用是指植物体通过自然挥发、雨水淋溶、根系分泌、残株腐败等途径向周围环境中释放自身代谢产物,通过直接或者间接的途径抑制种子萌发、种内其他个体或者自身生长的现象[1]。自毒作用是自然界中广泛存在的一种现象,尤其是在人工农林系统中[2],是一种特殊的种内化感作用,通常被认为是影响植物种群天然更新障碍的重要原因[3]。凋落物的增加不仅显著改变土壤酶活性、动物和微生物活性及多样性,还对土壤有机质腐殖质化有显著影响[4]。研究表明土壤微生物直接受到植物酚类物质的影响[5],同时它们也可能利用这些植物化学物质作为碳源,从而改变植物与植物的化学相互作用[6],凋落物中的酚类物质能抑制植物的共生真菌,这可能对植物幼苗的发育有重要影响,然而这些对微生物的影响具有一定的特异性[7],同时土壤微生物对凋落物分解过程同样有重要的影响[8]。在目前自毒作用的研究中,大多聚焦在植物化感成分对种子萌发和植物生长产生的直接影响上,但对其影响土壤环境中微生物组成、营养元素含量、酶活性变化,进而影响幼苗生长养分利用策略方面的报道很少特别是对有重要影响的土壤微生物的相关关注更少。
米槁Cinnamomum migaoH.W.Li 为樟科樟属高大乔木,是中国西南地区特有物种,仅分布于滇黔桂交界的干热河谷地带[9]。米槁果实是苗族传统用药,在治疗胃肠道疾病和心脑血管疾病方面疗效显著[10]。由于米槁具有较高的药用价值,从20世纪70年代末不断有学者将研究目光聚焦于米槁[11],主要集中在精油提取及药用成分研究[12]、种质资源调查[13]、幼苗生物生理特性[14]、植物化感作用[15]等方面。相关学者在研究中发现米槁天然更新存在极大障碍,近30年来对米槁野外种群调查的资料显示其天然种群规模极小,绝大多数种群数量仅为两三株,且树龄较高,种群总体呈现出衰退现象[16]。而且后期对其资源调查中发现很多天然种群已逐渐消失,其物种生存与繁衍受到极大威胁[17]。
本研究课题组于2015—2018年在对天然米槁种群调查中发现,虽然大多数种群冠层下繁衍了少量的幼树,但其主要是由母树萌条而来,极少见到实生苗演替而来的更新种群,大多种群的实生苗在翌年就全部消失殆尽,天然更新极其不良。相关文献显示米槁具有萜类、酚酸类、黄酮类等高化感潜力物质存在[18],而且对部分植物具有较强的化感作用[9]。高化感潜力物种往往具有较强的自毒作用[19]。以往研究已经证实,酚酸、黄酮和萜类与土壤中微生物的相互影响是限制植物天然更新的重要因素。本研究通过设计米槁凋落物处理米槁盆栽幼苗的试验,观察在一定生活阶段米槁幼苗生长和根际土壤营养、酶活性及微生物的相关变化,以期从自毒角度出发探讨米槁天然更新障碍产生的原因,探寻并掌握基于自毒—土壤反馈过程中凋落物对幼苗生长的影响及其响应机制,为后期合理种植及改良提供理论指导,并为米槁的种群保育提供一定的科学依据。
1 材料与方法
1.1 研究区概况
米槁主要分布于滇黔桂交界的干热河谷地带,分布的海拔范围为340~1 020 m。分布区内的地势西高东低,气候温和、雨量丰沛,云雾多、日照少。年均相对湿度75%~82%,年均降水量1 160~1 340 mm,年均日照时数1 116~1 211 h,年均气温15~19℃,区域内降水多集中在5—10月份。
1.2 供试材料
2017年11月于贵州省罗甸县采集米槁种子,用0.5%高锰酸钾溶液消毒2 h 后,使用发芽盒进行种子萌发。2018年1月发芽后转入营养土定植,3月中旬将长势一致的幼苗移栽至营养袋内进行缓苗处理,4月将幼苗(高度为16.25±1.41 cm,叶片数为5±0.58)移至塑料盆内进行栽培试验;供试土壤由未生长植物的黄土∶腐殖质∶珍珠岩=7∶2∶1 的均匀混合物组成,每盆土壤约2.5 kg,所有供试土壤全部经过灭菌处理,121℃高压灭菌2 次,每次循环1 h(隔24 h);对米槁冠层下凋落物调查发现,其组分主要为叶片、果实和枝条,因此将供试材料分为叶片、果皮、种子、枝条4个组分(所有凋落物均来自贵州省罗甸县,为尽可能模拟自然情况,凋落物均在当年11—12月份收集于冠层下,并区分组分)。
1.3 试验设计
将所有凋落物组分的供试材料剪成约1 cm2的小块,然后分别称取0、1、2、3、4 g,置于100 mL去离子水中,制成浓度为0.00、0.01、0.02、0.03、0.04 g·mL-1的溶液,其中浓度0.00 g·mL-1为未处理对照组(CK)。按照上述5 个浓度,设置叶片、果皮、种子、枝条4 个组间对照,每个处理9 个重复,共180 盆,置于温室大棚内进行控制试验。试验开始后每10 d 将浸提液连同凋落物浇灌在各处理的幼苗盆中,并随机移动各处理的幼苗位置,每盆不定时浇入定量的去离子水以补充水分,待处理210 d 后测定其相关指标。
1.4 指标测定及方法
苗高:在试验末期,对每个处理的幼苗用游标卡尺与卷尺测量;叶面积测定选取3 盆植株,使用CI—203 手持式激光叶面积仪测定,其中选3片最大叶子的叶面积;生物量测定待试验结束后,将各处理下米槁幼苗置于65℃的烘箱中烘干至恒质量,然后称其质量。
土壤的酸性指标磷酸酶、蔗糖酶、脲酶、过氧化氢酶含量,采用试剂盒进行测定,方法与结果计算参照试剂公司方案(北京索莱宝生物科学技术有限公司)。测定土壤全氮(TN)(半微量开氏法)、全磷(TP)(钼锑抗比色法)、全钾(TK)(火焰光度法)、碱解氮(AN)(半微量开氏法)、有效磷(AP)(钼锑抗比色法)、速效钾(AK)(火焰光度法)的含量[20]。土壤的初始理化性质如表1所示。

表1 供试土壤化学性质Table 1 The initial chemical composition of the tested soil
土壤微生物:选取4 个凋落物组分的浇灌浓度0.04 g·mL-1处理和空白处理的植株根际土壤,随机选择其中3 个作为重复,置于冰盒中保存,随后用DNA 提取试剂盒(FastDNA®SPINKit for Soil)提取微生物DNA。PCR 扩增采用TaKaRa rTaq DNA 多聚酶,20 μL 反应体系:5× Buffer 4 μL,2.5 mmol/L dNTPs 2 μL,真菌正向引物ITS1F,CTTGGTCATTTAGAGGAAGTAA,反向引物2043R GCTGCGTTCTTCATCGATGC,细菌正向引物5′-TACGGRAGGCAGCAG-3′,反向引物5′-AGGGTATCTAATCCT-3′。rTaq 多聚酶0.4 μL,BSA 0.2 μL,模板DNA 10 ng,而后补ddH2O 至20 μL。PCR 仪:ABI GeneAmp 9700 型。PCR 反应参数:a.1×(95℃,3 min),b.35×(95℃,30 s;55℃,30 s;72℃,45 s);c(72℃),最后10℃直至停止。PCR 产物经由上海欧易公司代为测序(Illumina)。
1.5 数据处理
细菌和真菌DNA 测序原始数据使用Trimmomatic 软件分析,对raw data 低质量序列,首先采用滑动窗口法对序列扫描,当质量低于20时,切掉碱基质量平均值低于阈值的滑窗,并去除长度小于50 bp 的序列。使用Flash 软件将上一步合格的双端 raw data 拼接,序列拼接时最大overlap 为200 bp,得到完整的paired end 序列。使用QIIME 软件中的split_librarie 软件,去除paired end 序列中含有N 碱基的序列,去除单碱基重复大于8 的序列,去除长度小于200 bp 的序列,得到clean tags 序列。采用WPS 2019 软件进行数据整理,数据组间比较用单因素方差分析(Duncan’s test),P<0.05 表示组间差异有统计学意义,使用SRST 在线统计工具完成(www.mdtserver.com/srst/)。作图采用Origin Pro 2018 软件完成。
2 结果与分析
2.1 不同凋落物组分对幼苗生长的影响
测定米槁幼苗苗高、生物量和叶面积时发现(表2):在凋落物叶片处理下,整体呈现出抑制现象,苗高随处理浓度提高呈逐步增加的趋势,但均低于对照组;生物量随处理浓度增大逐步降低,各处理均与对照组存在显著差异(P<0.05);叶面积随处理浓度增大未表现出明显规律,但均小于对照组。果皮处理下的苗高、生物量、叶面积均高于对照组,且苗高、生物量在各处理下均显著高于对照组。种子处理下,除生物量在0.01 g·mL-1浓度组和叶面积在0.01、0.02 g·mL-1浓度组时低于对照组外,其他浓度组均高于对照组,其中生物量在0.03、0.04 g·mL-1浓度组时显著(P <0.05)高于对照组;苗高随着处理浓度升高呈逐步升高趋势,但与对照组间差异不显著。枝条处理下,除苗高在0.01 g·mL-1浓度组和生物量在0.01、0.02 g·mL-1浓度组时低于对照组外,其他均高于对照组,且苗高在0.02、0.03、0.04 g·mL-1浓度组时较对照组显著升高;生物量在0.03、0.04 g·mL-1浓度组中显著升高。
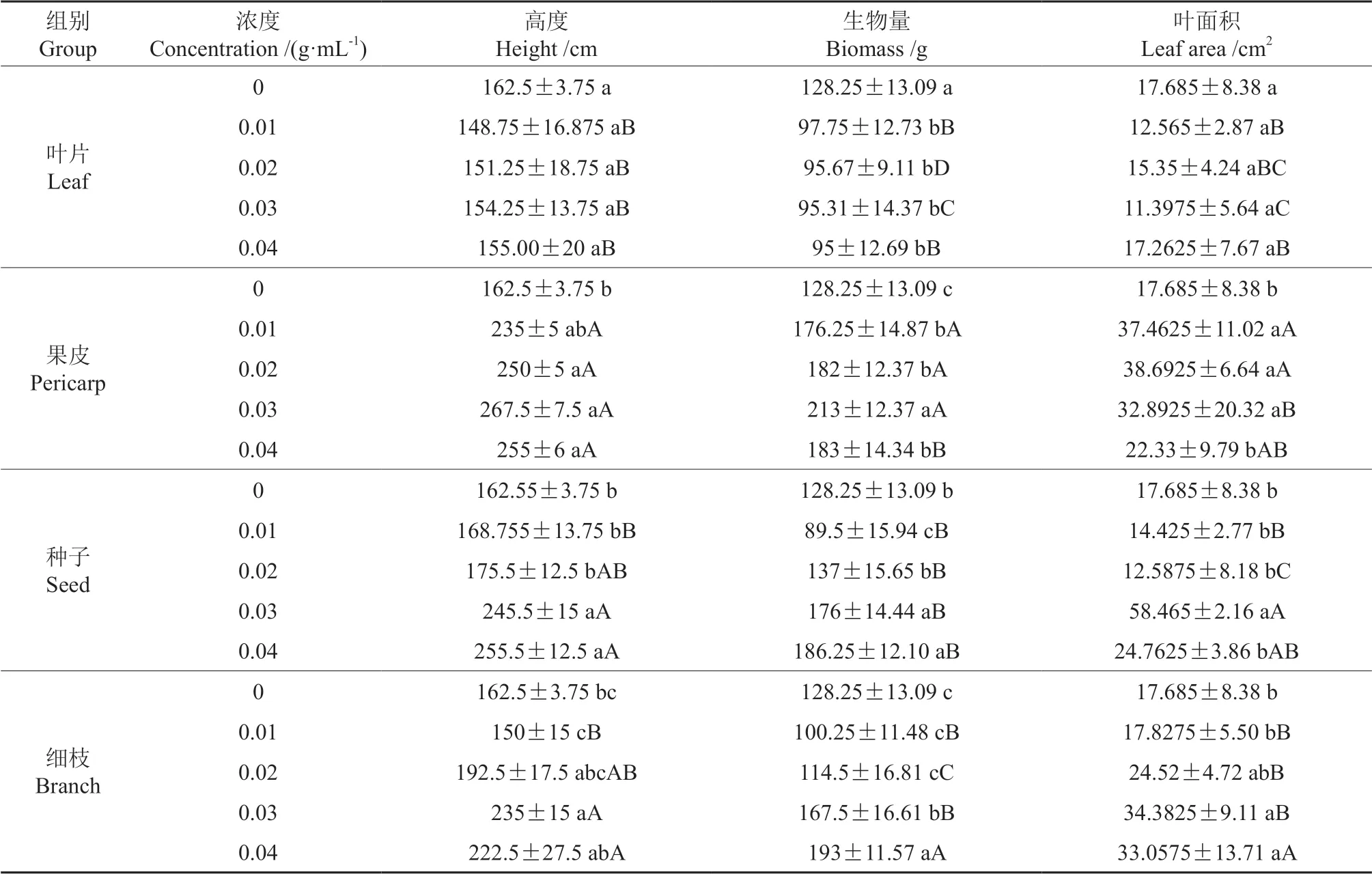
表2 不同凋落物组分对米槁幼苗生长的影响†Table 2 Effects of different litter components on the growth of seedlings
2.2 不同凋落物组分对米槁幼苗栽培土壤N、P、K 的影响
土壤全氮含量在所有凋落物组分的水浸提液处理下均高于对照组,其中全氮含量与叶片、果实和种子浸提液浓度呈正相关,但与枝条处理浓度呈负相关;叶片和种子浸提液处理在0.03~0.04 g·mL-1时比对照组显著升高(P<0.05)(图1a)。土壤全磷含量在所有处理后都高于对照组,其中,叶片与枝条水浸提液处理在0.02~0.04 g·mL-1时比对照组差异显著(P<0.05),果皮与种子水浸提液所有处理都显著高于对照组(P<0.05)(图1b)。土壤全钾含量在所有凋落物水浸提液处理后都显著高于对照组(P<0.05),且与叶片、种子水浸提液浓度升高呈正相关,对果实和枝条处理为负相关(图1c)。速效氮含量在叶片与种子处理中表现为比对照增加,种子水浸提液浓度在0.02~0.04 g·mL-1时比对照组显著升高(P<0.05);果实与枝条处理均低于对照组(图1d)。土壤速效磷含量在所有处理下均高于对照组,其中,果皮、种子和枝条分别在0.03~0.04、0.02~0.04、0.04 g·mL-1时显著高于对照组(P<0.05)(图1e)。土壤速效钾含量与所有水浸提液处理浓度呈正相关,且比对照组显著升高(P<0.05)(图1f)。
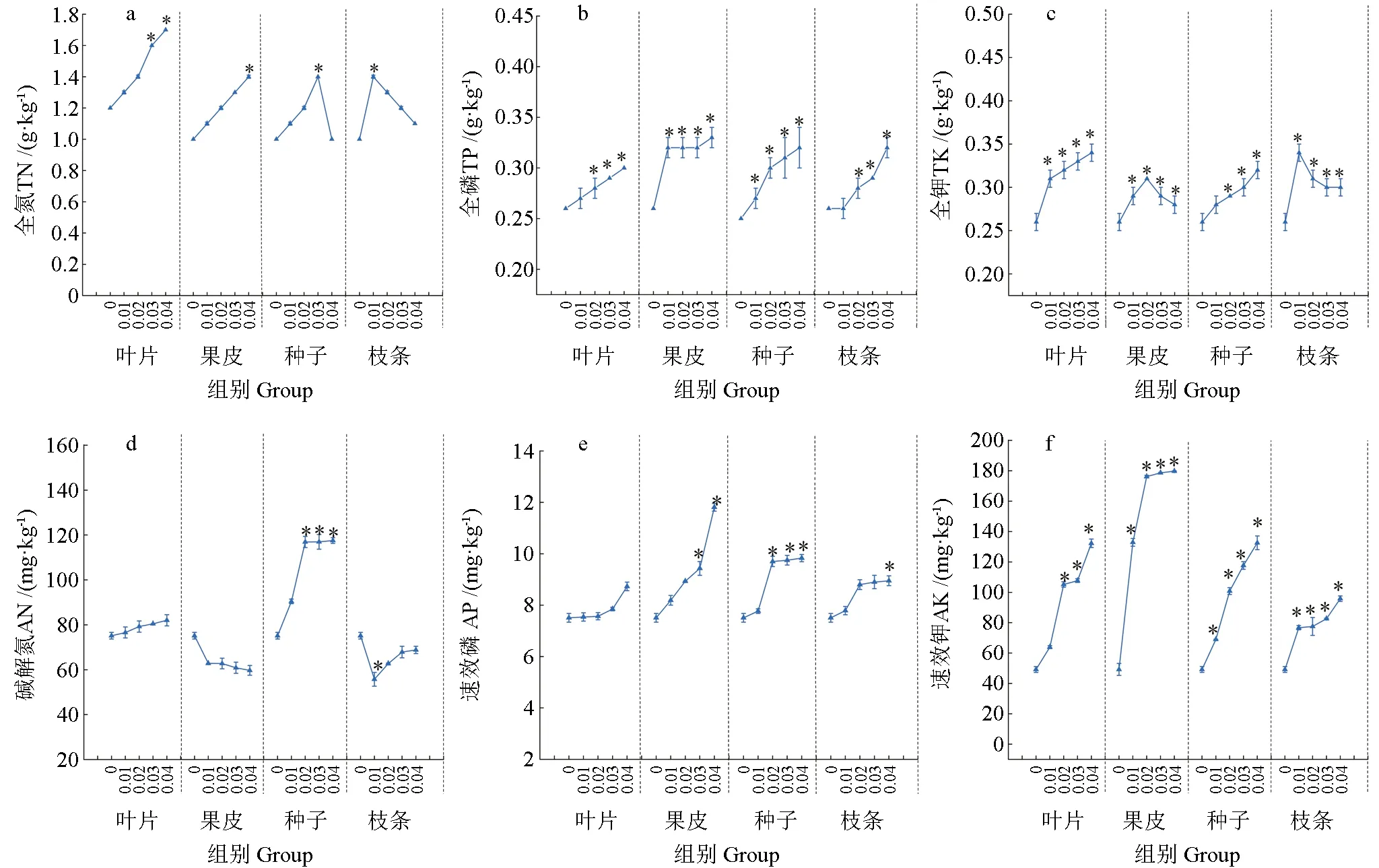
图1 米槁不同凋落物组分对种植土壤全氮(a)、全磷(b)、全钾(c)、碱解氮(d)、速效磷(e)和速效钾(f)的影响Fig.1 The contents of TN(a),TP(b),TK(c),AN(d),AP(e)and AK(f)in the soil of C.migaoseedlings,after the application of different litter components.
2.3 不同凋落物组分对米槁幼苗栽培土壤酶活性的影响
在叶片与枝条水浸提液处理中,土壤过氧化氢酶活性与浓度呈负相关,与对照组相比显著降低(P<0.05),为明显的负调控效应。在果皮与种子水浸提液中,过氧化氢酶活性呈先下降后上升趋势(图2a),表现为促进作用。土壤脲酶活性在所有处理中呈升高趋势,且都高于对照组,叶片、果皮、种子和枝条水浸提液处理分别在0.03~0.04、0.02~0.04、0.02~0.04、0.01~0.04 g·mL-1时比对照组显著升高(P<0.05)(图2b),说明所有处理对土壤脲酶活性都有很好的促进作用。土壤酸性磷酸酶活性随叶片与果皮水浸提物浓度的升高呈下降趋势,其中叶片处理均低于对照组,果皮水浸提液处理在0.02~0.04 g·mL-1时低于对照组;种子和枝条水浸提液随浓度升高对土壤酸性磷酸酶活性有一定的抑制作用,但都高于对照组,所有处理与对照组不存在显著差异(P>0.05)(图2c)。所有水浸提液处理下,土壤蔗糖酶活性均高于对照组,但与叶片与枝条水浸提液浓度负相关,叶片处理在0.01 g·mL-1时显著高于对照组(P<0.05);果皮与种子处理浓度升高则表现为促进作用,种子处理在0.02~0.04 g·mL-1时显著高于对照组(P<0.05)(图2d)。
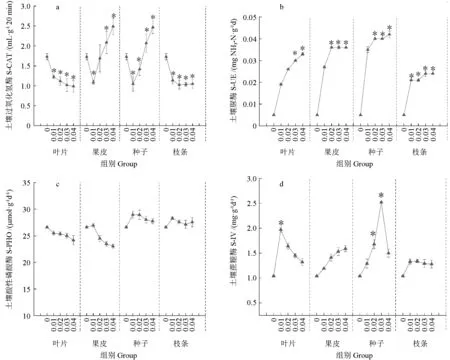
图2 米槁不同凋落物组分对米槁种植土壤过氧化氢酶(a)、脲酶(b)、酸性磷酸酶(c)和蔗糖酶(d)活性的影响Fig.2 The contents of soil catalase(a),soil urease(b),soil phosphatase(c)and soil invertase(d)of C.migao seedlings,after the application of different litter components
2.4 不同处理土壤微生物群落差异性
从真菌在属水平的构成情况来看(图3a),不同处理具有一定的相似性。优势属在叶片1中为Oliveonia(8.2%),叶片2 中为被孢霉属Mortierella(18.3%),叶片3 中为梭链孢属Fusidium(18.1%)。优势属在细枝1 中为柄孢壳属Zopfiella(9.89%),细枝2 中为扁孔腔菌属Lophiostoma(6.58%),细枝3 中为斜盖伞属Clitopilus(2.4%)。优势属在种子1 中为被孢霉属Mortierella(52.8%),种子2 中为青霉菌属Penicillium(28.8%),种子3 中为青霉菌属Penicillium(14.16%)。优势属在果皮1 中为Rhynchogastrema(18.83%),果皮2中为裸脚伞属Gymnopus(12.36%),果皮3 中为Archaeorhizomyces(8.89%)。3 个对照(CK)的优势属均为被孢霉属Mortierella(CK1 11.65%>CK2 10.99%>CK3 6.25%)。
对于细菌组成,不同处理同样具有一定的相似性(图3b)。优势属在叶片1 中为热酸菌属Acidothermus(3.92%),叶片2中为Candidatus solibacter(18.3%),叶片3 中为伯克氏菌属Burkholderia(3.36%)。优势属在细枝1中为Bryobacter(2.44%),细枝2 中为Bryobacter(3.63%),细枝3 中为Rhizomicrobium(5.1%)。优势属在种子1 中为Candidatus solibacter(3.43%),种子2 中为假单胞菌属Pseudomonas(5.83%),种子3 中为Acidothermu(3.51%)。优势属在果皮1 中为伯克氏菌属Burkholderia(3.46%),果皮2 中为假单胞菌属Pseudomonas(3.83%),果皮3 中为Candidatus solibacter(3.76%)。优势属在对照1中为鞘氨醇单胞菌属Sphingomonas(9.73%)对照2 中为Prevotella9(5.95%),对照3 中为鞘氨醇单胞菌属Sphingomonas(4.35%)。

图3 米槁根际土壤微生物群落组成及相对丰度Fig.3 Composition and relative abundance of microorganism communities in rhizosphere soil of C.migao
从对排名前30 的细菌和真菌在种水平上进行基于系统发育的聚类分析后构建的聚类热图可以看出(颜色代表物种的丰度,偏向红色丰度高,偏向蓝色丰度低):真菌(图4a)在不同凋落物处理下在种水平下差异明显,并且组内具有较好的相似性。叶片的3 个重复(优势种依次 为Eurotiales sp8.24%、Mortierella gemmifera14.26%、Fusidium griseum18.19%)与果皮1 聚为一支(Penicillium chrysogenum18.83%),3 个空白单独聚为一支(优势种依次为Mortierellaceae sp18.23%、17.41%、Agaricomycetes sp22.66%),种子2(优势种Penicillium sp17.5%)、种子3(优势种Mortierellaceae sp16.88%)单独聚为一支,细枝3(优势种Agaricales sp53.27%)各重复与种子1(优势种Mortierella sp52.15%)单独聚为一支;不同凋落物处理下细菌(图4 b)构成情况则较为复杂,组内相似性极差。叶片1(优势种Streptomyces scabiei1.69%)、细枝2(优势种Bacillus coagulans0.71%)、种子1(优势种Pseudomonas fluorescens0.4%)、 叶片2( 优势种Bacillus coagulans0.25%)单独聚为一支,CK1(Bacillus coagulans2.5%)、CK2 单独聚为一支(优势种Bacillus coagulans3.33%),细枝3(优势种Pseudomonas fluorescens0.24%)、果皮3(优势种Lactobacillus delbrueckii subsp.bulgaricus0.66%)单独聚为一支、种子3(优势种Bacillus coagulans0.83%)和果皮1(优势种Pseudomonas fluorescens1.15%)单独聚为一支。

图4 种水平上米槁根际土壤微生物的聚类热图分析Fig.4 Analysis of heat map of microorganisms in rhizosphere soil of C.migaoat species level
3 讨论
自毒作用对植物种子萌发和生长通常有抑制作用,影响种群的自然更新[19]。从米槁幼苗的苗高、生物量和叶面积的变化可看出,凋落物叶片处理对米槁幼苗具有明显抑制作用,其他凋落物组分在浓度范围内对米槁幼苗生长具有不同程度的促进作用。米槁冠层下的凋落物主要为叶片,果实和枝条相对少见。前人对米槁叶片化学成分的研究也揭示其具有部分化感潜力的成分[17],而这些成分已在其他物种上得到了证实[21],说明叶片凋落后释放化感物质是影响米槁种群天然更新的一个重要原因。
土壤酶是一种具有催化能力的生物活性物质,由微生物、植物和活体动物分泌并在动植物残骸分解后释放,和土壤中N、P、K 转化与利用有着密切的联系[22]。一般化感(自毒)植物的凋落物对土壤酶与N、P、K 有重要影响,会导致土壤肥力与酶活性发生不同程度的改变,间接导致自毒作用[23]。虽然很多自毒(化感)物质在植物体内时与酰基(糖基)结合,但并不会直接作用于植物,而是以凋落物的形式进入土壤后,在微生物参与下导致酰基/糖基降解后从不活跃形式转换成活跃形式,对土壤中的微生物、相关酶等产生作用,从而也会导致自毒作用[24]。已有相关研究表明,土壤微生物与蔗糖酶、脲酶、磷酸酶活性也直接相关[25]。从不同处理对N、P、K 与土壤酶活性的影响来看,随着处理浓度上升,土壤脲酶、速效K、全P、速效P 呈现逐步上升的趋势,枝条处理下土壤过氧化氢酶呈现降低的趋势,全N、速效N、全K、全P、土壤过氧化氢酶、酸性磷酸酶、蔗糖酶则没有明显变化。通常土壤脲酶与微生物数量、全N、速效P呈现正相关,本研究中全P 的变化趋势较好地验证了这一点,这也与前人的研究结果一致[26]。从试验结果来看,不同凋落物组分对土壤细菌的影响较为复杂,组内与组间没有明显差别,说明米槁自毒作用可能与土壤细菌关系不大。从米槁凋落物对土壤真菌的影响来看,组内具有较大相似性,组间差异较大,说明不同凋落物组分由于自身次生代谢产物构成的不同,引起了土壤中真菌与其相互作用,进而造成了不同处理真菌组成差异较大,相关研究也证实化感物质会通过改变土壤中的真菌进而影响植物生长[27]。
不同凋落物处理下土壤中N、P、K 的增加并未改变叶片处理对米槁幼苗生长的抑制作用,这证实了前人研究得出的土壤肥力改善并不能减轻自毒作用对植物的负面影响的结论[28],也进一步佐证了在米槁叶片凋落物中确实存在抑制米槁幼苗生长的自毒物质。盆栽试验各处理下细菌和真菌主要由采样环境中由凋落物携带和试验地空气中可能存在的孢子萌发而来。天然种群中和人工环境下的真菌组成差异,主要是因为凋落物可携带的微生物的种类和数量有限,无法完全真实反映自然条件下微生物构成情况。加上试验地与天然种群的环境因素有所差异,可能无法反应自然界中米槁凋落物与土壤真菌的相互关系[29]。从揭示微生物与其化感作用之间的关系来看,原位试验必不可少,这将是未来研究重点。
4 结论
通过分析果皮、种子、枝条和叶片4 个凋落物组分对米槁幼苗生长的影响可以发现,果皮、枝条、种子在试验浓度范围内对其生长均有不同程度的促进作用,叶片在试验浓度范围对米槁幼苗生长具有抑制作用,并且抑制作用随浓度增大而逐渐加大。土壤中真菌的构成在其他几个处理(包括CK)间存在显著差异。叶片凋落物的添加虽然改善了土壤营养元素含量,但并未促进米槁幼苗生长,说明米槁叶片凋落物中的自毒物质是影响米槁幼苗生长的重要因素。从物种保护的角度来看,保育米槁天然种群时应当及时清理冠层下的枯枝落叶,以减轻自毒物质在冠层下土壤中的积累,同时也可翻新土壤,便于天然种群中幼苗正常生长,后期也可以考虑在相似生境中进行人工育苗后的迁地保护。
