PI3K/Akt调控糖尿病冠状动脉平滑肌细胞BK通道的作用机制
2022-03-02焦国庆李明秋王如兴胡亚玲LUTong
焦国庆,李明秋,吴 莹,王如兴,胡亚玲,纪 丽,LU Tong
1无锡市转化医学研究所,2南京医科大学附属无锡人民医院心脏外科,江苏 无锡 214023;3Mayo Clinic细胞电生理研究室,美国 明尼苏达州罗切斯特 55905
糖尿病严重危害人类健康,往往合并心、脑、肾、视网膜等脏器和组织的并发症,其中以冠状动脉病变尤为严重,可导致心肌梗死、恶性心律失常和心脏猝死等严重并发症,已成为我国急性心肌梗死的最主要危险因素之一[1]。大电导钙激活钾通道(BK通道)广泛分布于冠状动脉平滑肌细胞上,由4个α亚基和4个β亚基组成,其中α亚基形成BK通道的孔区,β亚基为辅助亚基,对BK 通道动力学起重要调节作用。在血管平滑肌细胞上,主要为β1 亚基,参与血管张力调节,对冠状动脉血管舒张收缩功能起重要调节作用[2-3]。高血糖可上调超氧化物歧化酶(superoxide dismutase,SOD)的水平,SOD 抑制过氧化氢酶表达,导致细胞内活性氧(reactive oxygen species,ROS)显著增加,糖尿病患者体内ROS 增高是糖尿病患者的普遍特征。ROS 是BK 通道的强力抑制剂,使BK通道的生理功能障碍,本课题组以前的研究证实,在糖尿病合并冠心病患者的冠状动脉平滑肌细胞中BK⁃β1降低,BK通道功能障碍[4]。最近的研究表明,细胞氧化应激反应的核因子E2相关因子2(Nrf2)可能参与BK 通道的调节,并可能与E3泛素连接酶引起的BK⁃β1 的分解代谢加快,BK⁃β1降低有关[5-6]。
DNA 依赖的蛋白激酶催化亚单位(DNA⁃Pkcs)属于磷脂酰肌醇⁃3⁃激酶(PI3K)超家族,与蛋白激酶B(Akt)的473 丝氨酸(S473)的磷酸化(p⁃Akt)有关[7]。以前的研究表明,ROS 能激活细胞内DNA⁃Pkcs 和PI3K/Akt 信号传导通路,调节细胞的生长、分化及细胞凋亡[8-9]。本研究探讨糖尿病中PI3K/Akt信号传导通路是否参与冠状动脉平滑肌细胞中BK⁃β1的调节。
1 材料和方法
1.1 材料
人冠状动脉平滑肌细胞(human coronary ar⁃tery smooth muscle cell,HCASMC,中科院上海细胞研究所),HCASMC 培养基SMBM(Lonza Walkers⁃ville 公司,美国),ROS 检测试剂盒、二甲基亚砜(DMSO)、PI3K 抑制剂Wortmannin(上海碧云天公司),ROS 抑制剂GKT137831(SELLECK 公司,美国)。链脲佐菌素(streptozocin,STZ)(Sigma公司,美国)。抗BK⁃a抗体(Alomona公司,以色列),抗BK⁃β 1 抗体(Abcam 公司,美国),DNA⁃Pkcs、Akt、p⁃Akt(S473)(Santa Cruz 公司,美国)。SPF 级Spraque Dawley 8~12周龄的雄性大鼠30只(江苏省血吸虫病防治研究所动物中心),体质量(200±30)g。本研究方案经南京医科大学实验动物伦理委员会批准,实验动物的使用和喂养遵循ARVO声明。
1.2 方法
1.2.1 HCASMC的处理
HCASMC 培养于SMBM 培养基,正常糖浓度培养基及高糖浓度培养基葡萄糖浓度分别为5 mmon/L及15 mmon/L。PI3K抑制剂Wortmannin处理组以不含血清的SMBM培养基加入Wortmannin(100 nmon/L)预处理细胞30 min,再以高糖浓度培养基培养48 h(n=3),对照组以终浓度0.1%(w/w)的二甲基亚砜(DMSO)的无血清培养基预处理细胞30 min,再以高糖浓度培养基培养48 h(n=3)。ROS抑制剂GKT137831处理组以GKT137831(20 μmon/L)加入高糖浓度培养的HCASMC 作用48 h(n=3),对照组以终浓度0.1%(w/w)的二甲基亚砜(DMSO)作用于高糖浓度培养的人平滑肌细胞(n=3)。用预冷的磷酸盐缓冲液冲洗细胞3 次,加入RIPA 裂解液,在冰上充分裂解,离心后收集上清液,采用二喹啉甲酸法测定蛋白浓度。
1.2.2 糖尿病大鼠动物模型的建立及处理
20 只大鼠采用STZ 60 mg/kg 腹腔内注射,2 周后测定大鼠血糖浓度,如血糖浓度低于300 mg/dL,则用等剂量STZ 再次腹腔内注射,持续8 周血糖浓度高于300 mg/dL 诊断为糖尿病。10 只大鼠腹腔内注射生理盐水作为正常对照组(Nor,n=10)。20只糖尿病大鼠中,10 只以GKT137831[40 mg/(kg·d)]灌胃2周(DM+GKT,n=10),10只糖尿病大鼠灌胃相同数量的饮用水2 周(DM,n=10),处死大鼠。分离正常大鼠、糖尿病大鼠及经GKT137831灌胃的糖尿病大鼠冠状动脉,冠状动脉分离方法在课题组相关文献中已有详述[6]。简言之,处死的大鼠酒精消毒后,切开大鼠胸腔,将大鼠心脏连同出入心脏的大血管切下,将切下的心血管组织浸入冰冷的缓冲液中(NaCl 145 mmol/L、KCl 4.0 mmol/L、CaCl20.05 mmol/L、MgCl21.0 mmol/L、HEPES 10 mmol/L、Glucose 10 mmol/L,pH7.20),在外科手术显微镜下使用显微手术器械,自大鼠主动脉根部冠状动脉起始部,沿左侧及右侧冠状动脉走行途径,细微分离右冠状动脉及左冠状动脉。冠状动脉血管组织用液氮速冻后储存于-80 ℃备用。将动脉组织匀浆化,收集总蛋白。
1.2.3 HCASMC及糖尿病大鼠冠状动脉中ROS检测
用细胞渗透荧光探针DCFHDA检测人HCASMC及糖尿病大鼠冠状动脉中的ROS 及GKT137831 对ROS的影响。HCASMC 在5 mmon/L糖浓度(NG组,n=3)、15 mmon/L糖浓度(HG组,n=3)、15 mmon/L糖浓度+GKT137831(HG+GKT组,n=3)孵育48 h后,用PBS洗涤2次,然后加入DCFHDA 10 μL和90 μL无血清SMBM 培养基37 ℃培养30 min,孵育后用PBS洗涤2 次,荧光显微镜480~525 nm检测DCF荧光强度。快速冰冻的大鼠冠状动脉血管环被切割成30 μm厚的切片,并放置在玻璃玻片上(DM,n=3;DM+GKT,n=3)。DCFH⁃DA(25 μmon/L)应用于组织切片,37 ℃避光孵育30 min,荧光显微镜480~525 nm 检测DCF荧光强度,将使用Scion Image软件对DCF信号进行进一步的密度分析。
1.2.4 采用蛋白免疫印迹(Western blot)检测HCASMC及大鼠冠状动脉BK⁃a亚基、BK⁃β1亚基、DNA⁃Pkcs、Akt、p⁃Akt(S473)表达
等量蛋白分别行8%~12%丙烯酰胺凝胶电泳,5%脱脂牛奶室温封闭1 h,一抗4 ℃封闭过夜,洗膜,HRP标记二抗室温封闭2 h。洗膜后再用GAPDH抗血清封闭,ECL试剂盒发光,吸光度分析法定量。
1.3 统计学方法
以SPSS 11.5统计分析软件进行分析,计量资料以均数士标准差()表示。采用t检验对正常组和糖尿病组BK⁃a、BK⁃β1、DNA⁃Pkcs、Akt、p⁃Akt(S473)蛋白表达进行比较,P<0.05 为差异有统计学意义。
2 结果
2.1 不同糖浓度下HCASMC中BK⁃α、BK⁃β1、DNA⁃Pkcs、Akt、p⁃Akt的表达
与5 mmol/L 葡萄糖浓度下的HCASMC 比较,15 mmol/L葡萄糖浓度下HCASMC中BK⁃α表达无明显变化,BK⁃β1 蛋白表达降低(P<0.05),DNA⁃Pkcs、Akt、p⁃Akt的表达增高(P<0.05,图1)。
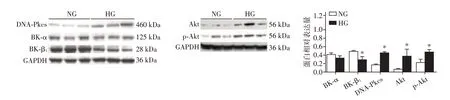
图1 Western blot检测不同葡萄糖浓度下HCASMC中BK⁃α、BK⁃β1、DNA⁃PKcs、Akt、p⁃Akt(S473)的表达Figure 1 Expression of BK⁃α,BK⁃β1,DNA⁃PKcs,Akt and p⁃Akt(S473)of human coronary artery smooth muscle cells in different glucose concentrations by Western blot
2.2 Wortmannin 处 理HCASMC 后BK⁃β1、DNA⁃Pkcs、Akt、p⁃Akt的表达
HCASMC 以Wortmannin(100 nmol/L)预 处理30 min后,在15 mmol/L葡萄糖浓度的SMBM中培养48 h 并和对照组相比较,Wortmannin 处理组,DNA⁃Pkcs、Akt 的表达无明显变化(P>0.05),p⁃Akt 蛋白表达量明显降低,BK⁃β1 的表达量明显增高(P<0.05,图2)。
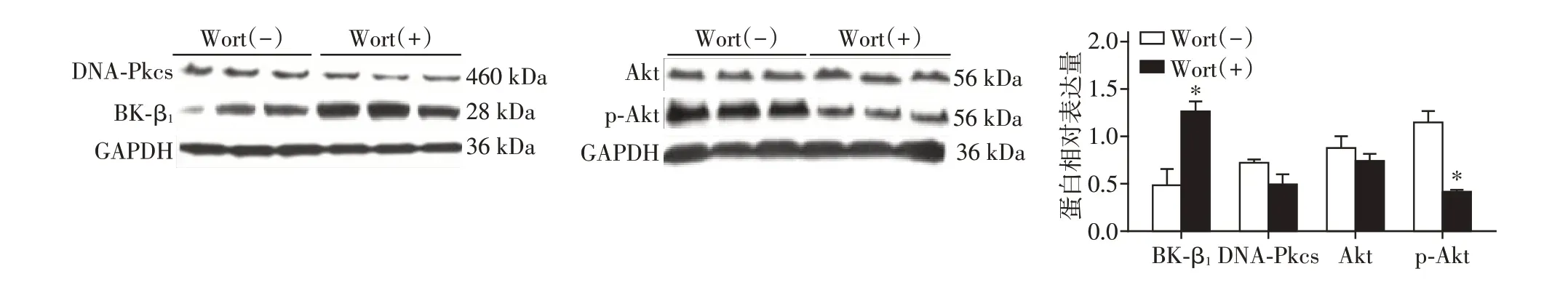
图2 Western blot检测Wortmannin作用于HCASMC后BK⁃β1、DNA⁃Pkcs、Akt、p⁃Akt(S473)的表达Figure 2 Expression of BK⁃β1,DNA⁃Pkcs,Akt and p⁃Akt(S473)of human coronary artery smooth muscle cells treated with Wortmannin by Western blot
2.3 GKT137831作用于15mmol/L糖浓度下的HCASMC48 h后BK⁃β1、DNA⁃Pkcs、Akt、p⁃Akt的表达
与15mmol/L糖浓度下的HCASMC比较,15mmol/L糖浓度下HCASMC经GKT137831处理48 h后,DNA⁃Pkcs、Akt、p⁃Akt蛋白表达降低(P<0.05),BK⁃β1表达量增高(P<0.05,图3)。
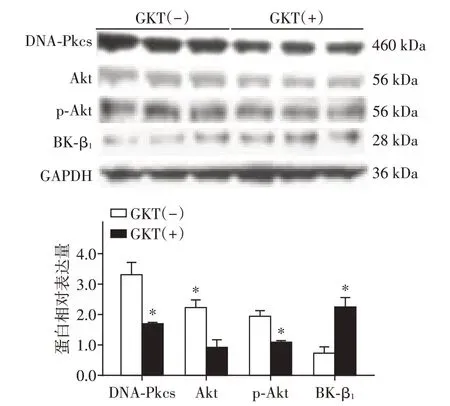
图3 Western blot检测GKT137831作用HCASMC 48 h后BK⁃β1、DNA⁃Pkcs、Akt、p⁃Akt的表达Figure 3 Expression of BK⁃β1,DNA⁃Pkcs,Akt and p⁃Akt(S473)of human coronary artery smooth mus⁃cle cells after treated with ROS inhibitor GKT137831 for 48 h by Western blot
2.4 GKT137831 对HCASMC及大鼠冠状动脉中ROS的影响
DCFH⁃DA 进入细胞,容易被细胞内酯水解将ES 转化为非荧光形式的DCFH,在多种ROS 存在下迅速转化为荧光DCF。15 mmol/L 葡萄糖浓度下的HCASMC 中ROS 明显高于5 mmol/L 葡萄糖浓度(P<0.05)。经GKT137831处理48 h后,和15 mmol/L葡萄糖浓度组相比,GKT137831 处理后的HCASMC中ROS 含量降低约40%(P<0.05)。STZ 诱导的糖尿病大鼠经GKT137831 灌胃2 周后,冠状动脉中ROS 含量较未经GKT137831 处理组降低40%(P<0.05,图4)。
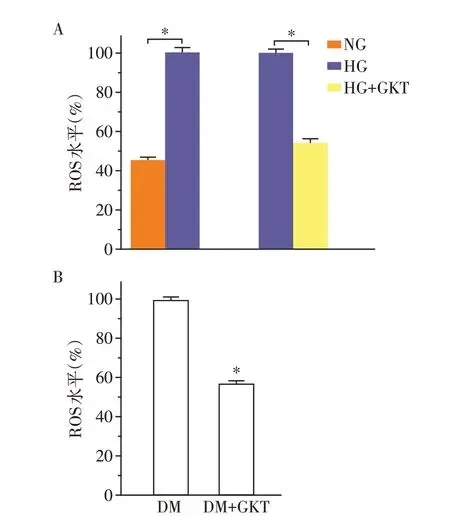
图4 GKT137831 对HCASMC 及糖尿病大鼠冠状动脉ROS的影响Figure 4 ROS Expression of human coronary artery smooth muscle cells and coronary artery from STZ induced diabetic rats treated with GKT137831
2.5 大鼠冠状动脉BK⁃β1、DNA⁃Pkcs、Akt、p⁃Akt的表达
和正常大鼠相比较,STZ 糖尿病模型大鼠冠状动脉DNA⁃Pkcs、Akt、p⁃Akt(S473)表达量分别增加约50%、30%、30%(P<0.05),BK⁃β1 表达量降低约45%(P<0.05);和糖尿病大鼠相比较,GKT137831喂饲2周后的糖尿病大鼠冠状动脉DNA⁃Pkcs、Akt、p⁃Akt(S473)蛋白表达量明显降低(P<0.05)、BK⁃β1表达量明显增高接近于正常大鼠水平(P<0.05,图5)。

图5 Western blot 检测GKT137831 对糖尿病大鼠冠状动脉的BK⁃β1、DNA⁃Pkcs、Akt、p⁃Akt(S473)的影响Figure 5 Expression of BK⁃β1,DNA⁃Pkcs,Akt and p⁃Akt(S473)of coronary artery from STZ induced di⁃abetic rats treated with GKT137831 by West⁃ern blot
3 讨论
BK通道是大电导钙激活钾通道的一种,广泛存在于人体的组织细胞和血管平滑肌细胞中,BK通道调节着血管张力,与血管的血流有关。BK通道电流约占冠状动脉平滑肌细胞总钾离子电流的65%,是冠状动脉平滑肌细胞上最主要的钾通道,在糖尿病等疾病状态下,冠状动脉平滑肌细胞BK 通道开放减少,电流密度降低,蛋白表达减弱,BK通道功能障碍,可能是冠状动脉功能受损的最主要原因[10],因此,积极寻求糖尿病状态下BK 通道蛋白表达减少及功能障碍的原因,对糖尿病状态下冠状动脉疾病的防治,具有重大临床意义。
高糖状态可上调SOD 的水平,导致细胞内ROS显著增加。超氧阴离子自由基和NO反应产生的过氧化亚硝基(OONO-)可抑制大鼠大脑动脉血管平滑肌细胞膜上的BK通道[11]。本课题组以前的研究证实,高糖(22 mmol/L)状态下,转染表达钙激活钾离子通道(hSlo)的HEK293 细胞及HCASMC 中,BK 通道电流密度下降,通道激活和失活动力学减慢。ROS 是BK 通道的强力抑制剂,使BK 通道的生理性激活功能丧失,并且这种抑制效能与敲除BK 通道的β1 亚基相同[4]。本研究中为进一步探讨ROS 是否为高糖状态下HCASMC 中BK⁃β1 表达降低的触发因素,测定了高糖浓度下HCASMC和糖尿病大鼠模型冠状动脉中ROS 水平,证实高糖浓度下HCASMC 和糖尿病大鼠模型冠状动脉中ROS 表达量增高。将ROS 抑制剂GKT137831 作用于高糖培养的HCASMC 发现,HCASMC 中BK⁃β1 表达增高,提示高糖状态下的ROS可能参与了HCASMC中BK⁃β1蛋白调节。
大量研究证据表明,氧化应激时PI3K/Akt 信号通路被激活并通过核因子E2相关转录因子2(Nrf2)激活下游抗氧化基因的表达[12-13]。为了探讨高糖是否通过PI3K/Akt 通路影响BK⁃β1 的表达,在高糖培养的HCASMC 中发现,BK⁃β1 表达明显减少的同时伴有DNA⁃Pkcs、Akt 及p⁃Akt 的表达增高。经GKT137831 作用后的HCASMC 中DNA⁃Pkcs、Akt、p⁃Akt表达量降低,以PI3K抑制剂Wortmannin(100 nmol/L)预处理细胞后,高糖状态下的HCASMC DNA⁃Pkcs、Akt未见明显变化,p⁃Akt的表达明显降低,BK⁃β1表达明显增加。提示高糖状态下,ROS可能通过PI3K/AKT通路参与BK⁃β1的调节。
为了进一步验证糖尿病中ROS 对冠状动脉平滑肌细胞BK⁃β1 的调节作用,在STZ 诱导的糖尿病大鼠中发现,糖尿病大鼠冠状动脉平滑肌细胞ROS、DNA⁃Pkcs、Akt 及p⁃Akt 表达增高,BK⁃β1的表达量降低。GKT137831灌胃2周后的糖尿病大鼠中冠状动脉平滑肌细胞ROS 表达量降低,DNA⁃PKcs、Akt、p⁃Akt、BK⁃β1 蛋白表达量接近于正常大鼠水平,进一步验证在STZ 诱导的Ⅰ型糖尿病大鼠冠状动脉平滑肌细胞中,ROS通过PI3K/AKT信号通路调节BK⁃β1亚基的代谢。
糖尿病中调节BK 通道功能和代谢的因素较多,已有的研究结果证实,二十二碳六烯酸调节BK通道的电流和冠状动脉血管张力[14]。Nrf2、MuF1通过泛素化降解途径影响BK⁃β1的分解代谢[6]。本研究结果显示,糖尿病中ROS 可能通过PI3K/AKT 信号通路部分参与冠状动脉平滑肌细胞BK⁃β1 的调节。本研究初步探讨了糖尿病中ROS 对BK⁃β1 调节的可能机制,局限于ROS对BK⁃β1蛋白表达量的研究,ROS 对冠状动脉平滑肌细胞BK 通道电流的影响以及对冠状动脉血管张力的影响尚有待进一步研究。
