莱菔硫烷对小鼠肺癌细胞凋亡的影响及机制研究
2022-03-02谢叶文
丁 骏,潘 洁,谢叶文,陈 洁,邵 芳
南京医科大学附属常州市第二人民医院中心实验室,江苏 常州 251300
肿瘤的发生发展非常复杂,涉及到多个基因和多个通路的紊乱,尽管近年来国内外在肿瘤的预防和治疗研究方面取得了较大的进展,但是恶性肿瘤造成的患者死亡率仍然很高,对肿瘤的预防和治疗仍然是医学科研界面对的一大难题。研究发现,人们日常食用的植物或水果中含有丰富的抗肿瘤成分,如绿茶中含有茶多酚[1-2],葡萄中含有漆树黄酮[3-4],十字花科植物含有硫代葡萄糖苷[5-6]等。
莱菔硫烷(sulforaphane,SFN)又名萝卜硫素,是一种主要存在于西兰花和其他十字花科蔬菜中的异硫氰酸盐类物质,能够在肿瘤的起始与肿瘤发展的各个环节发挥作用,是抗肿瘤能力最强的植物活性物质之一[7-8]。目前,有报道称SFN对肿瘤增殖的抑制、对肿瘤细胞凋亡的诱导以及化学致癌物代谢的影响都显示出很好的预防前景[9-11]。但是对SFN的研究还需要更加深入,目前缺乏对SFN 作用机制的全面了解。SFN 参与多种细胞生命活动,与SFN相互作用的分子有待鉴定,对细胞周期调控、细胞凋亡、细胞信号转导等的影响机制还需要更进一步探讨。本研究拟用不同浓度的SFN 作用于小鼠肺癌细胞系(Lewis lung cancer cells,LLC)细胞,观察其对LLC 细胞生长、凋亡、氧化应激反应和信号通路的影响,探寻SFN 抑制LLC 细胞生长的作用及其作用机制。
1 材料和方法
1.1 材料
SFN、DCFH⁃DA探针(Sigma公司,美国),CCK⁃8溶液、RIPA 裂解液、BCA 试剂及ECL 试剂盒(上海碧云天公司),细胞凋亡检测试剂盒(BioLegend 公司,美国),细胞周期检测试剂盒(BD公司,),TRIzol试剂(Invitrogen 公司,美国),反转录试剂盒、DNA Marker DL2000、SYBR Premix Ex TaqTM(Perfect Re⁃al Time)(大连TaKaRa 公司),兔抗鼠ERK、p⁃ERK、Nrf2、β⁃actin mAb(Abcam公司,美国)。
1.2 方法
1.2.1 细胞及培养
LLC细胞购自中国科学院上海生科院细胞资源中心,生长培养基为含10%胎牛血清的RPM1640培养基(Gibco 公司,美国),置于37 ℃、5%CO2的培养箱中培养,取对数生长期细胞做后续实验。
1.2.2 CCK8增殖实验
细胞增殖实验CCK8检测SFN 对LLC 细胞增殖能力的影响。用胰蛋白酶消化对数期生长的LLC细胞,制成单细胞悬液以每孔2×104个/mL细胞接种到96 孔板中,每孔设置5 个复孔,继续培养24 h 后进行分组及不同浓度SFN 处理,分别在处理6、24、48、72 h终止培养,每孔加入CCK8试剂10 μL后继续放入培养箱孵育3 h,最后在酶标仪上测各孔450 nm波长处的吸光值,绘制细胞生长曲线。
1.2.3 细胞凋亡检测
胰蛋白酶消化对数期生长的LLC 细胞,制成单细胞悬液以每孔3×105个/mL 细胞接种到6 孔板中,培养24 h 后进行不同浓度SFN 处理,细胞经SFN 后用不含EDTA 的胰酶消化细胞,终止消化后收集细胞,用PBS 洗涤离心2 次后加入100 μL 的binding buffer 和5 μL 的荧光团标记的抗体(Annexin V⁃APC、7⁃ADD),室温孵育15 min,加入400 μL 的binding buffer后再流式细胞仪上检测凋亡情况。结果用FlowJo 7.6.1分析细胞凋亡率。
1.2.4 细胞周期试验
取对数生长期LLC细胞悬液,接种于6孔板,每孔接种数为5×105个细胞,各细胞孔分别加入0、12.5、25.0 μmol/L SFN。加药后48 h胰酶消化细胞,PBS 洗2 遍后,用70%冰乙醇重悬,于-20 ℃固定过夜。固定离心后PBS清洗2遍,进行PI染色后流式细胞仪检测,Modifit软件分析结果,实验过程重复3次。
1.2.5 基因表达量检测
根据NCBI(http://www.ncbi.nlm.nih.gov)上GAP⁃DH、CyclinD1、CDK4、CDK6、CDK1 和CyclinB1 基因核苷酸序列,利用DNAMAN 6.0 及Primer Premier 5.0软件,设计正、反向引物(表1),引物合成和测序由上海生工生物公司完成。

表1 PCR引物的信息Table 1 Information of PCR primers
提取12.5、25.0 μmol/L SFN 处理24 h、48 h 的LLC 细胞RNA,RNase free H2O 充分溶解,测定其浓度,于-80 ℃保存备用。取5 μL(100 ng/μL)RNA进行反转录反应,再运用荧光定量PCR 检测,反应体系总体积为20 μL:SYBR Premix ExTapTM Ⅱ(2×)10 μL,PCR Forward Primer(10 μmol/L)0.4 μL,PCR Reverse Primer(10 μmol/L)0.4 μL,ROX Reference Dye Ⅱ(50×)0.4 μL,cDNA 1 μL,RNase⁃free H2O 6.8 μL;qRT⁃PCR扩增条件为:95 ℃30 s,95 ℃10 s,60 ℃30 s,循环40 次。在AB(应用生物系统)公司的7500型实时荧光定量PCR仪上进行。
1.2.6 细胞内活性氧(reactive oxygen species,ROS)检测
将对数生长期的LLC 细胞接种于6 孔板,每孔接种5×105个细胞,在37 ℃含5%C02培养箱中培养24 h,分别加入12.5、25.0 μmol/L SFN,继续培养24、48 h。细胞用胰蛋白酶进行消化,PBS 清洗后,向200 μL细胞悬液中加入5 μL DCFH⁃DA,并在室温黑暗条件下孵育30 min,离心,弃上清,用PBS洗2次。用流式细胞仪分析细胞,检测荧光变化情况。
1.2.7 Western blot实验
收集SFN 处理的细胞,PBS 洗涤2 次,去除上清,每个样品加入100 μL RIPA+1 μL PMSF后放置冰上30 min,每隔10 min摇匀1次,然后在12 000g4 ℃离心15 min,收集上清并用BCA 试剂盒检测其蛋白浓度。每100 μL 样品加入25 μL 5×SDS⁃PAGE蛋白上样缓冲液,混匀后100 ℃变性10 min。将蛋白样品进行SDS⁃PAGE,湿转至甲醇浸润过的PVDF 膜上。用50 g/L脱脂奶粉溶液封闭1.5 h,PBST洗膜3次,每次10 min,加入一抗(1∶1 000),4 ℃摇床过夜;去除一抗液,用PBST洗膜3次,每次10 min,加入二抗(1∶3 000),室温孵育1.5 h,PBST洗涤3次后采用ECL化学发光法曝光拍照。用Image J对实验结果进行分析。
1.2.8 小鼠成瘤实验
取对数生长期的LLC细胞,细胞达80%~90%密度为宜。胰酶消化细胞后用预冷的PBS洗2遍。用PBS 吹打细胞沉淀至浓度为3×106个/mL。每只C57BL/6J 小鼠腹股沟中上部皮下注射100 μL 细胞混悬液,建模1 周待小鼠皮下出现肿块后,随机将小鼠进行分组,给予药物干预,即分别用PBS 和0.5 mg/kg的SFN灌胃处理,1周5次,连续处理2周,并对肿块进行测量,1 周3 次,游标卡尺测量肿瘤最长和最短部位。V=1/2×a×b2(a为长轴,b为短轴)。
1.3 统计学方法
实时荧光定量PCR 结果采用2-ΔCT进行分析。采用SPSS 21.0统计软件,数据用均值±标准差()表示,组间比较采用t检验或方差分析,P<0.05 为差异有统计学意义。。
2 结果
2.1 SFN对LLC细胞增殖的影响
利用CCK8检测了SFN 对小鼠肺癌细胞LLC 增殖的影响,与对照组相比,随着处理时间增加,SFN处理LLC细胞后增殖能力明显减弱。12.5 μmol/L SFN处理细胞48 h后细胞数量较对照组减少,差异有统计学意义(P<0.01),25.0 μmol/L SFN处理细胞24 h后细胞数量软对照组减少,差异有统计学意义(P<0.05,图1),表明SFN可以抑制LLC细胞的增殖。

图1 SFN对LLC细胞增殖的影响Figure 1 The effect of SFN on the LLC cell proliferation
2.2 SFN对LLC细胞凋亡的影响
为研究SFN 对LLC 细胞凋亡能力的影响,细胞计数培养24 h 后,分别用12.5 和25.0 μmol/L 的SFN处理LLC细胞,用细胞凋亡试剂盒Annexin V⁃APC/7⁃AAD 对LLC细胞染色,结果发现,随着SFN浓度的增加,LLC细胞晚期凋亡比例逐渐升高,12.5 μmol/L的SFN 处理LLC 细胞24 h、48 h 的细胞凋亡率分别是7.24%和16.22%,25.0 μmol/L 的SFN 处理LLC 细胞24 h、48 h的细胞凋亡率分别是57.22%和75.12%(图2),表明SFN可以促进LLC细胞的凋亡。

图2 SFN对LLC细胞凋亡的影响Figure 2 The effect of SFN on the apoptosis of LLC cell line
2.3 SFN对LLC细胞周期阻滞的影响
为了研究SFN 对LLC 细胞周期阻滞的影响,细胞计数培养24 h后,用SFN处理LLC细胞,流式细胞术检测发现,25.0 μmol/L 的SFN 作用LLC 细胞24 h后,细胞周期分布出现了显著变化,处于G1 期的细胞比例明显下降(P<0.05),G2/M 期的细胞比例明显上升(P<0.01,图3)。同时检测了细胞周期相关基因的表达量,25.0 μmol/L的SFN处理LLC细胞24 h后,CyclinB、CyclinD、CDK1、CDK4 和CDK6 基因的表达量下降(P<0.01,图4),说明SFN 处理细胞后,将细胞周期阻滞在G2/M 期,使其不能进入下一个细胞阶段。

图3 SFN对LLC细胞周期阻滞的影响Figure 3 Effect of SFN on the cell cycle of LLC cells

图4 SFN对细胞周期相关基因表达的影响Figure 4 The effect of SFN on the expression of cell cycle related genes
2.4 SFN对LLC细胞内ROS表达的影响
DCFH⁃DA 探针用于特异性鉴定细胞内ROS 含量,它可以穿过细胞膜并被细胞内的酯酶水解生成DCFH,而细胞内的ROS可以将无荧光标记的DCFH转变为有荧光标记的DCF。所以,通过检测细胞内DCF的荧光强度就可以检测ROS的水平。LLC细胞计数培养24 h后,分别用12.5 μmol/L和25.0 μmol/L的SFN作用LLC细胞24 h后,流式细胞术检测发现,当用12.5 μmol/L 和25.0 μmol/L 的SFN 处理LLC 细胞24 h后,细胞内ROS的表达水平显著增高(图5)。

图5 SFN对LLC细胞中ROS水平的影响Figure 5 The effect of SFN on the ROS levels of LLC cell line
2.5 SFN对ERK磷酸化的影响
为进一步研究SFN 促进乳腺癌细胞迁移和侵袭能力的分子机制,通过Western blot检测对照组和SFN 处理组中的ERK 的磷酸化水平变化。结果显示,随着SFN 浓度的增高,细胞内Nrf2 的蛋白表达水平显著增高,ERK 磷酸化水平逐渐增强(P<0.01);用25.0 μmol/L处理LLC细胞4 h后,Nrf2的蛋白表达水平和ERK 磷酸化水平表达显著高于对照组,差异有统计学意义(P<0.05,图6)。

图6 SFN对Nrf2⁃ERK蛋白表达的影响Figure 6 The effect of SFN on the Nrf2⁃ERK signaling pathway
2.6 SFN对小鼠体内肿瘤生长的影响
小鼠成瘤实验结果发现,给药10 d后,SFN组小鼠的肿瘤体积与对照组相比明显减小(P<0.05,图7)。
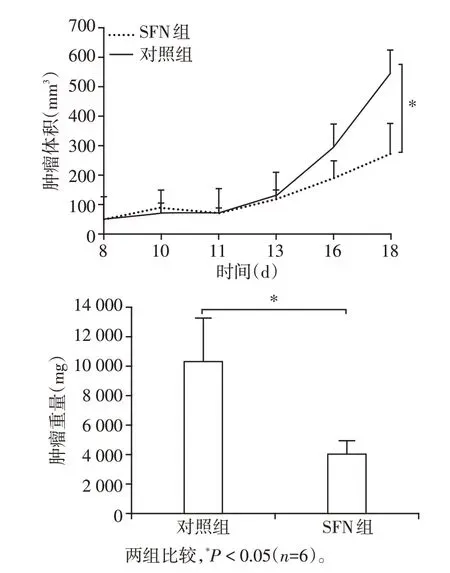
图7 SFN对小鼠肿瘤体积和重量的影响Figure 7 Effect of SFN on tumor size and weight in tu⁃mor mice model
3 讨论
植物中存在的天然异硫氰酸酯可以显著降低肿瘤的发生率[12-14]。目前已经证明的具有抗肿瘤活性的异硫氰酸酯类化合物有多种,SFN 便是其中之一[15-17]。研究表明,SFN 可以在肿瘤发生发展的各个阶段起到抑制作用,还可以通过线粒体通路、死亡配体通路、内质网通路等多种不同的途径诱导肿瘤细胞凋亡。
本研究从细胞及动物水平验证SFN对LLC细胞的影响,通过CCK⁃8 法检测SFN对LLC增殖率的影响,结果显示SFN能显著抑制LLC细胞的增殖,且这种抑制作用呈SFN 浓度依赖性;用流式细胞术研究了SFN 对LLC 细胞周期和细胞凋亡的影响,发现随着SFN浓度的增加,LLC细胞晚期凋亡率逐渐增加;其次,处于G0/G1 期的细胞比例明显下降,而G2/M期的细胞比例明显上升,细胞周期相关基因CCDN1、CDK4、CDK6、CyclinB1和CDK1表达显著性下降。细胞周期的调控涉及细胞周期蛋白、细胞周期依赖性蛋白激酶及周期蛋白依赖性激酶抑制因子的整个协同运作。Cyclin D1 基因编码G1/S 特异性周期蛋白D1,是细胞周期的启动因子,属于高度保守的细胞周期家族,该家族在整个细胞周期中蛋白丰度具有周期性变化。CCND1 这种亚型的周期蛋白与CDK4 或CDK6 形成复合物并作为它们的调节亚基,促进细胞增殖[18-19]。CyclinB1和CDK1 作为细胞周期G2/M 检查点的主要调控元件,CDK1 与CyclinB1 复合物的活化是启动有丝分裂的关键,同样是G2 期进入M 期的必要条件,是一个主要的在G2/M 期发生转变,调控细胞是否通过G2 期检查点的总开关[20]。SFN作用LLC细胞后的周期变化说明其可以调控LLC 细胞的细胞周期,将其细胞周期阻滞在G2/M期,使其不能进入下一个细胞阶段G0/G1期和S 期,从而阻止细胞完成DNA 的合成和修复,进而使LLC 细胞的增殖不能进入到下一个细胞周期,启动细胞凋亡,抑制LLC 细胞生长增殖,从而可能达到治疗肿瘤的目的。
在细胞凋亡的调控过程中氧化应激反应的作用至关重要,肿瘤细胞内的氧化还原稳态依赖于促氧和抗氧两个过程的相互平衡,两者异常都会造成细胞内ROS 水平的升高。研究表明,SFN 是一种有效的Nrf2诱导剂,其能够调控Nrf2从而诱导Ⅱ相解毒酶的活性,诱导细胞防御[21-22]。Nrf2 为细胞防御机制的激活剂,氧化还原主要开关[23]。Nrf2 可以在细胞核之间自由穿梭、迁移,胞质内的Keap⁃1 与Nrf2 结合在肌动蛋白的骨架上,两者的结合状态可以调控细胞内蛋白体的降解[24]。本研究用SFN 处理LLC细胞后,细胞的ERK磷酸化程度随着SFN的作用浓度和作用时间显著增强,Nrf2 的蛋白水平也显著上升,且细胞内ROS表达水平显著升高。这一结果可能由于SFN 能够直接结合在Keap⁃1 的巯基上切断与Nrf2的结合,从而触发细胞的ERK磷酸化作用使得Nrf2 从结合体上释放出来,分离后的Nrf2进入细胞核与ARE结合,诱导和上调Ⅱ相解毒酶的水平[25-27],抑制肿瘤细胞的抗氧化活性,使得肿瘤细胞内的ROS水平升高,促进肿瘤细胞的凋亡。
总之,本研究结果表明SFN 处理LLC 细胞后激活了细胞内ERK 磷酸化,使得细胞内Nrf2 表达增加,细胞内ROS含量升高,阻滞细胞周期,从而加速肿瘤细胞的凋亡,抑制肿瘤细胞的生长。SFN 大量存在于常见的可食性十字花科蔬菜,具有很好的安全性。此外,SFN 的亲脂性和低分子量易于被动扩散到细胞中,可以被迅速吸收[28]。因此,SFN将会是一种安全且有效的抗癌药物,可能具有一定的市场应用前景。
