龙须菜(Gracilariopsis)/江蓠(Gracilaria)的生长和种质特性分析
2022-03-01宣雯燕张莹莹陈琼琳罗素雅徐年军
宣雯燕, 张莹莹, 陈琼琳, 罗素雅, 孙 雪, 徐年军
龙须菜()/江蓠()的生长和种质特性分析
宣雯燕, 张莹莹, 陈琼琳, 罗素雅, 孙 雪, 徐年军
(宁波大学海洋学院 浙江省海洋生物工程重点实验室, 浙江 宁波 315211)
龙须菜()是具有重要经济价值和生态效益的大型红藻, 主要用作琼胶提取原料和鲍的饵料。本研究利用生理生化、液相色谱-质谱联用和氨基酸分析等方法, 比较了龙须菜() (wt、981、Gl-1、Gl-s、Gl-g)、异枝龙须菜(, Gh)和细基江蓠繁枝变种(var., Gt)的生长及藻胆蛋白、琼胶、红藻糖苷和氨基酸等的差异, 以期为龙须菜/江蓠栽培中的种质区分及选择提供参考。结果表明Gt在23 ℃和30 ℃条件下生长均最快, 其相对生长速率分别为野生型龙须菜(wt)的2.19倍和2.49倍。龙须菜Gl-s中藻胆蛋白浓度最高, 为wt的1.91倍。除了Gt之外, 其余6种藻中琼胶产率较高(16.22%~18.91%)。Gt中红藻糖苷和海藻糖积累最多, 分别为wt的3.50倍和1.81倍。Gl-g、Gl-s、Gt和Gh多糖丰富, 在36.89%~40.23%; 龙须菜981、Gl-1、wt和Gl-s总氨基酸浓度较高, 在152.35~161.32 mg·g–1干质量之间, 并且981、Gl-1、Gl-s氨基酸评分较优。综合以上结果, 龙须菜981、Gl-1和Gl-s的藻胆蛋白、琼胶和氨基酸等均显著优于其他藻, 并且生长较快, 可用于琼胶、藻胆蛋白及多糖的提取或鲍的饵料; 而细基江蓠繁枝变种生长快、红藻糖苷和海藻糖丰富, 可大规模栽培用作鲍的饵料。该研究为丰富及开发利用中国大型海藻种质资源提供了重要的资料。
龙须菜(); 江蓠(); 生长; 种质; 琼胶
龙须菜属()是大型红藻江蓠目(Gracilariales)中的一个属, 由Bird等[1]根据18S rDNA等基因序列将其从江蓠属()中分出来。龙须菜属和江蓠属中的很多种都具有重要的经济价值, 是提取琼胶的主要原料, 同时也是鲍等水产生物饵料。据《2020年中国渔业统计年鉴》数据,中国江蓠属海藻, 主要是龙须菜()在2019年产量为3.481×105t干品, 已成为产量第二的大型栽培海藻[2]。此外, 龙须菜藻胆蛋白可以作为天然色素用于食品、化妆品及荧光探针[3]; 龙须菜多糖还具有抗肿瘤、抗氧化、抗衰老等多种生物活性[4-5]。
野生型龙须菜分布于中国北方海域的沙沼、砾石或覆沙的岩礁, 春、秋两季生长, 生长期短, 自然资源量少。后来, 耐高温、高产龙须菜新品系相继选育成功, 如龙须菜981、鲁龙1号等。这些优良的龙须菜选育品系在中国山东、福建等海域栽培, 带来了巨大的经济和生态效益, 形成了大规模的龙须菜产业。
龙须菜作为一种重要的栽培藻类资源, 其相关的研究多集中在琼胶[6-7]、逆境胁迫[8-9]、生态效益[10]等方面, 而关于龙须菜种质特性的报道相对较少。海区栽培龙须菜主要依靠营养繁殖, 栽培人员多根据藻体颜色、粗细和分枝多少等来区分所用的藻种。龙须菜长期生活在不同海区环境中, 不仅藻体形态上有所差别, 而且其理化特性等也发生了较大的变化。因此, 本研究从山东、福建、广东采集了野生型和栽培的龙须菜、异枝龙须菜()和细基江蓠繁枝变种(var.), 对这些龙须菜/江蓠进行生长、生化组成和种质特性的比较, 为龙须菜栽培生产中的种质选用及种质资源开发利用提供资料。
1 材料与方法
1.1 实验材料
本实验共选用7种海藻材料: 野生型龙须菜(wt)、龙须菜981、龙须菜Gl-1、龙须菜Gl-s、绿色龙须菜(Gl-g)、异枝龙须菜(Gh)和细基江蓠繁枝变种(Gt), 其中Gh和Gt由谢恩义老师帮忙采集。藻体采集信息及形态等特征见表1。采集回来的海藻经过海水充分清洗、去除表面泥沙和附着物后, 在23 ℃、盐度25、30 μmol·m–2·s–1光照强度和12L∶12D光周期的光照培养箱中进行培养。

表1 龙须菜/江蓠来源和颜色、形态信息
1.2 相对生长速率测定
分别选取6~8 cm长的幼嫩藻体8~10根, 用滤纸充分吸干表面水分, 准确称取藻体鲜质量(FW)。在23 ℃和30 ℃, 分别培养5 d后再次称取藻体鲜质量, 每组设置3个重复。根据以下公式来计算各藻的相对生长速率(GR, %·d–1)[11]:GR=(lnW-ln0)/×100%, 其中0为实验开始时藻体鲜质量,W为实验结束时藻体鲜质量,为培养天数。
1.3 藻胆蛋白浓度测定
参考朱招波等[12]进行藻体的总藻胆蛋白的提取及各藻胆蛋白——藻红蛋白(PE)、藻蓝蛋白(PC)和别藻蓝蛋白(APC)的测定。按照公式PE=0.123565-0.068615+0.015650,C=0.162615-0.001565-0.098650,APC=0.171650-0.006565-0.004615来计算3种藻胆蛋白的浓度, 其中代表浓度,代表吸光度。
1.4 琼胶产率测定
参照汤小彬等[13]的方法稍有改动。准确称取0.5 g藻体(干质量, DW), 用NaOH碱处理法提取琼胶。按照公式:=/×100%来计算藻体的琼胶产率, 其中为琼胶产率(%),为琼胶干质量,为藻体干质量。
1.5 红藻糖苷/异红藻糖苷、海藻糖浓度测定
将冷冻干燥的龙须菜在液氮中充分研磨成粉末, 再准确称取10 mg干藻粉, 参照Lv等[14]方法进行样品的研磨、提取、干燥、超声波处理等, 最后取上清液过0.22 μm有机相滤膜后上机分析。使用Thermo Fisher Scientific的液相色谱-质谱联用仪(LC-MS, 其中高效液相色谱仪为U3000型、质谱仪为Q-Exactive型)进行3种糖的测定。以坛紫菜中红藻糖苷和异红藻糖苷及D-(+)-海藻糖(Sigma-Aldrich)为标准品。使用Xcalibur(Thermo Fisher Scientific)软件进行LC-MS数据获取和分析。
1.6 多糖、总蛋白、灰分浓度测定
藻体的多糖测定采用蒽酮-硫酸比色法, 使用南京建成生物工程研究所的相应试剂盒进行; 总蛋白质测定采用凯氏定氮法; 灰分测定参考GB 5009.4—1985食品中灰分的测定方法[15]。
1.7 氨基酸浓度测定和评分
准确称取0.1 g冻干研磨后藻粉置于厌氧水解管中, 加入盐酸水解过滤后真空干燥, 加入1 mL样品稀释液(pH 2.2)溶解, 用0.22 μm水系滤膜过滤后在全自动氨基酸分析仪(Sykam, S-433D)上进行氨基酸检测。检测波长570 nm和440 nm; 58~74 ℃梯度温控; 进样量0.05 mL; 流动相: 柠檬酸钠A浓度为0.12 mol·L–1(pH 3.45), B浓度为0.2 mol·L–1(pH 10.85); 流速: 洗脱泵0.45 mL·min–1, 衍生泵0.25 mL·min–1; 压力: 3~4 MPa。用藻体中某种氨基酸浓度占联合国粮农组织/世界卫生组织(FAO/ WHO)评分模式中该氨基酸浓度的百分比来表征该氨基酸的评分。
1.8 数据分析
使用Excel 2019进行数据处理, 利用OriginPro 2018进行作图。实验数据均以平均值±标准差(mean± SD)表示, 并采用SPSS 22.0进行one-way ANOVA (Duncan)或T-test分析, 以<0.05为差异显著水平。
2 结果与分析
2.1 龙须菜/江蓠的形态比较
在7种龙须菜/江蓠材料中, Gl-g、Gh和Gt在颜色上很容易与其他4种龙须菜区分(图1和表1); 另外4种龙须菜藻体均呈现红褐色。在形态上, 龙须菜wt、981和Gl-1藻体细长多分枝, 龙须菜Gl-s、Gl-g藻体较为短小、粗壮, 其中Gl-s藻体具有韧性, 不易折断; Gh藻体较为扁平粗壮、分枝多, 而Gt藻体分枝密且短、脆弱易断。
注: wt为野生型龙须菜, 981为龙须菜981, Gl-1为龙须菜Gl-1, Gl-s为龙须菜Gl-s, Gl-g为绿色龙须菜, Gh为异枝龙须菜, Gt为细基江蓠繁枝变种
2.2 龙须菜/江蓠的生长比较
在常温和高温条件下, 龙须菜/江蓠生长速率不同(图2)。在常温23 ℃时, Gt生长最快, 其GR为4.36%·d–1, 为wt的2.19倍; 其次是wt、981和Gl-1, 其GR在1.65%·d–1~1.99%·d–1之间; Gl-s、Gl-g、Gh生长缓慢(0.51%·d–1~0.70%·d–1)。在30 ℃时Gt生长也最快(GR为3.88%·d–1), 为wt的2.49倍; 其次是981、Gl-1、Gl-s, 其GR在1.95%·d–1~2.83%·d–1之间; 生长最慢的是Gl-g, 其GR为0.25%·d–1。23 ℃是龙须菜生长的合适温度, 藻体生长和状态正常; 而30 ℃高温培养5 d后, wt部分藻体变白。
不同温度对各龙须菜/江蓠生长的影响不同, 表现为以下3种情况: 1) 高温促进藻的生长, 如Gl-1、Gl-s和Gh, 在高温条件下的生长速率分别为常温下的1.58倍、3.22倍和2.69倍。2) 温度变化对藻生长影响不显著, 如wt、981和Gt。3) 高温抑制藻的生长, 如Gl-g在高温时的GR为常温培养时的44.84%。
2.3 龙须菜/江蓠的藻胆蛋白分析
藻胆蛋白是龙须菜/江蓠中重要的色素蛋白。7种藻体的PE浓度在0.08~0.61 mg·g–1FW之间, PC浓度为0.09~0.19 mg·g–1FW, APC浓度在0.10~0.39 mg·g–1FW之间(图3)。其中, wt、981、Gl-1和Gl-s的PE浓度显著高于其他材料, 这与其藻体颜色相一致。在7种材料中(表2), Gl-s藻胆蛋白浓度最高(1.03 mg·g–1FW), 是wt的1.91倍; Gh最低, 仅为0.26 mg·g–1FW。
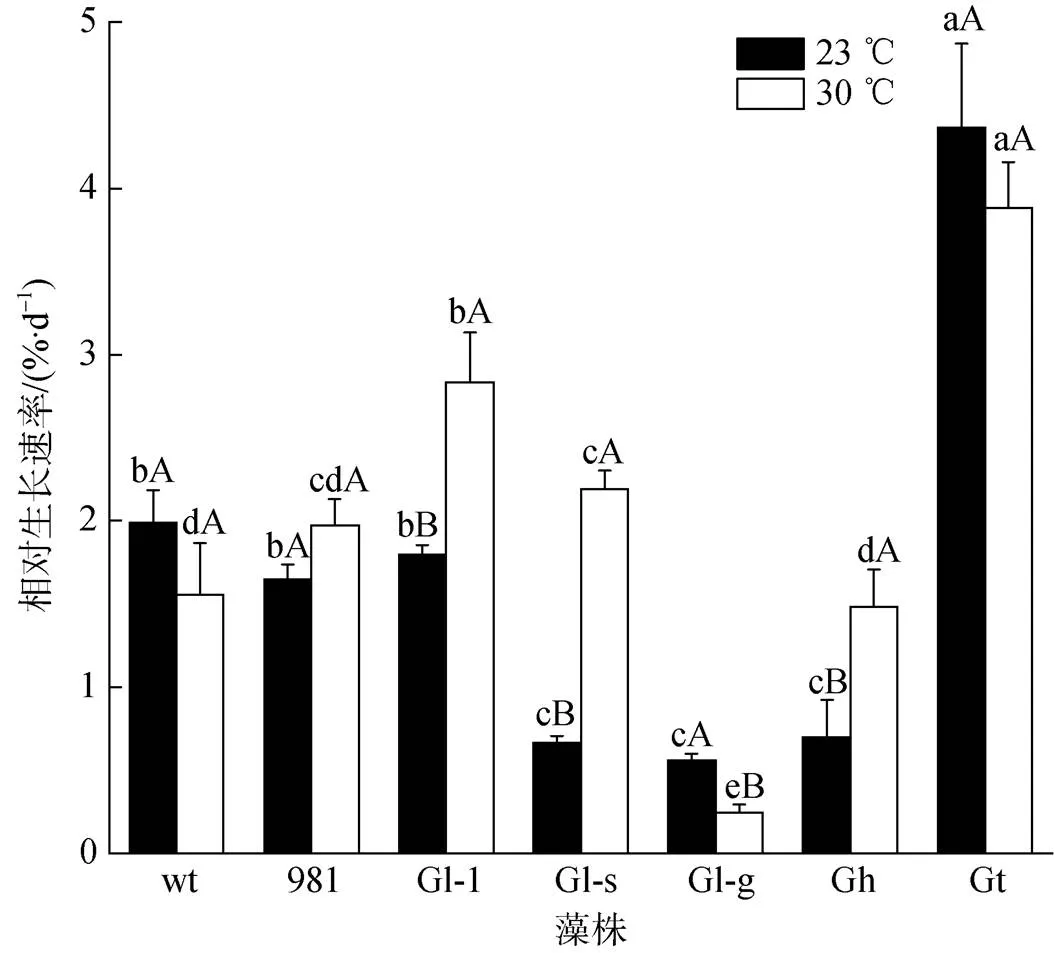
图2 龙须菜/江蓠在23 ℃和30 ℃下的生长
注: 不同小写字母分别表示同温度不同藻之间差异显著, 不同大写字母表示同种藻两种温度之间差异显著, wt为野生型龙须菜, 981为龙须菜981, Gl-1为龙须菜Gl-1, Gl-s为龙须菜Gl-s, Gl-g为绿色龙须菜, Gh为异枝龙须菜, Gt为细基江蓠繁枝变种
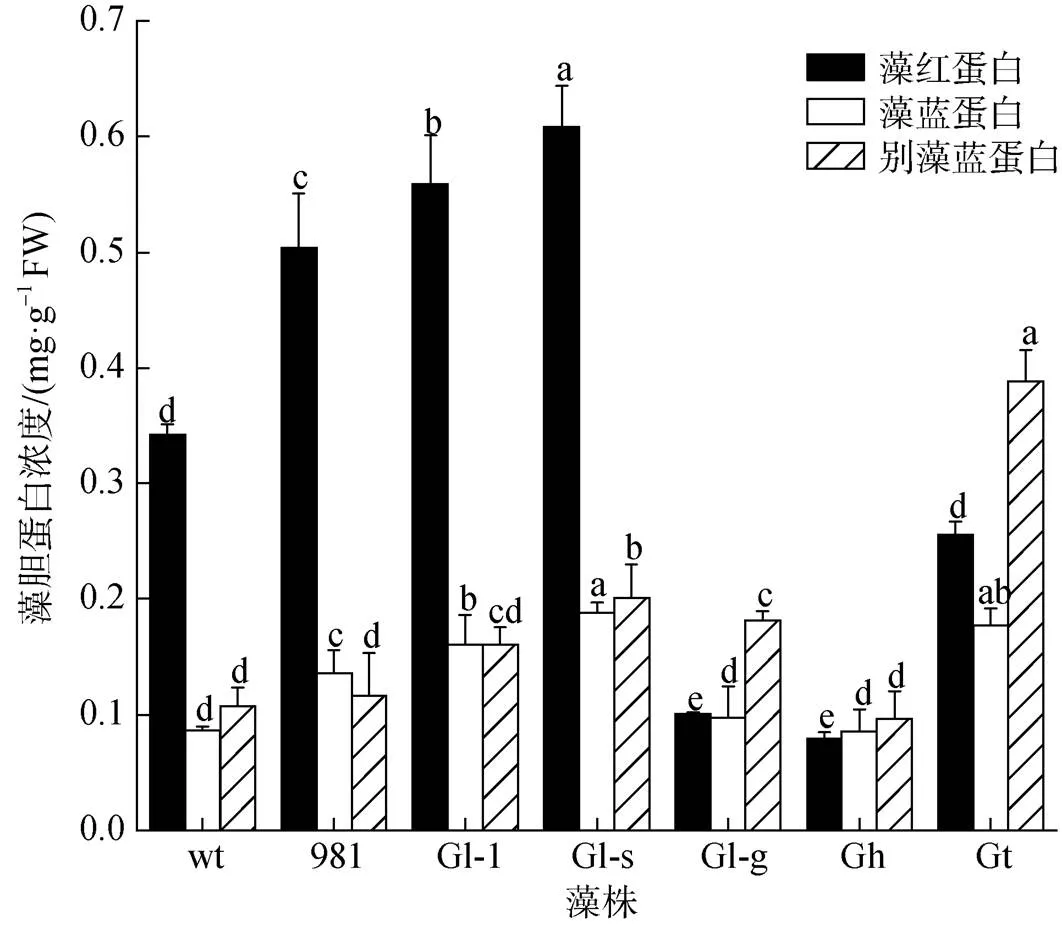
图3 龙须菜/江蓠藻胆蛋白浓度
注: 不同小写字母分别表示各藻胆蛋白在不同藻之间差异显著(<0.05), FW表示鲜质量, wt为野生型龙须菜, 981为龙须菜981, Gl-1为龙须菜Gl-1, Gl-s为龙须菜Gl-s, Gl-g为绿色龙须菜, Gh为异枝龙须菜, Gt为细基江蓠繁枝变种
在3种藻胆蛋白中, 红藻中一般藻红蛋白PE所占比例最高。从表2可以看出, 除Gl-g之外的4种龙须菜PE占总藻胆蛋白的比例较高(60.98%~66.62%), Gl-g、Gh和Gt中PE在总藻胆蛋白中所占比例较低(26.45%~31.86%), 该结果与藻体颜色差异相一致。4种红褐色龙须菜中APC占总藻胆蛋白比例较低, 在15.37%~20.16%之间, 而PE较低的3种藻中APC占比最高, 在38.01%~47.84%之间。PC占总藻胆蛋白比例在7种材料中差异较小, 在16.16%~30.13%之间。
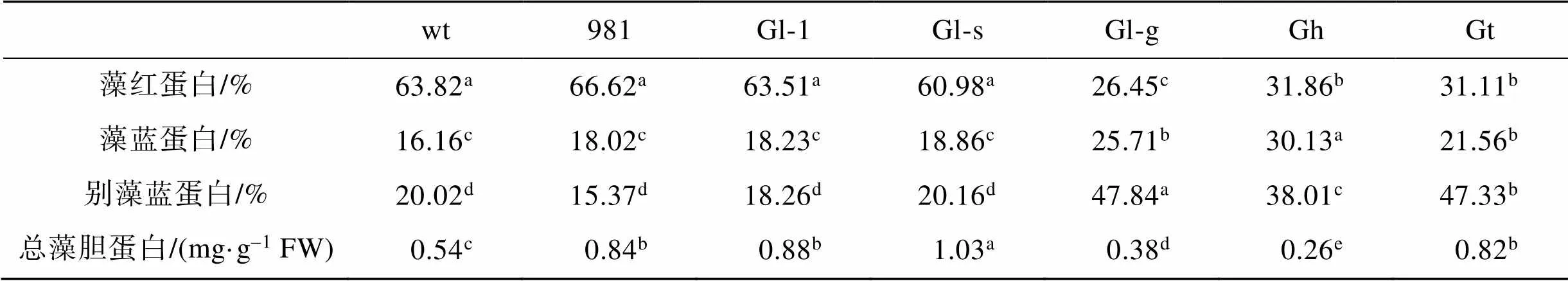
表2 龙须菜/江蓠各藻胆蛋白在总藻胆蛋白中所占的比例
注: 不同小写字母表示不同藻各藻胆蛋白占比具有显著差异(<0.05), FW表示鲜质量, wt为野生型龙须菜, 981为龙须菜981, Gl-1为龙须菜Gl-1, Gl-s为龙须菜Gl-s, Gl-g为绿色龙须菜, Gh为异枝龙须菜, Gt为细基江蓠繁枝变种
2.4 龙须菜/江蓠琼胶产率分析
本实验中7种藻的琼胶产率表现为2个水平(图4)。其中wt、981、Gl-1、Gl-s等6个样品的琼胶产率较高, 在16.22%~18.91%之间, 且无显著性差异。而Gt琼胶产率较低, 仅为藻体干质量的12.53%。

图4 龙须菜/江蓠的琼胶产率
注: 不同小写字母表示不同藻之间差异显著(<0.05), wt为野生型龙须菜, 981为龙须菜981, Gl-1为龙须菜Gl-1, Gl-s为龙须菜Gl-s, Gl-g为绿色龙须菜, Gh为异枝龙须菜, Gt为细基江蓠繁枝变种
2.5 红藻糖苷/异红藻糖苷、海藻糖浓度分析
不同龙须菜/江蓠中红藻糖苷和异红藻糖苷差别很大(图5)。在7种材料中, Gt和Gh中红藻糖苷最高, 分别是23.98 mg·g–1DW和22.85 mg·g–1DW, 两者分别是wt的3.50倍和3.36倍; 其次是Gl-g (19.06 mg·g–1DW); 而Gl-1中红藻糖苷最低, 为0.37 mg·g–1DW。与红藻糖苷相比, 龙须菜/江蓠中异红藻糖苷较低。在7种材料中, Gl-g中异红藻糖苷最高(7.79 mg·g–1DW), wt、981和Gl-s中异红藻糖苷次之, 在1.42~1.91 mg·g–1DW之间, 而Gl-1中异红藻糖苷最低(0.26 mg·g–1DW)。在7种材料中, Gl-g中红藻糖苷和异红藻糖苷总量最高(26.85 mg·g–1DW); Gt中两种糖苷差别最大, 红藻糖苷大约是异红藻糖苷的44.33倍。
不同龙须菜/江蓠中海藻糖差异显著(图6)。海藻糖最丰富的是Gt(0.60 mg·g–1DW), 其次是981 (0.46 mg·g–1DW)和Gl-s(0.38 mg·g–1DW), 而Gl-1的海藻糖最低, 仅为0.08 mg·g–1DW。Gt中海藻糖是wt的1.81倍, 是Gl-1的7.50倍。
2.6 龙须菜/江蓠多糖、总蛋白以及灰分分析
多糖是龙须菜/江蓠的重要组成成分。本研究中7种材料, 多糖占比最高的是Gl-g和Gl-s, 分别为40.23%和38.96%(>0.05); 最低的是981和Gl-1, 其多糖所占比例分别为29.34%和28.92% (>0.05); 其余样品多糖占比在31.05%~37.28%之间(表3)。
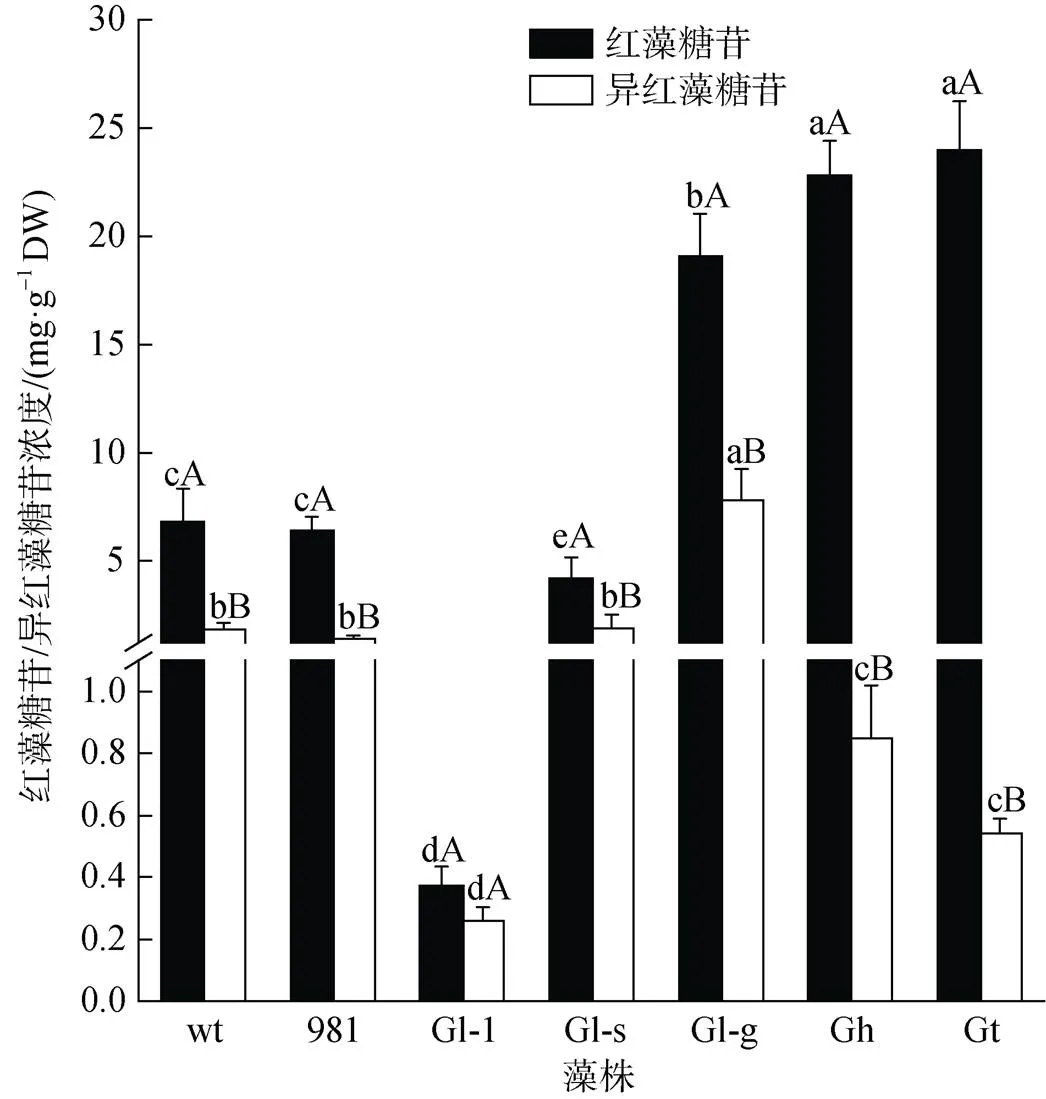
图5 龙须菜/江蓠中红藻糖苷/异红藻糖苷浓度
注: 不同小写字母表示同种糖苷在不同藻之间差异显著(<0.05), 不同大写字母表示同种藻中两种糖苷差异显著(<0.05), DW为干质量, wt为野生型龙须菜, 981为龙须菜981, Gl-1为龙须菜Gl-1, Gl-s为龙须菜Gl-s, Gl-g为绿色龙须菜, Gh为异枝龙须菜, Gt为细基江蓠繁枝变种
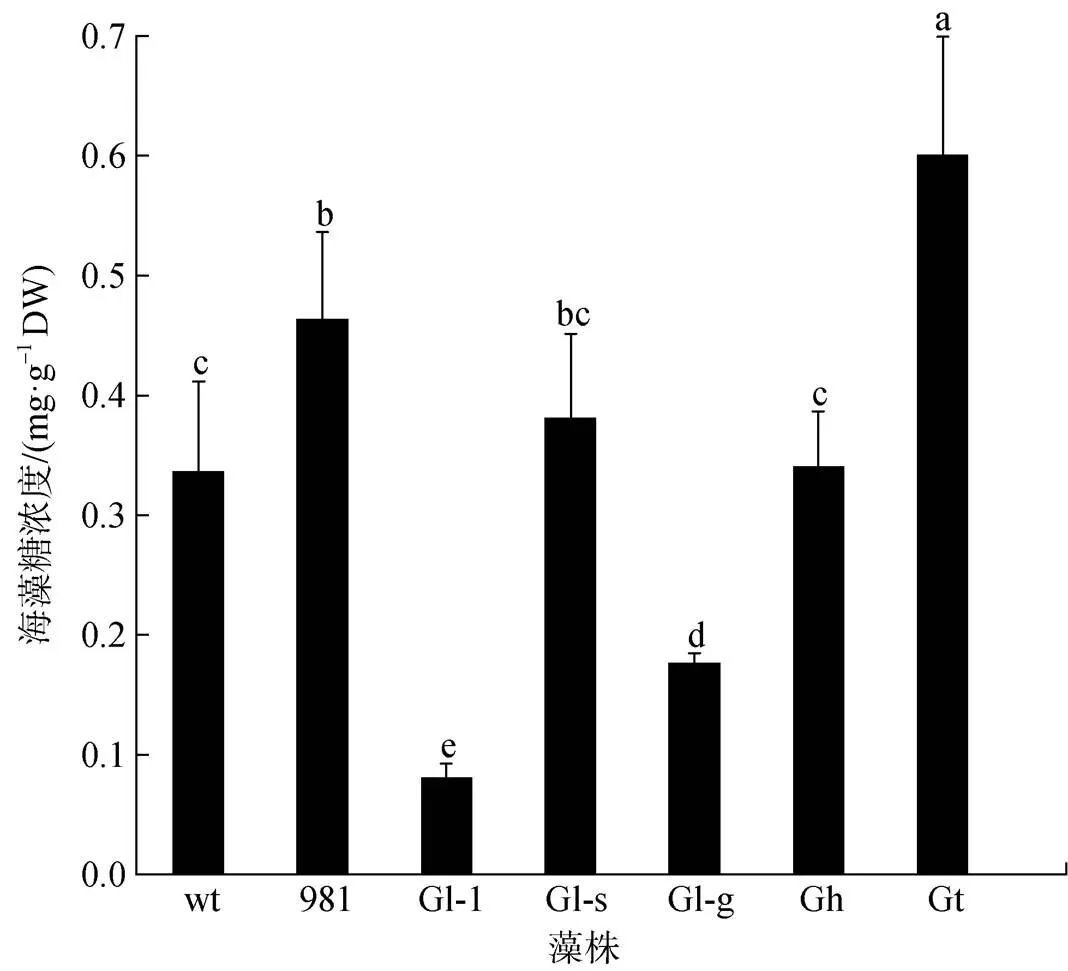
图6 龙须菜/江蓠中海藻糖浓度
注: 不同小写字母表示不同藻之间差异显著(<0.05), DW为干质量, wt为野生型龙须菜, 981为龙须菜981, Gl-1为龙须菜Gl-1, Gl-s为龙须菜Gl-s, Gl-g为绿色龙须菜, Gh为异枝龙须菜, Gt为细基江蓠繁枝变种
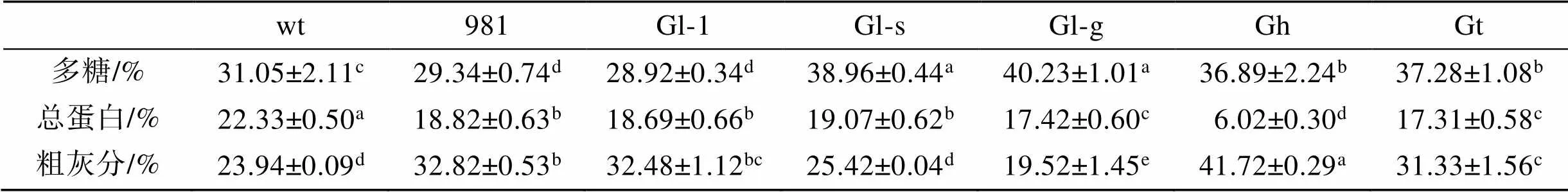
表3 龙须菜/江蓠的营养成分分析
注: 不同小写字母表示各营养成分在不同藻中差异显著(<0.05), wt为野生型龙须菜, 981为龙须菜981, Gl-1为龙须菜Gl-1, Gl-s为龙须菜Gl-s, Gl-g为绿色龙须菜, Gh为异枝龙须菜, Gt为细基江蓠繁枝变种
wt总蛋白占比最高(约为22.33%), Gh总蛋白占比最低(6.02%), 其余几种藻总蛋白占比在17.31%~ 19.07%, 均低于wt(<0.05)。
Gh中灰分最高, 为41.72%; 其次为981、Gl-1和Gt, 其灰分占比在31.33%~32.82%。Gl-s灰分与wt (23.94%)相当, 而Gl-g灰分最低(19.52%)。
2.7 龙须菜/江蓠的氨基酸组成及评分
本研究共检测了龙须菜/江蓠中16种水解氨基酸(表4)。在7种材料中, 981的总氨基酸(TAA)最高(161.32 mg·g–1DW), Gl-1的必需氨基酸(EAA)最高(63.87 mg·g–1DW), Gh的TAA和EAA均最低, 分别是58.08 mg·g–1DW和20.49 mg·g–1DW。在所有样品中, 呈味氨基酸如Glu、Asp、Phe、Ala和Gly等丰富, 占总氨基酸的40.80%~46.25%, 其中Glu最丰富。
FAO/WHO在1973年推荐的理想蛋白质模式中, 质量较好的蛋白质中EAA/TAA应在0.40左右, EAA/ NEAA(非必需氨基酸)应在0.60以上。在表4中, 实验检测的几个龙须菜/江蓠海藻中的EAA/TAA在0.34~0.40之间, 其中Gl-1和Gl-s的EAA/TAA较为接近理想模式(均在0.40)。7种海藻材料中EAA/ NEAA在0.53~0.67之间, 其中981、Gl-1、Gl-s均高于理想模式的0.60。
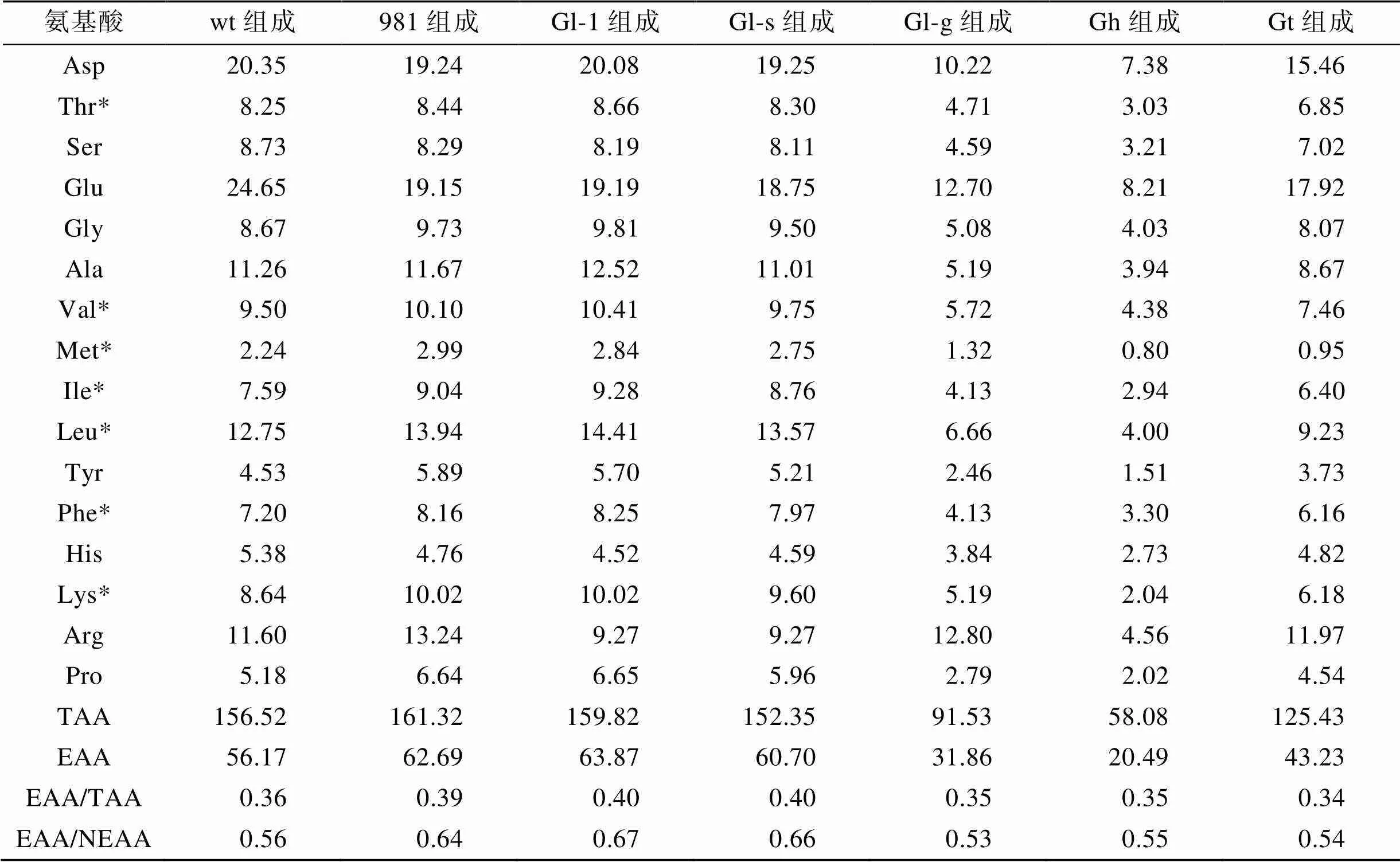
表4 龙须菜/江蓠的氨基酸组成分析(单位: mg·g–1 DW)
注: *表示必需氨基酸, wt为野生型龙须菜, 981为龙须菜981, Gl-1为龙须菜Gl-1, Gl-s为龙须菜Gl-s, Gl-g为绿色龙须菜, Gh为异枝龙须菜, Gt为细基江蓠繁枝变种
FAO在关于人体摄入必需氨基酸的推荐标准中指出, 食物中的氨基酸评分越接近100, 则其越接近人体需要, 其营养价值越高。981、Gl-1、Gl-s以及Gh的氨基酸评分更接近FAO的标准模式(表5), Gl-g整体必需氨基酸的氨基酸评分均较低。由表5中还可以看出, 所有海藻中含硫氨基酸均为第一受限氨基酸。
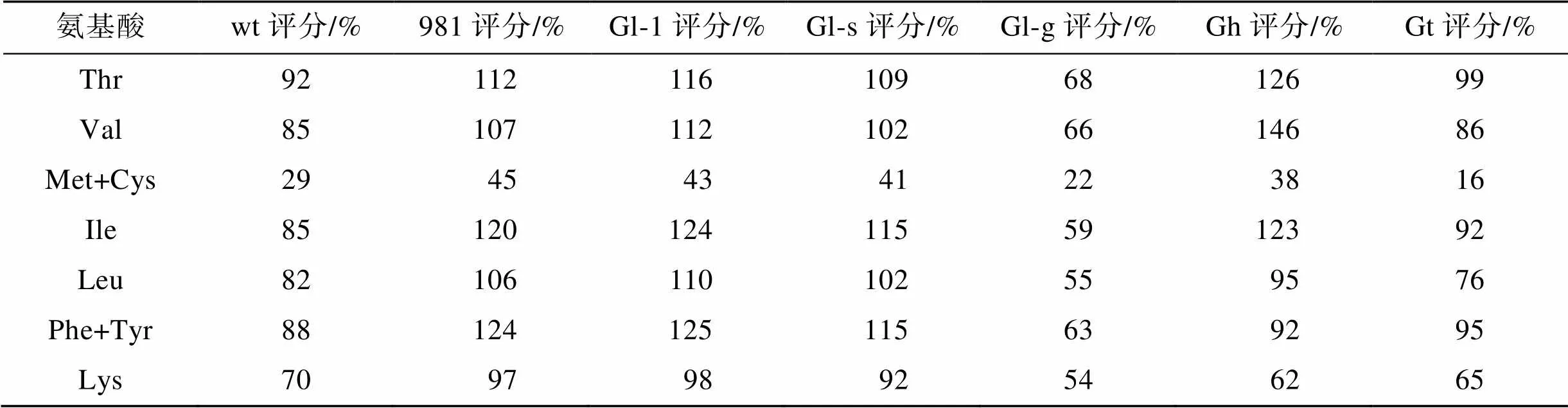
表5 龙须菜/江蓠的氨基酸评分
注: wt为野生型龙须菜, 981为龙须菜981, Gl-1为龙须菜Gl-1, Gl-s为龙须菜Gl-s, Gl-g为绿色龙须菜, Gh为异枝龙须菜, Gt为细基江蓠繁枝变种
3 讨论
3.1 龙须菜/江蓠生长和藻胆蛋白的比较
温度是影响藻类生长的一个重要参数。野生型龙须菜的最适生长温度是10~23 ℃, 981的最适温度是12~26 ℃。Liu等[9]研究显示龙须菜981在3种温度15 ℃、23 ℃和31 ℃培养时, 在23 ℃时生长最快。Lee等[16]报道不同季节下细基江蓠繁枝变种在14~ 32 ℃及12~37 ℃的温度变化下, 均在24 ℃生长最快。而本文中细基江蓠繁枝变种在23 ℃和30 ℃时的生长速率均较高且二者无显著差异。本研究中同为高温藻的异枝龙须菜与Gt不同, 其在30 ℃时的生长速率约为23 ℃时的2.12倍。
本研究中7种材料对不同温度响应不同。981在23 ℃和30 ℃时的生长速率无显著差异, 这可能与其耐受温度范围较广, 以及所用实验条件如光照强度和培养时间等有关。981生长随光照强度增加而加快, 如当光照从20 μmol·m–2·s–1升高到50 μmol·m–2·s–1时, 其GR由1.65%增加到5.34%, 而野生型龙须菜在此光照强度范围内GR则相对恒定,GR在1.99%~ 1.78%(数据未在文中呈现)。龙须菜981的生长随着光强增加而增加的结果, 与林贞贤等[17]研究相似。wt在23 ℃和30 ℃下的生长速率差异也不显著, 但在培养后期30 ℃培养藻体发白比例增加, 说明高温不利于野生型龙须菜生长。龙须菜Gl-1、Gl-s和异枝龙须菜均在30 ℃时的生长要快于23 ℃, 表明这3种龙须菜对高温具有一定耐受性, 可以作为选育耐高温藻种的候选材料。
藻胆蛋白是红藻、蓝藻和隐藻的主要捕光色素复合体, 该蛋白不仅可以作为天然色素用作食品、化妆品和药物, 还可以用作医学诊断、免疫学和细胞学研究的荧光探针等。藻胆蛋白中PE、PC及APC的相对浓度与其藻体颜色相关, 如本研究中红褐色龙须菜均表现为高比例的PE, 而Gl-g、Gh和Gt这3种藻体颜色偏绿, 其PE占总藻胆蛋白的比例较低, 但APC比例相对较高。野生型龙须菜的PE浓度是细基江蓠的2.8倍, 但是其PC低于细基江蓠[18]。本研究所用细基江蓠繁枝变种中的PE、PC与细基江蓠类似, 即其PE低于wt, 而其PC高于wt。
3.2 龙须菜/江蓠碳水化合物分析
琼胶是一种亲水性胶体, 由b-D-半乳糖和3, 6-内醚-a-L-半乳糖交联而成。琼胶在食品、医药和生物工程等方面应用广泛, 其提取原料主要来自龙须菜/江蓠、石花菜等红藻。由于石花菜目前无法人工栽培, 生物量较少, 因此龙须菜是琼胶的主要来源。琼胶产量受多种因素如氮磷浓度、光照强度、盐度等的影响。氮浓度升高, 龙须菜琼胶产率降低; 磷浓度升高, 琼胶积累增加[19]。在盐度胁迫或缺乏光照的条件下, 琼胶产量增加[20]。不同品系龙须菜中琼胶也存在差异, 如07-1、07-2和981中琼胶产率分别为19.8%、20.6%和18.0%[9]。本研究中981的琼胶产率为18.1%, 与以上结果一致。在本研究所用的7种材料中, wt、981、Gl-s和Gl-g等6种材料中琼胶产率无显著差别, 且均高于Gt。
红藻糖苷及其异构体-异红藻糖苷是红藻中重要的碳水化合物和光合同化产物, 同时也参与渗透压调节等生理过程。红藻中琼胶和红藻糖苷均由UDP-D-半乳糖聚合而成, UDP-D-半乳糖的分配对琼胶和红藻糖苷影响较大。同时, 季节、温度、盐度等因素均可以影响红藻糖苷的积累[21-22]。坛紫菜中的异红藻糖苷含量显著高于红藻糖苷, 但在不同生长阶段红藻糖苷含量的变化幅度均高于异红藻糖苷[23]。与坛紫菜不同, 本研究中除Gl-1中红藻糖苷和异红藻糖苷差别不大之外, 其余龙须菜/江蓠中均是红藻糖苷占绝对优势, 尤其是Gt和Gh。
海藻糖是一种在细菌、真菌、动植物等生物中普遍存在的非还原性二糖。除了用于碳的存储和运输, 海藻糖在干旱、盐度胁迫以及低温等不利环境条件下均能大量积累[24-25]。不同红藻中海藻糖差别很大, 如Karsten等[26]利用核磁共振、高效液相色谱和气相色谱方法检测了近60种红藻中的海藻糖, 结果只在仙菜科(Ceramiaceae)和红叶藻科(Delesseriaceae)等15种红藻中检测到, 而在其他大部分红藻中则均没有检测到海藻糖。本文中龙须菜中海藻糖较为丰富, 远远高于坛紫菜。7种材料中海藻糖浓度差别很大, 其差异可能预示着藻体对环境胁迫的适应能力不同。
3.3 龙须菜/江蓠营养成分评价
不同海域生长的龙须菜/江蓠营养成分不同。如潮汕沿海龙须菜中多糖、蛋白和灰分分别为31.05%、19.14%、28.77%; 而东海沿岸龙须菜多糖、蛋白和灰分分别为50.2%、18.9%、20.8%[27]。本研究结果显示龙须菜/江蓠蛋白质和多糖浓度较高, 5种龙须菜多糖在28.92%~40.23%, 接近潮汕龙须菜。细基江蓠及其繁枝变种的多糖在41.61%~47.05%, 蛋白在11.94%~21.67%、灰分在30.60%~37.66%, 其中湛江的细基江蓠繁枝变种的蛋白质要显著高于广西沿海的该藻[28]。本研究中Gt来自广东湛江, 多糖为37.28%, 总蛋白为17.31%, 与上述研究相比, 多糖略低, 总蛋白与其相当。
研究发现有些红藻的总氨基酸与其相应的总蛋白浓度相当[29]。本研究中龙须菜和江蓠的氨基酸也与相应的总蛋白变化一致, 表明这些藻中非蛋白氮很少。不同江蓠/龙须菜氨基酸存在较大的差异, 如两种江蓠和的TAA分别为76 mg·g–1DW和91 mg·g–1DW, 其中Ala最多[30]。而张氏江蓠()中TAA为91.90 mg·g–1DW, 且EAA/TAA超过50%[31]。本研究中除Gl-g之外, 其余4种龙须菜材料TAA在152.35~161.32 mg·g–1DW, 远高于上述3种江蓠。本研究中龙须菜的限制性氨基酸为Met, EAA/NEAA接近0.6, 氨基酸比例平衡。因此, 龙须菜可作为良好的食物和动物饲料蛋白质和氨基酸的来源。
3.4 7种龙须菜/江蓠材料的综合比较
本文所用7种龙须菜/江蓠材料表现出特异的理化和种质特性。野生型龙须菜中琼胶产率和粗蛋白较高, 但在自然海区条件及高温条件下生长较慢。981是龙须菜生产中的常用栽培品系, 其琼胶产率、藻胆蛋白、总蛋白和总氨基酸较高, 氨基酸组成均衡, 仍然是目前较为适合大规模栽培的龙须菜品系。Gl-1的红藻糖苷/异红藻糖苷及海藻糖均显著低于其他藻, 但其生长较快, 藻胆蛋白较多, EAA最高。Gl-s除生长速率相对较低之外, 其余指标均处于较高的水平, 如藻胆蛋白、琼胶和TAA等, 可用于琼胶、藻胆蛋白或多糖提取及鲍的养殖。Gl-g中琼胶产率、红藻糖苷/异红藻糖苷和多糖均较高, 但是其生长速度、藻胆蛋白和氨基酸评分很低。异枝龙须菜中的琼胶和红藻糖苷较高, 但是生长较慢、粗蛋白和氨基酸较低, 不宜用来提取琼胶。细基江蓠繁枝变种生长快, 同时红藻糖苷/异红藻糖苷和海藻糖丰富, 营养成分较高, 氨基酸比例均衡, 适宜在南方海域栽培来用作鲍的饵料或食用。
4 结论
中国龙须菜/江蓠种质资源丰富, 在医药、食品和水产养殖等领域具有重要的开发利用价值。由于生长速率、粗蛋白或营养成分组成等原因, 龙须菜wt、Gl-g和异枝龙须菜大规模栽培的意义不大。龙须菜981、Gl-1和Gl-s在藻胆蛋白、琼胶、TAA等方面均显著优于其他藻, 适于大规模栽培用于活性物质提取或鲍的养殖。细基江蓠繁枝变种在高温下生长快, 营养成分较高, 但琼胶产率低, 适宜用作鲍的饵料或食用。今后可以从这4种藻出发, 来选育综合性能更优良的龙须菜/江蓠藻栽培品系。
[1] BIRD C J, RAGAN M A, CRITCHLEY A T, et al. Molecular relationships among the Gracilariaceae (Rhodophyta): further observations on some undetermined species[J]. British Phycological Bulletin, 1994, 29(3): 195-202.
[2] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 《2020年中国渔业统计年鉴》[M].北京: 中国农业出版社, 2020.
[3] WERNER J P F, MISHRA K, HUANG Y, et al. Structure-based mutagenesis of phycobiliprotein smURFP for optoacoustic imaging[J]. ACS Chemical Biology, 2019, 14(9): 1896-1903.
[4] KANG Y N, WANG Z J, XIE D S, et al. Characterization and antitumor activity of polysaccharide from[J]. Marine Drugs, 2017, 15(4): 100.
[5] WANG X M, ZHANG Z S, ZHOU H C, et al. The anti- aging effects ofpolysaccharide in[J]. International Journal of Biological Macromolecules, 2019, 140(1): 600-604.
[6] XU X Q, SU B M, XIE J S, et al. Preparation of bioactive neoagaro-oligosaccharides through hydrolysis ofagar: A comparative study[J]. Food Chemistry, 2018, 240(3): 330-337.
[7] 陈伟洲, 徐涤, 王亮根, 等. 两个龙须菜新品系经济性状及琼胶特性的初步研究[J]. 中国海洋大学学报: 自然科学版, 2009, 39(3): 437-442.
CHEN Weizhou, XU Di, WANG Lianggen, et al. Preliminary study on economic characteristics and agar characteristics of two new strains of[J]. Periodical of Ocean University of China, 2009, 39(3): 437-442.
[8] ZOU D H, GAO K S. Thermal acclimation of respiration and photosynthesis in the marine macroalga(Gracilariales, Rhodophyta)[J]. Journal of Phycology, 2013, 49(1): 61-68.
[9] LIU C X, ZOU D H, YANG Y F, et al. Temperature responses of pigment contents, chlorophyll fluorescence characteristics, and antioxidant defenses in(Gracilariales, Rhodophyta) under different CO2levels[J]. Journal of Applied Phycology, 2016, 29(2): 1-9.
[10] ZHOU Y, YANG H S, HU H Y, et al. Bioremediation potential of the macroalga(Rhodophyta) integrated into fed fish culture in coastal waters of north China[J]. Aquaculture, 2006, 252(2): 264-276.
[11] JI Z W, ZOU D H, GONG J Y, et al. The different responses of growth and photosynthesis to NH4+enrichments betweenand its epiphytic algagrown at elevated atmospheric CO2[J]. Marine Pollution Bulletin, 2019, 144(7): 173-180.
[12] 朱招波, 孙雪, 徐年军, 等. 水杨酸对龙须菜抗高温生理的影响[J]. 水产学报, 2012, 36(8): 1304-1312.
ZHU Zhaobo, SUN Xue, XU Nianjun, et al. Effects of salicylic acid on the resistance ofto high temperature[J]. Journal of Fisheries of China, 2012, 36(8): 1304-1312.
[13] 汤小彬, 徐年军, 孙雪, 等. 24-表油菜素内酯对海洋红藻龙须菜琼胶合成及其相关基因表达的影响[J]. 水产学报, 2015, 39(12): 39-49.
TANG Xiaobin, XU Nianjun, SUN Xue, et al. Effects of 24-epibrassinolide on the agar synthesis and expression of genes involved in marine alga[J]. Journal of Fisheries of China, 2015, 39(12): 39-49.
[14] LV Y, SUN P, ZHANG Y Y, et al. Response of trehalose, its degrading enzyme, sucrose, and floridoside/isofloridoside under abiotic stresses in(Rhodophyta)[J]. Journal of Applied Phycology, 2019, 31(6): 3861-3869.
[15] 中国国家标准化管理委员会. 食品中灰分的测定方法: GB 5009.4—1985[S]. 北京: 中国标准出版社, 1985.
Standardization Administration of China. GB 5009.4—1985, Method for determination of ash in foods[S]. Beijing: Standards Press of China, 1985.
[16] LEE T M, CHANG Y C, LIN Y H. Differences in physiological responses between winter and summer(Gigartinales, Rhodophyta) to varying temperature[J]. Botanical Bulletin Academia Sinica Taipei, 1999, 40(1): 93-100.
[17] 林贞贤, 宫相忠, 李大鹏. 光照和营养盐胁迫对龙须菜生长及生化组成的影响[J]. 海洋科学, 2007, 31(11): 22-26.
LIN Zhenxian, GONG Xiangzhong, LI Dapeng. Effects of light and the stress of nutrients deficiency on the growth and levels of chemical constituents of[J]. Marine Sciences, 2007, 31(11): 22-26.
[18] 张学成, 张锦东, 隋正红, 等. 江蓠属藻胆蛋白的研究─Ⅰ诱变、突变体筛选及藻胆蛋白的光谱特性[J]. 中国海洋大学学报(自然科学版), 1996, 26(3): 318-326.
ZHANG Xuecheng, ZHANG Jindong, SUI Zhenghong, et al. Studies on phycobiliproteins fromⅠ. mutagenesis, mutation selection and characterization of absorption spectra and fluorescent emission spectra[J]. Periodical of Ocean University of China, 1996, 26(3): 318-326.
[19] LIU X J, WEN J Y, CHEN W Z, et al. Physiological effects of nitrogen deficiency and recovery on the macroalga(Rhodophyta)[J]. Journal of Phycology, 2019, 55(4): 830-839.
[20] LEE W K, LIM Y Y, LEOW T C, et al. Biosynthesis of agar in red seaweeds: A review[J]. Carbohydrate Polymers, 2017, 164(5): 23-30.
[21] MARTINEZ-GARCIA M, MAAREL M. Floridoside production by the red microalgaunder different conditions of growth and osmotic stress[J]. AMB Express, 2016, 6(1): 71-78.
[22] OCHSENKÜHN M A, RÖTHIG T, D'ANGELO C, et al. The role of floridoside in osmoadaptation of coralassociated algal endosymbionts to high-salinity conditions[J]. Science Advances, 2017, 3(8): e1602047-e1602055.
[23] 赵佳丽, 杨怡, 赵倩等. 高温胁迫下坛紫菜中红藻糖苷及其异构体的含量变化[J]. 核农学报, 2019, 33(1): 103-111.
ZHAO Jiali, YANG Yi, ZHAO Qian, et al. Different Variations of floridoside and isofloridoside inunder heat resistance[J]. Journal of Nuclear Agricultural Sciences, 2019, 33(1): 103-111.
[24] REDILLAS M C F R, PARK S H, LEE J W, et al. Accumulation of trehalose increases soluble sugar contents in rice plants conferring tolerance to drought and salt stress[J]. Plant Biotechnology Reports, 2012, 6(1): 89-96.
[25] GUO X Y, LIU D F, CHONG K. Cold signaling in plants: Insights into mechanisms and regulation[J]. Journal of Integrative Plant Biology, 2018, 60(9): 745- 756.
[26] KARSTEN U, GÖRS S, EGGERT A, et al. Trehalose, digeneaside, and floridoside in the Florideophyceae (Rhodophyta) a reevaluation of its chemotaxonomic value[J]. Phycologia, 2007, 46(2): 143-150.
[27] 周峙苗, 何清, 马晓宇. 东海红藻龙须菜的营养成分分析及评价[J]. 食品科学, 2010, 31(9): 284-287.
ZHOU Zhimiao, HE Qing, MA Xiaoyu. Evaluation of nutritional components in[J]. Food Science, 2010, 31(9): 284-287.
[28] 周岐存, 叶富良, 刘东超, 等. 细基江蓠繁枝变种和细基江蓠营养成分的比较研究[J]. 海洋科学, 2001, 25(4): 11-13.
ZHOU Qicun, YE Fuliang, LIU Dongchao, et al. Comparative studies on nutritional compositions ofvarand[J]. Marine Sciences, 2001, 25(4): 11-13.
[29] WONG K H, CHEUNG P C K. Nutritional evaluation of some subtropical red and green seaweeds: part I-proximate composition, amino acid profiles and some physico-chemical properties[J]. Food Chemistry, 2000, 71(4): 475-482.
[30] GRESSLER V, YOKOVA N S, FUJII M T, et al. Lipid, fatty acid, protein, amino acid and ash contents in four Brazilian red algae species. Food Chemistry, 2010, 120(2): 585-590.
[31] CHAN P T, MATANJUN P. Chemical composition and physicochemical properties of tropical red seaweed,[J]. Food Chemistry, 2017, 221(8): 302-310.
Analysis of the growth and germplasm properties of the/seaweeds
XUAN Wen-yan, ZHANG Ying-ying, CHEN Qiong-lin, LUO Su-ya, SUN Xue, XU Nian-jun
(School of Marine Sciences, Ningbo University, Key Laboratory of Marine Biotechnology of Zhejiang Province, Ningbo 315211, China)
is a commercially important seaweed with ecological benefits and is mainly used to extract agar and as abalone bait. In this study, the growth rate, contents of phycobiliprotein, agar, floridoside, and amino acid composition of(wt, 981, Gl-1, Gl-s, Gl-g),(Gh), andvar.(Gt)were compared using physiochemical measurements, high-performance liquid chromatography-mass spectrometry, and amino acid analyses. The aim was to provide a reference for differentiating and selecting the germplasm to cultureseaweeds. The results showed that Gt had the fastest relative growth rate at 23 ℃ and 30 ℃, with 1.19- and 1.49-fold increases compared to that of the wild-type.(wt), respectively. Among the 7 kinds of seaweeds, the phycobiliprotein content in Gl-s was the highest, which was 1.91 times that of wt. Six kinds of seaweeds contained the highest agar yields (16.22%–18.91%) except Gt. The floridoside and trehalose contents in Gt were rich and were 2.50- and 0.81-fold higher than that of wt, respectively. The polysaccharide contents of Gl-g, Gl-s, Gt and Gh were relatively high, ranging from 36.89% to 40.23%. The total amino acid content of 981, Gl-1, and Gl-s was 152.35–161.32 mg·g–1DW, which was higher than the others. The amino acid scores of 981, Gl-1, and Gl-s were superior to the others. Based on these results,981, Gl-1, and Gl-s showed excellent performance, such as growth rate, amount of agar extracted, phycobiliprotein, and TAA, and could be cultivated to extract agar, phycobiliprotein, polysaccharides, or as abalone bait.var.grew rapidly and was rich in trehalose and floridoside, so it could be extensively cultivated to feed abalone. This study provides an important reference for enriching the germplasm resources and utilizing seaweeds in China.
;; growth; germplasm; agar
Jan. 19, 2021
S917.3
A
1000-3096(2022)12-0148-11
10.11759/hykx20210119001
2021-01-19;
2021-03-03
国家重点研发计划(2018YFD0901502), 宁波市重大科技专项项目(2019B10009), 宁波市重大科技攻关项目(2021Z114)
[National Key R & D Program of China, No. 2018YFD0901502; Key Program of Science and Technology Innovation in Ningbo, No. 2019B10009; Major Project of Science and Technology in Ningbo, No. 2021Z114]
宣雯燕(1994—), 女, 汉族, 浙江湖州人, 硕士, 研究方向为藻类生理生化, E-mail: 541374174@qq.com; 孙雪(1974—),通信作者, 女, 博士, 研究员, 研究方向为藻类生理与分子生物学, E-mail: sunxue@nbu.edu.cn
(本文编辑: 杨 悦)
