大钦岛不同养殖年限深水网箱沉积物微生物群落结构分析
2022-03-01解维俊赵玉庭刘元进胡顺鑫姜海滨韩慧宗王腾腾李兆龙张明亮
解维俊, 赵玉庭, 刘元进, 胡顺鑫, 姜海滨, 韩慧宗, 王腾腾, 王 斐, 李兆龙, 张明亮
大钦岛不同养殖年限深水网箱沉积物微生物群落结构分析
解维俊1, 2, 赵玉庭2, 刘元进2, 胡顺鑫2, 姜海滨2, 韩慧宗2, 王腾腾2, 王 斐2, 李兆龙1, 2, 张明亮2
(1. 上海海洋大学 水产与生命学院, 上海 201306; 2. 山东省海洋资源与环境研究院, 山东 烟台 264006)
为研究深水网箱养殖年限对沉积物微生物群落结构的影响, 分别对大钦岛海域养殖3、8、13、18 a网箱以及非养殖区(DZ)表层沉积物(0~2 cm)进行16S rDNA高通量测序。结果显示, 长年网箱养殖(13、18 a)区域沉积物菌群的丰富度和多样性均显著高于短期网箱养殖(3、8a)区域(<0.05)。随着养殖年限的增加, 网箱沉积物优势菌门变化显著(<0.05), 短期网箱养殖(3、8 a)和非养殖区(DZ)沉积物主要优势菌门为拟杆菌门(Bacteroidota), 变形菌门(Proteobacteria)、厚壁菌门(Firmicutes), 长年网箱养殖(13、18 a)沉积物主要优势菌门为拟杆菌门, 变形菌门、脱硫菌门(Desulfobacterota)。影响网箱养殖沉积物菌群结构的主导环境因子为Hg、Cd、有机碳以及石油类。冰鲜野杂鱼的投喂可能是大钦岛长年网箱养殖区环境恶化的重要因素之一, 应推广绿色环保型配合饲料的使用, 并采用微生物(以厌氧不产氧光合细菌为主的微生态制剂)、大型生物(刺参及大型藻类)相结合的协同治理手段进行污染沉积物修复, 推进深水网箱的健康养殖和可持续发展。
深水网箱; 养殖年限; 沉积物; 微生物群落
浅海网箱养殖是近海生态环境恶化的重要因素之一[1]。残饵、粪便等有机物质在海底的沉降和堆积会导致底栖环境呈缺氧或无氧状态, 从而显著改变底栖微生物群落结构[2]。随着底栖环境进一步的恶化, 硫酸盐还原菌将成为优势类群, 致使硫化物和非离子态的硫化氢大量富集, 极易产生毒害作用[3]。为了减轻网箱养殖带来的生态危害, 中国近几年大力发展深水网箱养殖[4-5], 将养殖网箱从水深10 m以内的浅海搬到水深20 m以上的深水区域。但深水网箱养殖是否有利于海洋生态环境的保护, 仍缺乏系统研究。尽管已有大量研究关注深水网箱养殖对底栖环境、微生物群落结构的影响, 如网箱养殖活动可能会增加沉积物中总氮、总磷、有机碳和硫化物的含量[6]以及提高沉积物菌群的丰富度和多样性[7], 并且对大型底栖生物的分布[8]存在明显影响, 但中国深水网箱养殖开展较晚, 缺乏对长期养殖环境效果的研究。

1 材料与方法
1.1 样品采集
根据养殖起始年份将大钦岛网箱养殖区划分为不同的采样区域3、8、13、18 a以及非养殖区(DZ)5个区域(表1), 采样网箱自投放入海以来均以许氏平鲉幼苗(6 cm左右)为养殖对象, 饵料以冰鲜野杂鱼为主, 于2021年6月进行了调查取样(图1)。使用彼得森采泥器采集样点的表层沉积物(0~2 cm), 每个采样区域选取3个网箱表层沉积物作为平行样品, 每个平行样品由5点法采集混合而成, 将样品放在无菌聚乙烯自封袋中, 置于便携式冰箱带回实验室分析。样品分为2部分, 一部分存放在5 mL冻存管中置于–80 ℃冰箱用于微生物群落结构和多样性分析, 另一部分自然风干后研磨存储于4 ℃冰箱中用于理化性质测定。
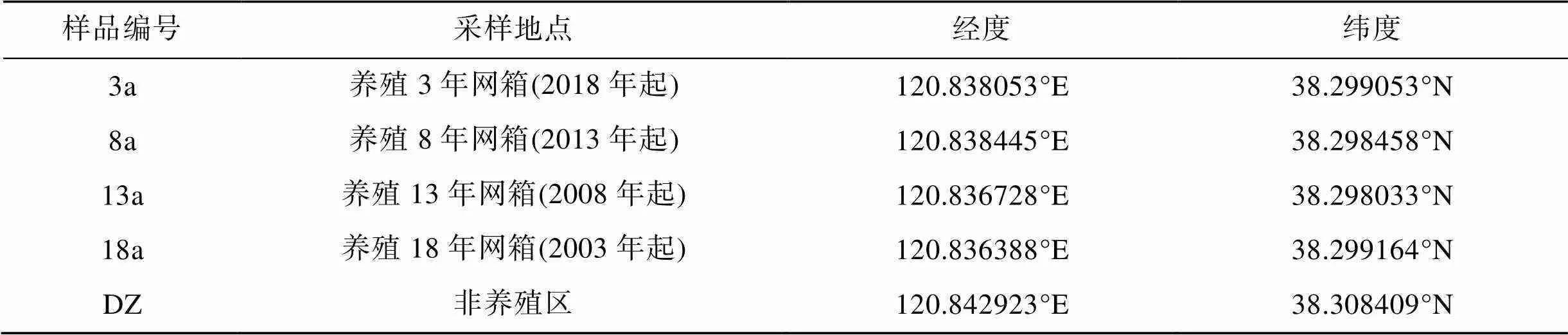
表1 大钦岛网箱养殖区各采样点详细情况
图1 大钦岛网箱养殖区各采样位点分布
1.2 沉积物理化指标分析方法
测定了硫化物、有机碳、Cu、Zn、Cr、Hg、Cd、Pb、As及石油类等指标。硫化物测定用亚甲基蓝分光光度法(GB17378.5—2007), 有机碳测定用重铬酸钾氧化-还原容量法(GB17378.5—2007), Cu、Zn、Cr、Cd、Pb及As测定用电感耦合等离子体质谱法(HY/T147.2—2013), Hg测定用电子荧光法(GB17378.5—2007), 石油类测定用紫外分光光度法(GB17378.5—2007)。
1.3 高通量测序
将装有沉积物样品的5 mL冻存管送至上海欧易生物医学科技有限公司, 进行PCR扩增和高通量测序。土壤基因组由Magen核酸提取试剂盒(MagPure Soil DNA KF Kit)提取, 利用1%琼脂糖凝胶电泳检测其纯度和完整度。针对V3-V4区域设计特异引物进行PCR扩增, 前端引物为343F-5′- TACGGRAGGCAGCAG-3′, 后端引物为798R-5′- AGGGTATCTAATCCT-3′, 将样品的PCR产物在Illumina Miseq平台上进行高通量测序。
1.4 数据分析
将测序得到的原始FASTQ文件用Trimmomatic[10]软件过滤去除质量低或模糊的碱基以及长度小于50 bp的序列, 得到的双端数据使用FLASH[11]软件进行拼接, 同时过滤去除Barcode和引物序列以及长度小于200 bp的序列, 得到clean tags序列。最后用UCHIME[12]软件去除嵌合体序列, 得到可用于后续划分OTU的有效序列Valid tags。用VSEARCH[13]软件将优质序列Valid tags以97%相似度进行OTU分类, 随后将个OTU中丰度最大的序列作为代表序列, 对比Silva (www.arb-silva.de), Greengene (http:// greengenes.secondgenome.com/)数据库并使用RDP classifier软件进行物种比对注释, 保留置信度>0.7的注释结果, 采用QIIME[14]软件对OTU进行α多样性指数分析。β多样性和差异OTUs分析使用R语言(www.r-project.org)统计软件进行分析。
用 WPS Excle 2019处理数据, Surfer绘制采样点分布地图, 并用SPSS 24.0软件进行单因素方差分析(One-Way ANOVA)和相关性分析,<0.05为差异显著。
2 结果与分析
2.1 沉积物理化性质
各区域有机碳、Cu、Zn、Cr、Hg、Cd、Pb、As和石油类含量差异均不显著(>0.05), 说明深水网箱长年养殖并未对底栖环境造成深远影响(表2)。但养殖18 a区域硫化物含量最高, 且显著高于对照区域(<0.05), 含量增长了97.44%, 表明长年养殖促进了硫化物的积累。尽管养殖18 a区域硫化物含量仍符合一级海洋沉积物评价标准(GB18668—2002), 但高浓度的硫化物将会对海洋生物产生危害, 长年养殖无疑增加了底栖环境的生态风险。除Cr外, 其余各监测指标均符合一级海洋沉积物评价标准, 但各区域Cr含量差异不显著(>0.05), 表明该区域Cr本底值较高, 深水网箱养殖并没有明显增加其含量。
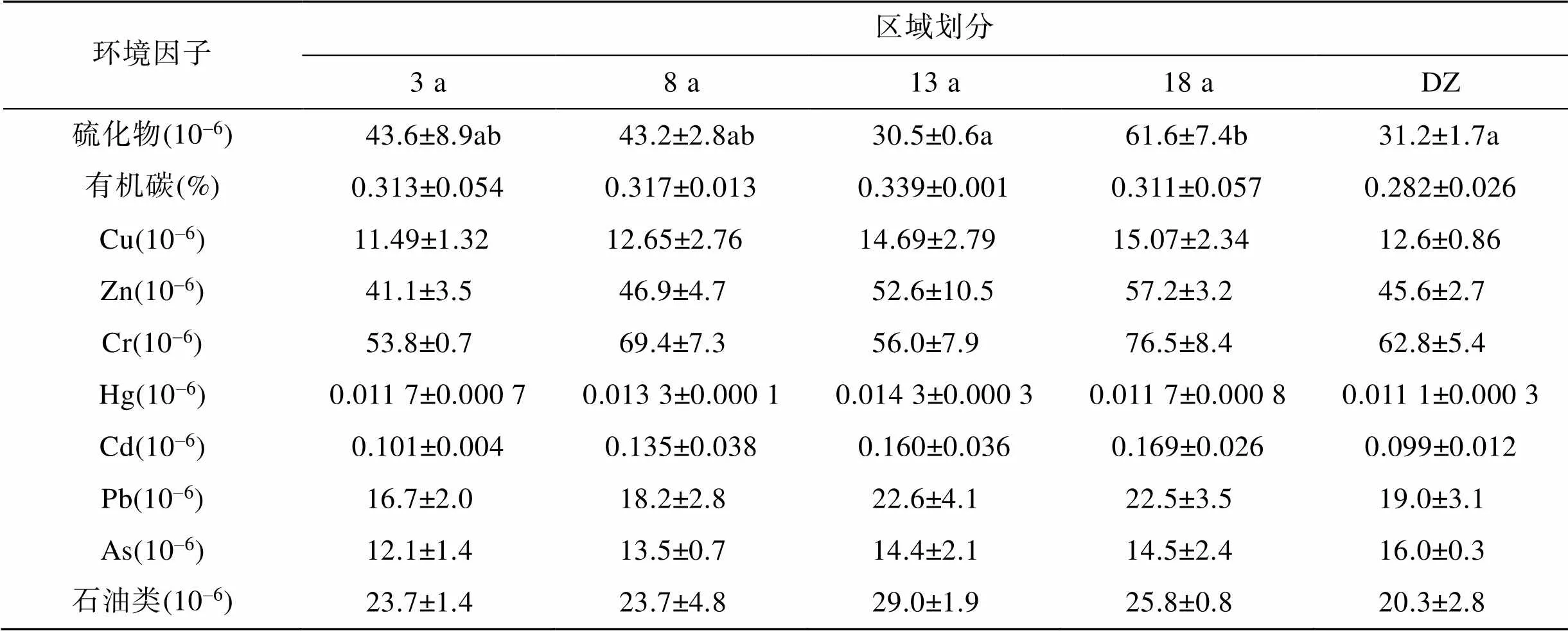
表2 养殖网箱沉积物理化因子测定结果
注: 表中同列数据后不同小写字母表示处理间差异显著(<0.05)
2.2 高通量测序结果
不同养殖年限网箱沉积物样品经高通量测序得到clean tags (拼接后的tags数目) 68 525~73 761条, 有效序列52 274~67 696条, 聚类于1 662~5 207个OTUs。样品测序覆盖率为96.52%~99.04%, 说明测序可以很好地覆盖物种信息, 抽样充分。养殖3、8、13、18 a以及非养殖区(DZ)中分别测到的OTU个数为5 954、6 079、7 385、7 659和6 119个。不同养殖年限网箱沉积物共有的OTU数目为1 807个, 约占各采样点总OTU数目的25%。5个采样区域特有的OTU数目分别为: 904个(占3 a总OTU个数的15.2%)、1 317个(占8 a总OTU个数的21.7%)、1 325个(占18 a总OTU个数的17.9%)、1 512(占18 a总OTU个数的19.7%)、1 299个(占非养殖区总OTU个数的21.2%)。该数据表明, 各养殖年限网箱沉积物特有的微生物种类较多, 微生物的组成存在差异性, 总体来说长年养殖对网箱沉积物细菌群落结构具有明显影响, 提高了沉积物微生物菌群的丰富度。
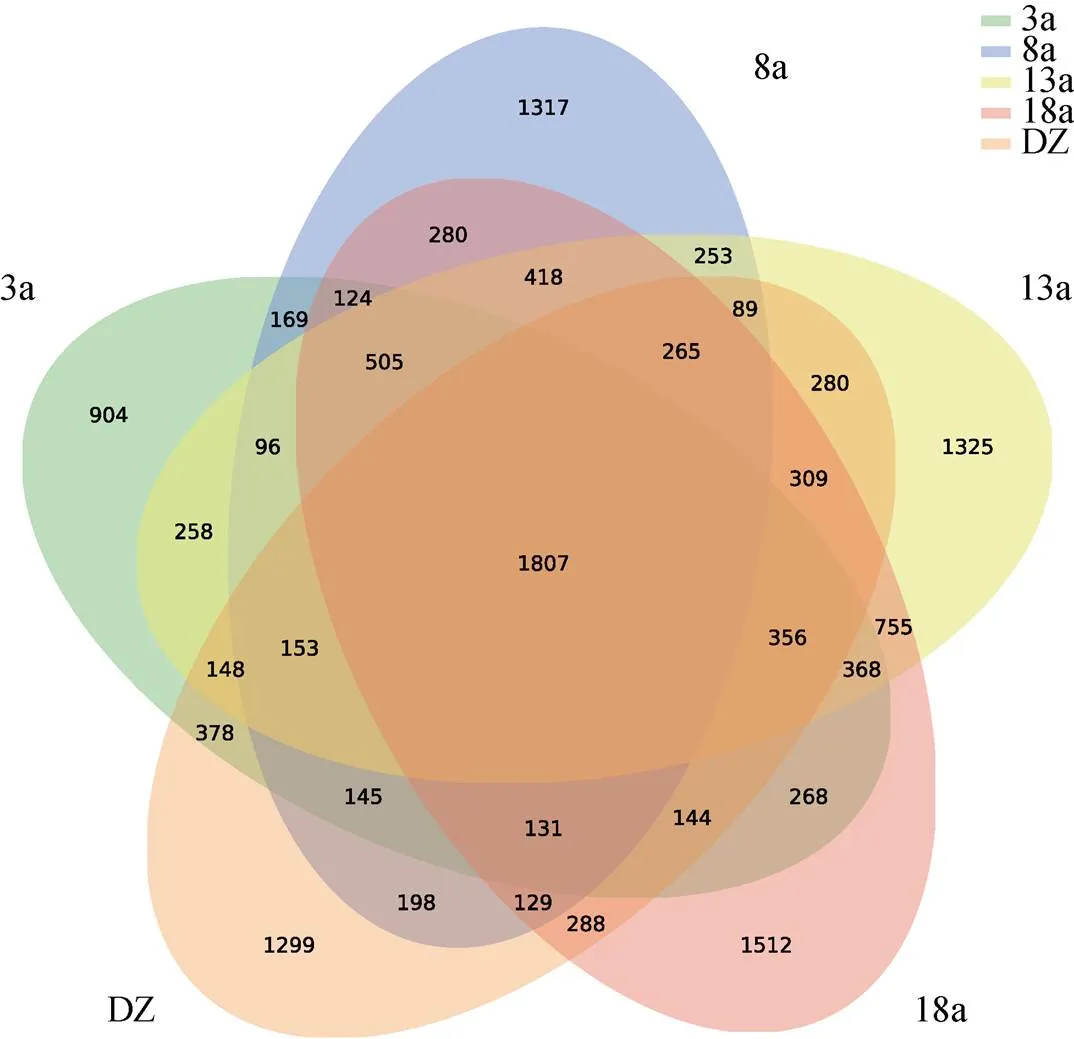
图2 不同养殖年限网箱沉积物中的微生物群落韦恩图
2.3 网箱养殖年限对沉积物微生物α多样性的影响
采用Chao1、物种丰富度Richness、Shannon、Simpson等指数对沉积物样本α多样性进行评估, 结果(表3)显示。不同养殖年限网箱沉积物菌群丰富度和多样性都具有显著性差异(<0.05), 随养殖年限的增加, 养殖网箱沉积物菌群的丰富度和多样性均呈上升趋势, 且长年养殖网箱(13、18 a)沉积物菌群丰富度和多样性显著大于其他区域(<0.05), 说明养殖年限可能是影响网箱沉积物细菌群落丰富度和多样性的重要因素之一。
2.4 网箱养殖年限对沉积物微生物群落的影响
5个区域沉积物细菌在门水平上丰度排名前10的门类分别为拟杆菌门(Bacteroidota), 变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、脱硫菌门(Desulfobacterota)弯曲杆菌门(Campilobacterota)酸杆菌门(Acidobacteriota)、黏球菌门(Myxococcota)放线菌门(Actinobacteriota)NB1-j和芽孢杆菌门(Gemmatimonadota)(图3)。不同养殖年限网箱沉积物菌群组成在门水平上具有显著差异, 养殖3、8 a以及非养殖区(DZ)的主要优势菌门为拟杆菌门, 变形菌门和厚壁菌门(总相对丰度>61.77%), 养殖13、18 a的主要优势菌门为拟杆菌门, 变形菌门和脱硫菌门(总相对丰度>61.98%)。养殖3、8 a网箱沉积物厚壁菌门相对丰度分别为28.16%、32.70%, 养殖13、18 a网箱沉积物厚壁菌门相对丰度分别为5.60%、7.26%, 长年养殖显著降低了厚壁菌门的相对丰度(<0.05)。养殖3、8 a网箱沉积物脱硫菌门相对丰度分别为9.90%、12.23%, 养殖13、18 a网箱沉积物脱硫菌门相对丰度分别为25.53%、16.80%, 长年养殖显著提升了脱硫菌门的相对丰度(<0.05)。非养殖区沉积物检测出的拟杆菌门相对丰度(37.60%)高于所有养殖区沉积物拟杆菌门相对丰度(<20.50%), 并且显著高于其在养殖8、13 a沉积物中的相对丰度(<0.05)。变形菌门的相对丰度在5个区域差异不显著(0.05), 其他菌门相对丰度较小, 不同区域差异也不显著(0.05)。
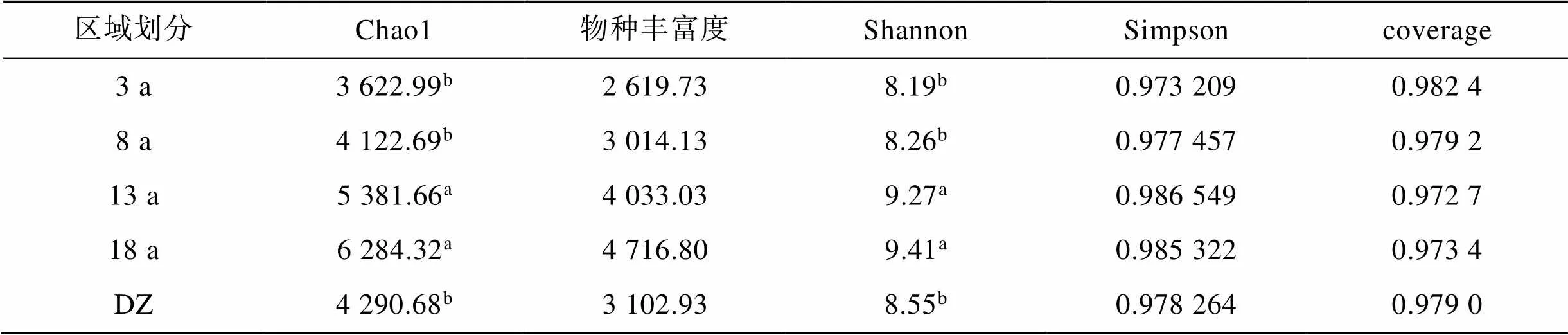
表3 各位点沉积物α多样性分析
注: 表中同列数据后不同小写字母表示处理间差异显著(<0.05)
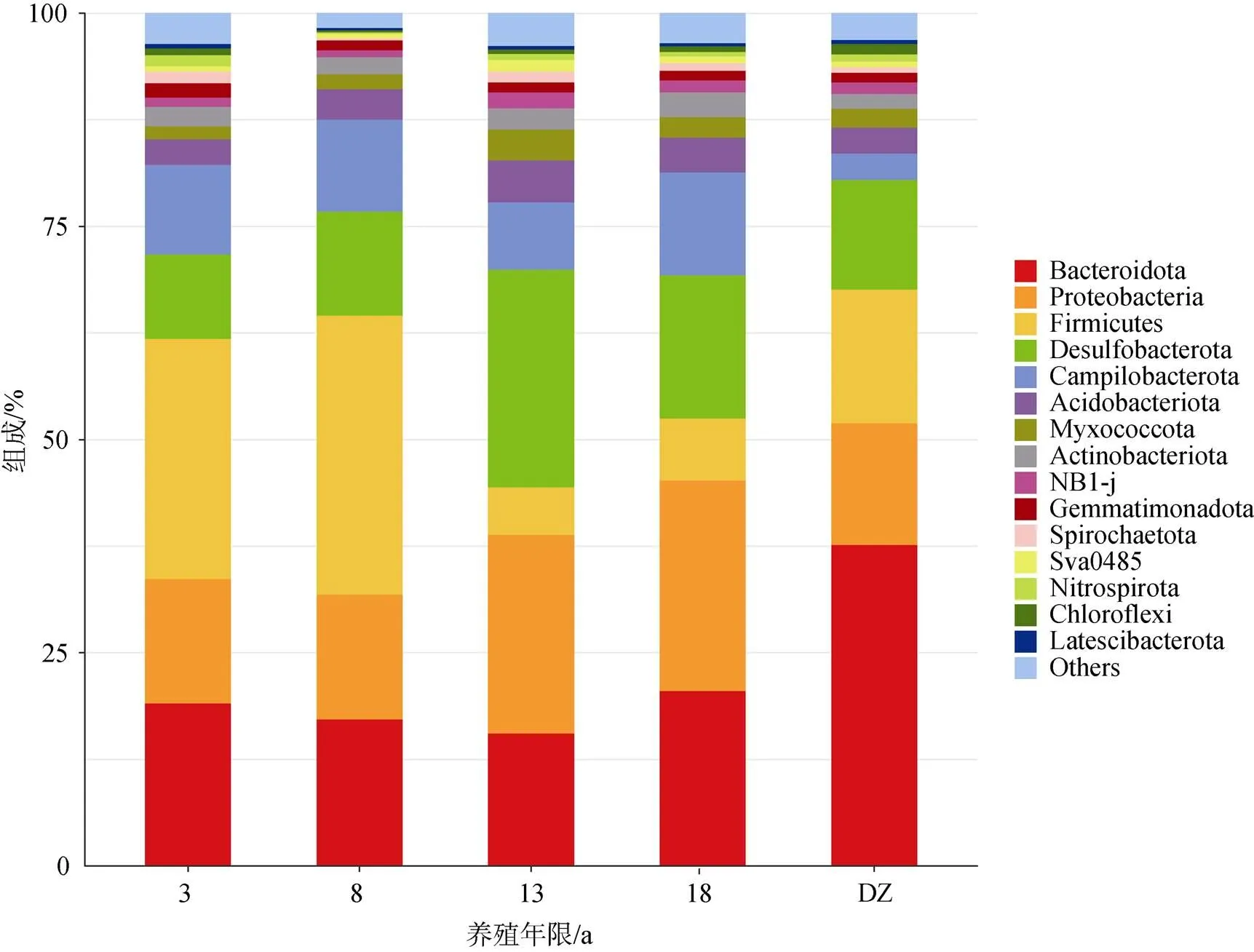
图3 沉积物微生物群落组成(门水平)
菌属水平下, 不同养殖年限网箱沉积物优势菌属(相对丰度>2%)呈现出显著性差异(<0.05)(图4)。养殖3 a网箱沉积物优势菌主要隶属于硫卵菌属(S)(10.45%)、嗜中温温暖杆菌() (5.54%)、拟杆菌属()(5.40%)、毛囊菌属()(3.84%)和(2.52%)。养殖8 a网箱沉积物优势菌主要隶属于硫卵菌属(10.71%)、(5.40%)、毛囊菌属(4.40%)和毛螺菌科()(2.74%)。养殖13 a网箱沉积物优势菌主要隶属于(9.16%)、硫卵菌属(7.63%)、(2.97%)、(2.74%)、(2.29%)、海球菌属()(2.26%)和伍斯菌属()(2.08%)。养殖18 a网箱沉积物优势菌主要隶属于硫卵菌属(11.54%)、(5.49%)、毛囊菌属(2.90%)、(2.40%)、伍斯菌属(2.27%)和拟杆菌属(2.20%)。非养殖区(DZ)沉积物优势菌主要隶属于拟杆菌属(16.13%)、毛囊菌属(11.81%)、另枝菌属()(3.68%)、毛螺菌科(3.49%)和硫卵菌属(2.93%)。5个区域沉积物优势菌属均包含硫卵菌属, 且其在4个养殖网箱区域沉积物的相对丰度均显著大于非养殖区(DZ) (<0.05)。仅是4个养殖网箱区域沉积物的优势菌属, 且其在养殖8、13、18 a网箱沉积物的相对丰度均显著大于非养殖区(DZ)(1.66%)(<0.05)。拟杆菌属、毛囊菌属是非养殖区沉积物的优势菌属且相对丰度较高, 显著高于其在养殖区域沉积物的相对丰度(<0.05)。
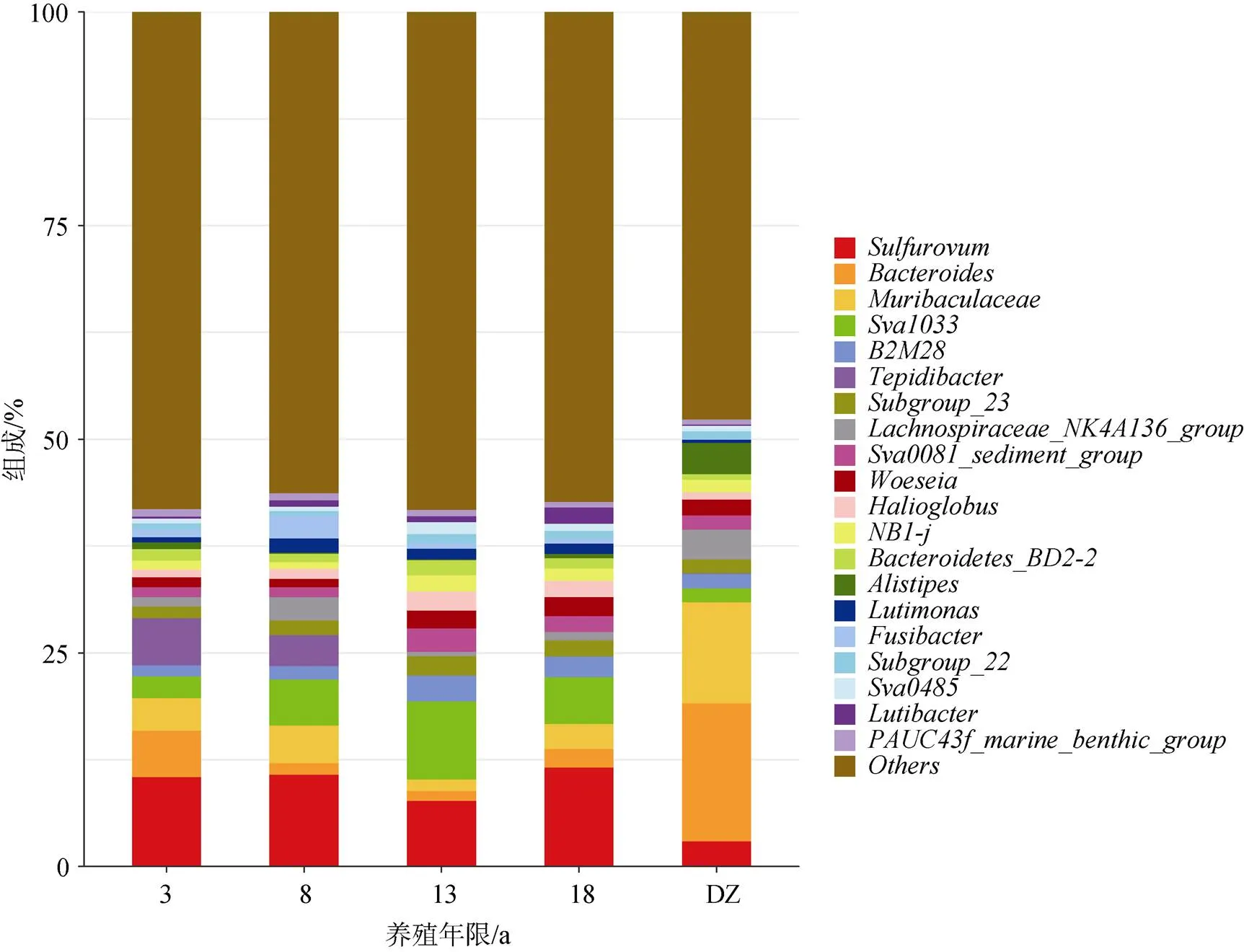
图4 沉积物微生物群落组成(属水平)
选取样品相对丰度前30的菌属进行聚类分析, 并绘制Heatmap图(图5)。在属分类水平上可以看出, 硫卵菌属随养殖年限的增加呈现先降低后上升的趋势, 与硫化物含量变化趋势一致。随养殖年限的增加, 优势菌属的数量也增加。由聚类结果可知, 养殖3、8 a可以聚为一支, 养殖13、18 a可以聚为一支, 随后4个养殖区聚为一支, 非养殖区单独为一支。同时, 采用主成分分析(PCA)对不同养殖年限网箱沉积物菌落结构差异进行分析(图6), 分析结果与聚类分析结果较为相似, 养殖3、8 a与非养殖区(DZ)在第一主成分上和养殖13、18 a被明显地区分, 说明网箱养殖年限明显影响沉积物细菌群落结构。部分区域的3个重复样品的聚集性较差, 组内细菌群落组成存在差异, 原因是同一养殖年限网箱区域面积过大, 取样时为了更好地展示其真实菌落结构情况, 取样位置跨度较大所致。
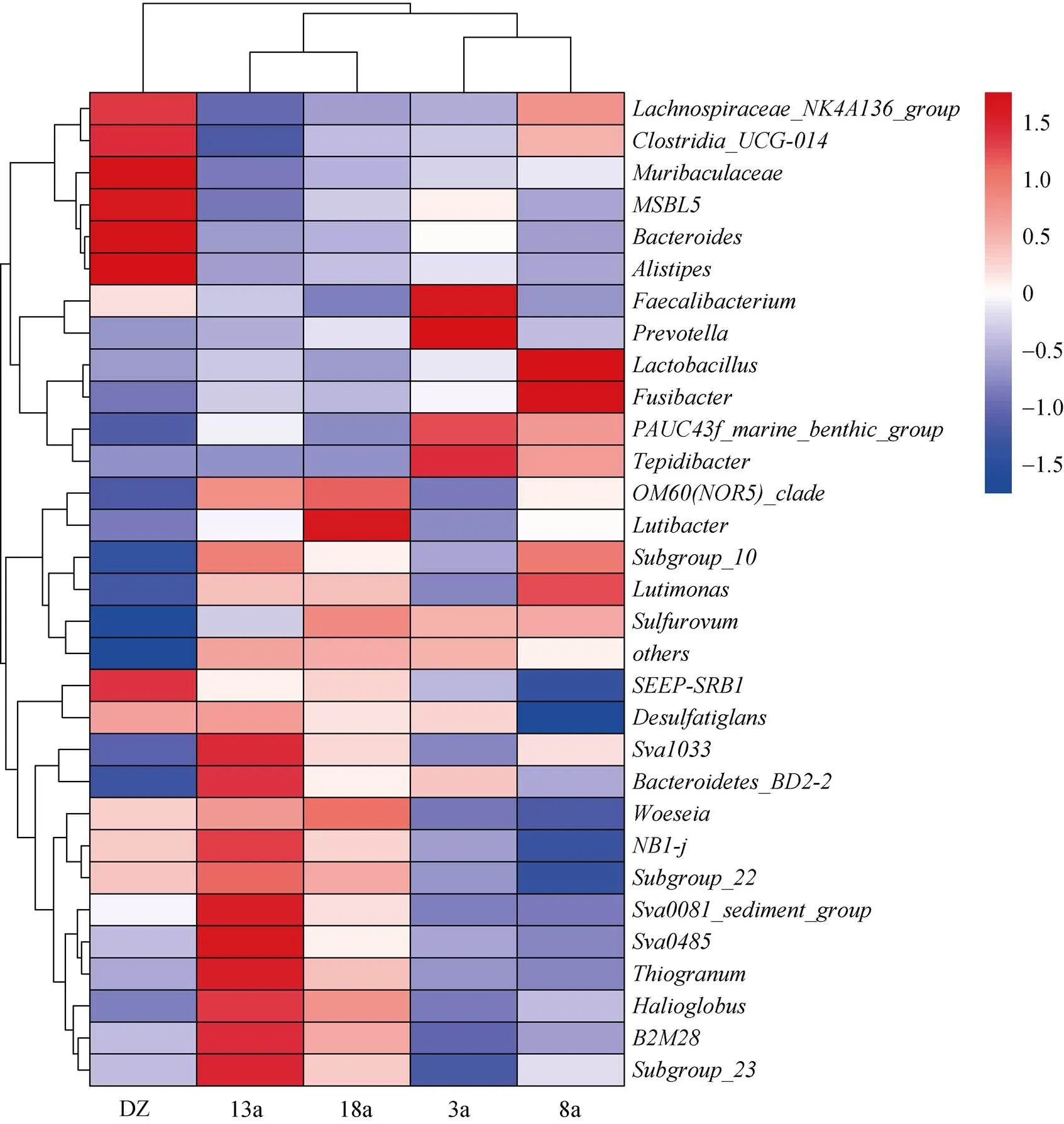
图5 沉积物微生物属水平热图
2.5 养殖网箱沉积物微生物群落与环境因子相关性
将养殖网箱沉积物样品中细菌丰度前15属与沉积物理化因子进行微生物环境因子分析(图7), 采用协方差矩阵进行计算。其中,与Hg含量呈显著正相关(=0.034,=0.670)。与Cd含量呈显著正相关(=0.049,=0.633)。另枝菌属()与有机碳含量呈显著负相关(=0.040,=–0.655), 表明另枝菌属受沉积物有机质含量影响显著。海球菌属与石油类含量呈显著正相关(=0.042,=0.650)。这表明Hg、Cd、有机碳以及石油类对不同养殖年限网箱沉积物细菌群落结构有一定的影响。本研究中大部分菌属与环境因子不具有显著相关, 这可能是因为该研究中微生物与环境因子之间的关系可能受到混杂因素的影响, 使其作用可能难以区分。
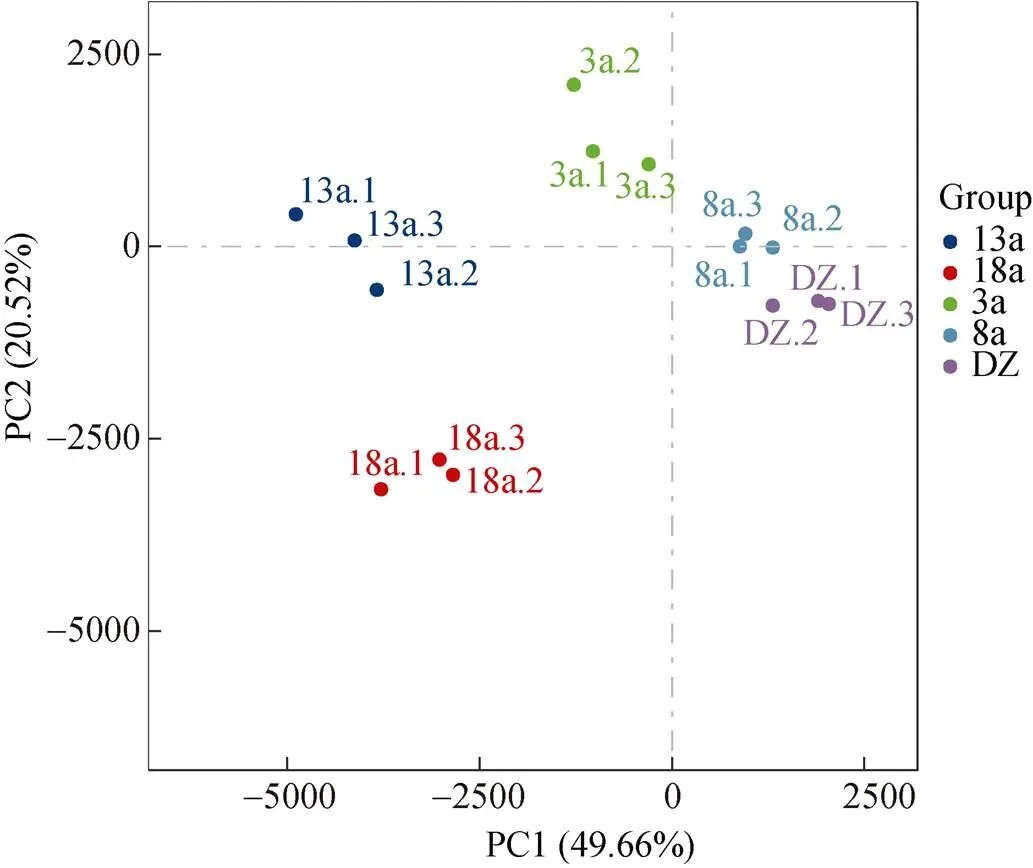
图6 沉积物微生物PCA分析
2.6 网箱养殖年限对硫酸盐还原菌群落的影响
本研究根据高通量测序的结果筛选出其中的硫酸盐还原菌(SRB), 选取样品中发现的相对丰度前10的SRB菌属分析(表4), 脱硫酸盐橡菌属()是养殖网箱沉积物中丰度最高的SRB菌属。我们在进行SRB菌属筛选时发现养殖13、18 a网箱沉积物SRB类群最多, 相对丰度最大, 如脱硫化凸菌属()在养殖13、18 a网箱沉积物出现且相对丰度较高, 但在养殖3、8 a网箱和DZ未出现。这些结果说明长年养殖网箱区(13、18 a)沉积物环境更适合严格厌氧的SRB菌属生长。
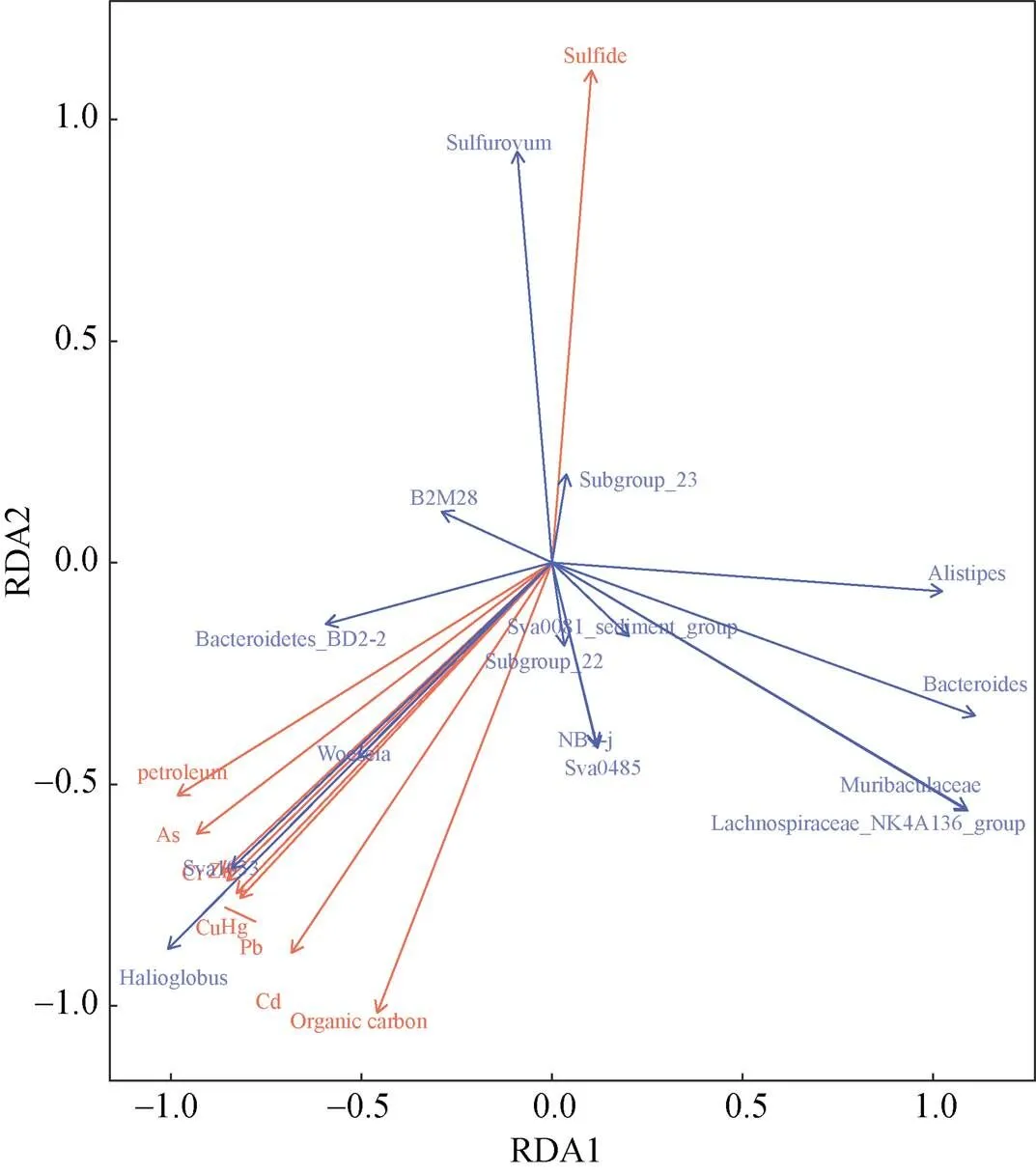
图7 沉积物微生物群落与环境因子的RDA分析(属水平)
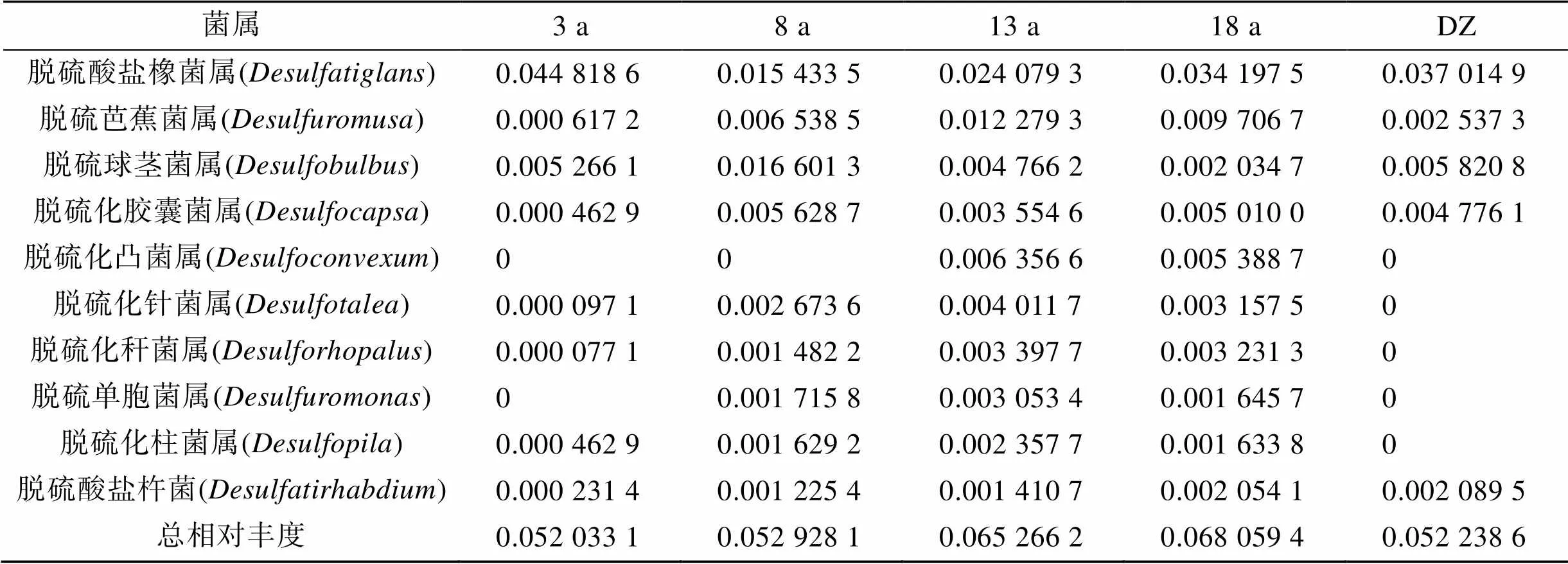
表4 沉积物硫酸盐还原菌丰度
3 讨论
研究结果显示, 长年养殖(13、18 a)网箱沉积物菌群丰富度和多样性显著大于短期养殖(3、8 a)和非养殖区(<0.05), 与颜婷茹[15]对象山港南沙港网箱养殖区以及胡晓娟[16]对汕头南澳岛白沙湾养殖海域研究结果一致, 表明长年网箱养殖对底栖微生物群落具有促进作用。这可能是养殖过程中鱼类残饵和排泄物在沉积物中的累积为细菌提供了合适的生长基质, 刺激细菌的繁殖, 从而使菌群丰富度和多样性指数更高[17-18]。
在本研究中, 随着养殖年限的增加, 长年养殖(13、18 a)网箱沉积物中脱硫菌门的丰度显著提高, 厚壁菌门的丰度显著下降。脱硫菌门主要存在于缺氧的有机污染环境并参与硫循环与碳循环[19], 说明长年养殖网箱沉积物处于严格厌氧状态并存在丰富的有机物, 原因可能是由于网箱养殖活动给沉积物带来丰富的还原性有机物, 大大地增加底栖环境的耗氧量, 裘琼芬等[20]也发现象山港网箱养殖区沉积物耗氧量是非养殖区沉积物耗氧量的2.5倍以上。厚壁菌门相对丰度的显著下降意味着隶属于厚壁菌门的乳酸菌属()、芽孢杆菌属()等典型益生菌由于不适应养殖后期严格厌氧和高污染水平沉积物环境而导致其相对丰度下降, 这些益生菌有净化水质和增强水生动物免疫力的功效[21], 益生菌相对丰度的显著下降可能会使养殖环境进一步恶化。
硫卵菌属可以利用硝酸盐将硫化物氧化为单质硫, 有时还将硫化物/单质硫氧化为硫酸盐, 是一种典型的硫氧化菌[22], 硫卵菌属和都驱动着海洋沉积物中的硫循环, 而它们在4个养殖区沉积物的相对丰度均显著大于非养殖区(<0.05), 说明养殖区沉积物中硫循环显著活跃, 可能原因是大钦岛渔民为了压缩成本, 网箱养殖主要投喂冰鲜野杂鱼[23], 饵料转化率较低, 导致大量粪便和残饵在网箱底部累积, 最终造成网箱沉积物中有机质含量较高, 有机质中的无机硫酸盐被硫酸盐还原菌分解产生硫化物[24], 硫化物的浓度的升高会刺激硫氧化菌的生长繁殖[25], 从而加速驱动网箱养殖区沉积物中硫循环。养殖后期(18 a)网箱沉积物中硫循环应该主要集中在严格厌氧的硫酸盐还原菌的硫酸盐还原作用, 这也与本研究中所测得硫化物浓度变化趋势一致, 说明长年网箱养殖区域硫氧化菌和硫酸盐还原菌的动态关系无法维持, 生态系统的平衡被打破。
对于不同海区网箱养殖沉积物, 影响菌群结构特征的环境因子不尽相同。如颜婷茹[15]发现象山港南山港网箱养殖区沉积物细菌群落特征主要与PO43–和SO42–存在显著相关性; 胡晓娟[16]发现南澳白沙湾鱼类网箱养殖区沉积物的微生物群落组成主要受TN、TP、TOC影响显著; 涂志刚[26]发现海南后水湾卵形鲳鲹()高密度网箱养殖区沉积物细菌群落结构的主要影响因子为总氮、总磷以及COD含量。在本研究中, 部分菌群相对丰度与环境因子存在显著性相关, Hg、Cd、有机碳以及石油类是影响沉积物细菌群落的主导因子, 但是与菌群的丰富度和多样性不存在显著相关(>0.05)。由于大钦岛无陆源径流输入, 网箱养殖投喂的饵料成为沉积物有机质和重金属的主要来源, 因此冰鲜野杂鱼可能是影响养殖网箱沉积物细菌群落结构的重要因素。
应当将投喂饵料由传统的冰鲜野杂鱼转变为含有水产诱食剂(氨基酸、大蒜素等)和微生态制剂(酵母菌、EM等)的绿色环保型水产饲料, 控制未能及时被养殖动物吸收利用的N、P等物质进入水体, 有利于预防长年养殖网箱区水体和沉积物发黑发臭。在养殖后期(13、18 a)网箱沉积物中投放适量的厌氧不产氧光合细菌, 光合细菌是一类可以在厌氧光照条件下利用有机物、硫化物以及氨进行光合作用的微生物, 实现对污染沉积物的初步改造, 使其适应大型生物存活, 后续引入刺参()及大型藻类, 进行大型生物修复。以刺参、沙蚕()、魁蚶()等沉积食性生物摄食沉积物有机质, 当地养殖品种海带作为修复藻类吸收N、P矿化释放营养盐, 构建多营养层次养殖生态系统, 提高生态系统对网箱沉积物有机质的利用效率, 最终实现污染沉积物治理。
4 结论
本研究结果表明, 长年养殖(13、18 a)网箱沉积物菌群丰富度和多样性显著高于短期网箱养殖(3、8 a)区。Hg、Cd、有机碳以及石油类是影响沉积物细菌群落的主要环境因子。长年网箱养殖区沉积物硫循环失调且处于严格厌氧状态, 主要原因可能是大钦岛网箱养殖区长期投喂冰鲜野杂鱼导致, 应及时推广绿色环保型配合饲料, 同时构建多营养层次养殖生态系统实现对污染沉积物的治理。
[1] 李洪鹏. 原生态复合菌对浅海养殖区氮和有机污染的净化作用研究[D]. 青岛: 中国海洋大学, 2008.
LI Hongpeng. Study on purification of eco-original bacteria group on nitrogen and dissolved organic matter pollution in shallow sea aquaculture region[D]. Qingdao: Ocean University of China, 2008.
[2] 徐永健, 钱鲁闽. 海水网箱养殖对环境的影响[J]. 应用生态学报, 2004, 3: 532-536.
XU Yongjian, QIAN Lumin. Impacts of cage culture on marine environment[J]. Chinese Journal of Applied Ecology, 2004, 3: 532-536.
[3] RICHARDS C M, PALLUD C. Kinetics of sulfate reduction and sulfide precipitation rates in sediments of a bar-built estuary (Pescadero, California)[J]. Water Research, 2016, 94: 86-102.
[4] 操戈, 邓卫哲, 徐承旭. 海南大力发展深海网箱养殖[J].水产科技情报, 2017, 44(2): 109.
CAO Ge, DENG Weizhe, XU Chengxu.Hainan vigorously develops deep-sea net-pen aquaculture[J]. Fisheries Science & Technology Information, 2017, 44(2): 109.
[5] 高晓霞, 周国良. 打造深海网箱养殖岭南优势产业带——广东召开深海养殖网箱推进会[J]. 海洋与渔业, 2020, 6: 13-14.
GAO Xiaoxia, ZHOU Guoliang. Guangdong held a meeting to promote deep-sea aquaculture netting to create an advantageous industrial zone in Lingnan[J]. Ocean and Fishery, 2020, 6: 13-14.
[6] 黄小平, 郭芳, 黄良民. 大亚湾典型养殖区表层沉积物环境特征研究[J]. 热带海洋学报, 2008, 27(5): 37-42.
HUANG Xiaoping, GUO Fang, HUANG Liangmin. Researches on surface sediment environment in marine culture area of Daya Bay[J]. Journal of Tropical Oceanography, 2008, 27(5): 37-42.
[7] 孙超, 朱玲, 毛玉泽, 等. 象山港南沙岛不同养殖模式沉积物微生物群落结构分析[J]. 渔业科学进展, 2014, 35(4): 13-21.
SUN Chao, ZHU Ling, MAO Yuze, et al. The structures of sediment microbial communities in different mariculture models at Xiangshan Bay of China[J]. Progress in Fishery Sciences, 2014, 35(4): 13-21.
[8] 丁敬坤, 薛素燕, 李加琦, 等. 基于大型底栖动物的桑沟湾不同养殖区底栖生境健康评价[J]. 中国水产科学, 2020, 27(12): 1393-1401.
DING Jingkun, XUE Suyan, LI Jiaqi, et al. Health assessment of large-scale aquaculture on benthic habitats in Sanggou Bay[J]. Journal of Fishery Sciences of China, 2020, 27(12): 1393-1401.
[9] 胡志强, 胡志兴, 葛培义. 大钦岛深水网箱养鱼发展现状及对策[J]. 齐鲁渔业, 2010, 27(9): 53-54.
HU Zhiqiang, HU Zhixing, GE Peiyi. Current situation and countermeasures for the development of deep-water net-pen fish farming on Dachin Island[J]. Shandong Fisheries, 2010, 27(9): 53-54.
[10] BOLGER A M, LOHSE M, USADEL B. Trimmomatic: a flexible trimmer for Illumina sequence data[J]. Bioinformatics, 2014, 30(15): 2114-2120.
[11] MAGOČ T, SALZBERG S L. FLASH: fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21): 2957-2963.
[12] EDGAR R C, HAAS B J, CLEMENTE J C, et al. UCHIME improves sensitivity and speed of chimera detection[J]. Bioinformatics, 2011, 27(16): 2194-2200.
[13] ROGNES T, FLOURI T, NICHOLS B, et al. VSEARCH: a versatile open source tool for metagenomics[J]. PeerJ, 2016, 4: e2584.
[14] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336.
[15] 颜婷茹. 象山港南沙港网箱养殖区沉积物微生物群落多样性的时空分布规律研究[D]. 上海: 上海海洋大学, 2012.
YAN Tingru. The temporal and spatial distribution of microbial community in response to fish cage farming in Nansha Bay in East China Sea[D]. Shanghai: Shanghai Ocean University, 2012.
[16] 胡晓娟. 广东典型海域微生物群落特征分析[D]. 广州: 暨南大学, 2013.
HU Xiaojuan. Analysis on microbial community characteristics in the typical sea areas in Guangdong Province[D]. Guangzhou: Jinan University, 2013.
[17] 廖红芳, 郑忠明, 冯坚, 等. 象山港大黄鱼()网箱养殖区及邻近海域沉积物中异养细菌生态分布[J]. 海洋与湖沼, 2014, 45(6): 1308-1316.
LIAO Hongfang, ZHENG Zhongming, FENG Jian, et al. Bacterial ecological distribution in sediment of a yellow croaker () cage farm and adjacent sites in Xiangshan Bay[J]. Oceanologia et Limnologia Sinica, 2014, 45(6): 1308-1316.
[18] VEZZULLI L, CHELOSSI E, RICCARDI G, et al. Bacterial community structure and activity in fish farm sediments of the Ligurian sea (Western Mediterranean)[J]. Aquaculture International, 2002, 10(2): 123-141.
[19] NEALSON K H. Sediment bacteria: who’s there, what are they doing, and what’s new?[J]. Annual Review of Earth and Planetary Sciences, 1997, 25(1): 403-434.
[20] 裘琼芬, 张德民, 叶仙森, 等. 象山港网箱养殖对近海沉积物细菌群落的影响[J]. 生态学报, 2013, 33(2): 483-491.
QIU Qiongfen, ZHANG Demin, YE Xiansen, et al. The bacterial community of coastal sediments influenced by cage culture in Xiangshan Bay, Zhejiang, China[J]. Acta Ecologica Sinica, 2013, 33(2): 483-491.
[21] 刘艳丽, 吕惠蓉, 李海东, 等. 温度对大鳞副泥鳅肠道菌群组成的影响研究[J]. 中国水产, 2022, 1: 94-97.
LIU Yanli, LV Huirong, LI Haidong, et al. Study on the effect of temperature on the composition of the intestinal flora of the paralarval loach[J]. China Fisheries, 2022, 1: 94-97.
[22] 方安琪, 贺志理, 王成, 等. 红树林沉积物中微生物驱动硫循环研究进展[J]. 微生物学报, 2020, 60(1): 13-25.
FANG Anqi, HE Zhili, WANG Cheng, et al. Progress in studying microbially-driven sulfur cycling in mangrove sediments[J]. Acta Microbiologica Sinica, 2020, 60(1): 13-25.
[23] 王凯. 长岛地区深水网箱养殖许氏平鲉主要疾病的流行病学调查与病原病理学研究[D]. 上海: 上海海洋大学, 2018.
WANG Kai. Epidemiology, etiology and histopathology of black rockfish () major diseases in Changdao County offshore cage[D]. Shanghai: Shanghai Ocean University, 2018.
[24] 甘居利, 林钦, 黄洪辉, 等. 大鹏澳网箱养殖区底质硫化物分布、变化和污染分析[J]. 水产学报, 2003, 6: 570-574.
GAN Juli, LIN Qin, HUANG Honghui, etal. Distribution, variation and pollution of the sulfide in surfacial sediment at cage culture area in Dapengao Bay[J]. Journal of Fisheries of China, 2003, 6: 570-574.
[25] 刘阳, 姜丽晶, 邵宗泽. 硫氧化细菌的种类及硫氧化途径的研究进展[J]. 微生物学报, 2018, 58(2): 191-201.
LIU Yang, JIANG Lijing, SHAO Zongze. Advances in sulfur-oxidizing bacterial taxa and their sulfur oxidation pathways[J]. Acta Microbiologica Sinica, 2018, 58(2): 191-201.
[26] 涂志刚. 海南后水湾深水网箱养殖区微生物多样性及其养殖卵形鲳鲹“烂身病”研究[D]. 海口: 海南大学, 2017.
TU Zhigang. Studies on microbial diversity and rot body disease ofin deep-sea cage aquaculture area in Houshui Bay, Hainan[D]. Haikou: Hainan University, 2017.
Analysis of the microbial community structure of deep-water net tank sediments of Daqin Island at different culture years
XIE Wei-jun1, 2, ZHAO Yu-ting2, LIU Yuan-jin2, HU Shun-xin2, JIANG Hai-bin2, HAN Hui-zong2, WANG Teng-teng2, WANG Fei2, LI Zhao-long1, 2, ZHANG Ming-liang2
(1. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China; 2. Shandong Marine Resources and Environment Research Institute, Yantai 264006, China)
To investigate the effect of deep-water net-pen culture years on the sediment microbial community structure, 16S rDNA high-throughput sequencing was performed on the surface sediments (0–2 cm) of 3, 8, 13, and 18 a net-pen culture and nonculture areas (DZ) in Daqin Island waters. The results showed that the abundance and diversity of sediment flora were significantly higher (<0.05) in the long-year net box culture (13, 18 a) than in the short-term net box culture (3, 8 a). The dominant phyla in the sediment of the net pots changed significantly with increasing years of culture (<0.05). Bacteroidota, Proteobacteria, and Firmicutes were the dominant phyla in the sediment of the short-term net pots (3, 8 a) and the nonculture zone (DZ), while the dominant phyla in the sediment of the long-term net pots (13, 18 a) were Bacteroidota, Proteobacteria, and Firmicutes. The main dominant phyla in the sediments of the long-year net culture (13, 18 a) were Bacteroidota, Proteobacteria, and Desulfobacterota. The dominant environmental factors influencing the structure of the sediment flora in the net pens were Hg, Cd, organic carbon, and petroleum. The feeding of chilled wild fish may be one of the important factors contributing to the environmental degradation of the perennial net tank culture area on Daqin Island. The use of green and environmentally friendly compound feeds should be promoted, and a combination of microorganisms (microecological agents based on anaerobic nonoxygenic photosynthetic bacteria) and macroorganisms (spiny cucumbers and macroalgae) should be incorporated for the remediation of polluted sediments to facilitate the promotion of healthy culture and sustainable development of deep-water net tanks.
deep-water nets; cuture years; sediment; microbial communities
Mar. 21, 2022
s949
A
1000-3096(2022)12-0031-10
10.11759/hykx20220321003
2022-03-21;
2022-05-05
山东省重点研发计划项目(2020CXGC011404); 国家自然科学基金项目(42176159); 国家现代农业产业技术体系(CARS-47)
[Key Research and Development Project of Shandong, No. 2020CXGC011040; National Natural Science Foundation of China, No. 42176159; Construction of Modern Agricultural Industry Technology System of China, No. CARS-47]
解维俊(1996—), 男, 硕士研究生, 主要从事水生态环境修复研究, E-mail: 1665039783@qq.com; 张明亮(1982—),通信作者, E-mail: zhangml1982@126.com
(本文编辑: 谭雪静)
