大型海藻龙须菜凋落物分解对水质的影响
2021-03-05戴晓娟胡韧罗洪添王庆胡晓娟白敏冬杨宇峰
戴晓娟, 胡韧, 罗洪添, , 王庆, , 胡晓娟, , 白敏冬, 杨宇峰,
1. 暨南大学水生生物研究所, 广东 广州 510632;
2. 南方海洋科学与工程广东省实验室, 广东 珠海 519080;
3. 中国水产科学院南海水产研究所, 广东 广州 510300;
4. 厦门大学环境与生态学院, 福建 厦门 361102
大型海藻龙须菜(Gracilaria lemaneiformis)在我国沿岸被广泛栽培, 它能有效吸收氮、磷等营养盐, 修复富营养化水体, 收获的龙须菜可用于生产琼胶, 因此龙须菜栽培具有重要的经济、社会和生态效益(Yang et al, 2015)。江蓠属海藻产量在我国大型海藻栽培产量中位列第二, 仅次于海带(农业农村部渔业渔政管理局, 2019), 而龙须菜是江蓠属海藻产量的主要贡献者(Yang et al, 2015)。大型海藻会因衰老或外部因素干扰而导致藻体凋落, 凋落衰亡的大型海藻在分解过程中, 其吸收的营养盐会重新被释放到水体中, 进而影响海洋生态系统营养盐循环(Pedersen et al, 2017)。
大型海藻生长可作为海水营养盐的汇(Mawi et al, 2020), 但凋落分解可能使其变成释放营养盐的源。目前关于大型海藻凋落物分解的研究仍十分有限, 国内学者主要关注“绿潮”大型海藻衰亡。如孟祥森等(2016)通过对绿潮硬毛藻衰亡过程的研究, 发现大量氮磷释放到海水中, 造成了局部水域的富营养化。刘湘庆等(2016)的研究显示, 我国黄海漂浮浒苔的衰亡分解可导致水体缺氧, 其释放大量的营养盐会恶化水质。大型海藻规模栽培中往往存在藻体在海区腐烂的现象, 如海带在滞销时因未及时收割而烂在海里, 紫菜因气候影响而大面积死亡, 并在海中腐烂分解。
为评估大型海藻龙须菜的凋落分解过程及沉积物对其凋落分解的影响, 本研究选取大型海藻龙须菜为实验对象, 采用室内模拟方法, 研究新鲜龙须菜和干龙须菜分别在有沉积物和无沉积物条件下分解对水质的影响, 以期为海洋环境保护和大型海藻栽培产业可持续发展提供科学依据。
1 材料与方法
1.1 实验材料
龙须菜采自广东南澳岛深澳湾, 用人工海水冲洗干净, 一部分 65℃烘干至恒重(即干龙须菜), 另一部分洗净后用滤纸吸干藻体表面水分(即鲜龙须菜)。在广东省南澳县深澳湾网箱养殖区用抓斗式采泥器采集表层沉积物, 风干后过孔径 1mm网筛, 去除杂物及动植物残体后充分混匀。实验采用人工海水: 自来水曝气24h 后, 以30g 海盐配1L 水的比例配置, 搅拌均匀后测其盐度为 30‰, 静置12h。
1.2 实验设计
实验共设置6 组: 海水组(W 组)、海水+沉积物组(S 组)、干龙须菜+海水组(DW 组)及鲜龙须菜+海水组(FW 组)、干龙须菜+海水+沉积物组(DWS 组)、鲜龙须菜+海水+沉积物组(FWS 组)(图1), 每组3 个重复。实验条件为温度25℃、光强5500lx、光暗周期比12h: 12h。将3g 干龙须菜、30g 鲜龙须菜分别装入上孔径2mm、下孔径0.18mm 的凋落物袋, 放入装有2.5L 人工海水的3L 烧杯中, 沉积物组的烧杯内有250g 沉积物(Paalme et al, 2002; 王云祥 等, 2016)。在第 0、1、3、6、10、15、21、28、36、45 天取样, 取样前测定溶解氧(dissolved oxygen, DO), 用去离子水补充蒸发水量, 待其自然混合均匀后采集 20mL 水样, 用于测定水体总氮(total nitrogen, TN)、总磷(total phosphorus, TP)浓度, 最后用去离子水补充水量至2.5L。于实验始末测定龙须菜总氮、总磷和总碳(total carbon, TC)含量, 以及称量龙须菜干重。
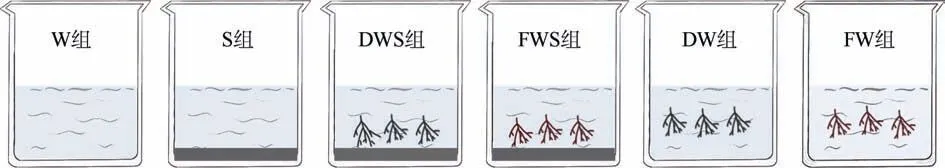
图1 龙须菜凋落物分解实验设置 W 组表示海水组; S 组表示海水+沉积物组; DW 组表示干龙须菜+海水组; FW 组表示鲜龙须菜+海水组; DWS 组表示干龙须菜+海水+沉积物组; FWS 组表示鲜龙须菜+海水+沉积物组 Fig.1 Experimental design of G. lemaneiformis litter decomposition W represents seawater, S represents sediment, DW represents dried seaweed+seawater, FW represents fresh seaweed+seawater, DWS represents dried seaweed+seawater+sediment, and FWS represents fresh seaweed+seawater+sediment
用 YSI-Plus 多参数水质分析仪(美国)测量水温、盐度和 DO; 依据《海洋调查规范》(GB/T 12763.4-2007)(中华人民共和国国家质量监督检验检疫总局 等, 2017)测定水体的TN 和TP。用电感耦合等离子体发射光谱仪(英国, Thermo Scientific, iCAP 7000 SERIES)测定龙须菜的TP 含量; 龙须菜的 TN 和 TC 含量则用有机元素分析仪(德国, Elementar, vario EL cube)测定。
1.3 数据处理
参照Zhou 等(2018)的方法, 失重率计算公式为:
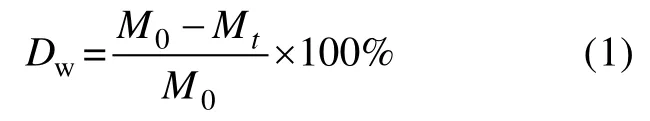
式中: Dw为失重率(单位: %); M0、Mt分别为龙须菜被投放初始以及投放td 后的干重(单位: g)。
分解速率估算采用Olson(1963)的指数衰减模型:

式中: k为分解速率(单位: d–1), t为分解时间(单位: d)。
营养盐释放率公式(孟祥森 等, 2016)为:
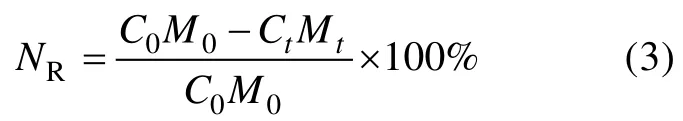
式中: NR为营养盐释放率(单位: %); C0、Ct分别为分 解开始和结束时龙须菜营养盐含量(单位: mg·g–1)。
参照组采用生物合成人胰岛素(批准文号:国药准字J20120034;规格:10 mL:400 IU)治疗。要求患者进行有氧运动,并开展饮食控制,在患者餐前30 min,对其进行皮下注射生物合成人胰岛素治疗。起始剂量为6 U,根据患者血糖水平变化情况,合理调整给药剂量,为4 U/次[2]。对患者连续治疗2周。
营养盐单位累积贡献量的计算公式(杜立刚, 2013)为:
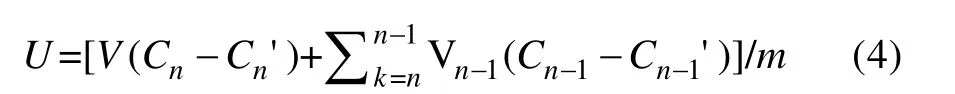
式中: U 为单位累积释放量(单位: mg·g–1); V 为烧杯中的溶液总体积(单位: L); n 为采样次数; Cn为第n次采样时实验组中的N 或P 浓度(单位: mg·L–1); Cn'为第n 次采样时空白组的N 或P 浓度(单位: mg·L–1); Vn为取样体积(单位: L); m 为龙须菜初始干重(单位: g)。
2 结果与分析
2.1 龙须菜的分解与营养盐释放率
在45d 的实验周期内, 龙须菜的失重率和分解速率在各实验组之间的对比均呈DW 组>DWS 组>FWS 组>FW 组(表1), 其中FW 组失重率和分解速率显著低于干龙须菜组(DW 组和DWS 组)(P<0.05)。龙须菜氮、磷和碳释放率在各实验组之间的对比同样呈DW 组>DWS 组>FWS 组>FW 组分布(表1), 其中FW 组的TN 最终释放率为负值(-1.13±7.38%), 并 显 著 低 于 DW 组 的 TN 释 放 率(73.96±5.61%)(P<0.05)。此外, FW 组的TC 和TP 释放率均明显低于两个干龙须菜组(DW 组和 DWS组)(P<0.05)。这一实验结果表明干龙须菜分解较剧烈, 而沉积物对干、鲜龙须菜的分解具有不同影响。
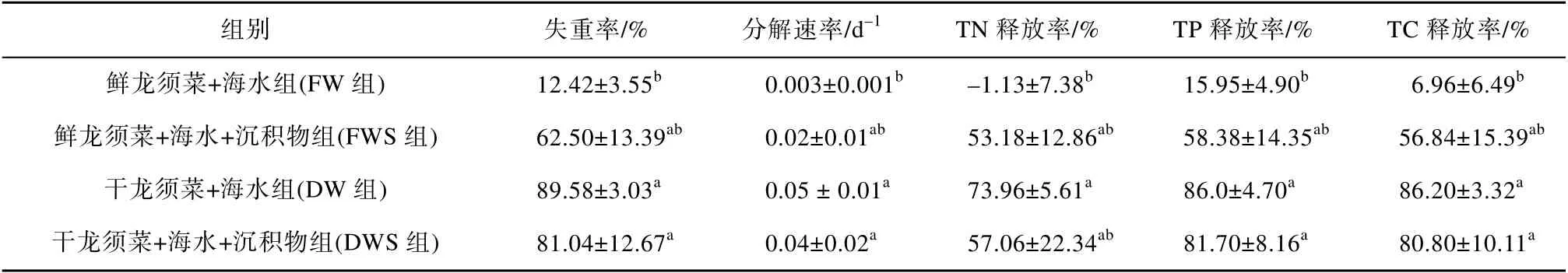
表1 龙须菜的失重率、分解速率和营养盐释放率 Tab. 1 The weight loss rate, decomposition rate and release rate of nutrients in G. lemaneiformis
2.2 龙须菜分解过程中的水体理化指标变化
2.2.1 水体DO 浓度变化
在45d 实验周期中, W 组、S 组及FW 组的DO浓度在3.63~7.19mg·L–1之间波动, 其他处理组的水体DO 浓度变化较大(图2)。DW 组中, 其水体DO浓度在第 1 天快速下降, 在第 3~28 天于 0.04~ 0.09mg·L–1之间波动, 其中在第21 天达到最低值(0.04mg·L–1); DWS 组中, DO 浓度在第1 天快速降低, 在第6~28 天于0.04~0.10mg·L–1之间波动, 在第21天DO 浓度最低(0.04±0.01mg·L–1); FWS 组DO 浓度在第 0~21 天持续下降, 于第 21 天达到最低值(0.26±0.32mg·L–1)后又逐渐恢复至对照组水平。实验过程中, 各处理组的水体DO 浓度变化反映了龙须菜的凋落分解可导致水体短期缺氧。各实验组在整个实验过程中的水体DO 平均浓度大小对比为W 组>FW 组>S 组>FWS 组>DW 组>DWS 组。
在无沉积物组中, 水体的 DO 浓度范围为0.04~7.19mg·L–1, 各组在实验过程中的 DO 平均浓度呈W 组>FW 组>DW 组。在沉积物组中, 水体的DO 浓度范围为0.04~6.75mg·L–1, 各组在实验过程中的DO 平均浓度呈S 组>FWS 组>DWS 组。

图2 龙须菜分解过程中的水体DO 浓度变化 a. 无沉积物组; b. 有沉积物组 Fig.2 Variation of DO concentration in water body during the G. lemaneiformis litter decomposition period. (a) Treatments without sediments, and (b) treatments with sediments
2.2.2 水体TN 浓度变化
W 组、S 组及FW 组的水体TN 浓度在实验周期内较稳定, 其他组则变化较大(图3)。DW 组中, TN 浓度在第3 天达到最大值(12.10±1.92mg·L–1), 然后缓慢下降, 第10 天后基本保持稳定; DWS 组中, TN 浓度在初始的几天呈较快速的上升趋势, 并在第6 天达到最大值(18.45±3.36mg·L–1), 随后逐渐下降至有沉积物的对照组水平; FWS 组的TN 浓度在第28 天上升至最大值(9.93±1.89mg·L–1)后也转为下降。各组TN 平均浓度呈DWS 组>DW 组>FWS 组>S 组>W 组>FW 组。以上实验结果表明龙须菜的凋落分解可使水体TN 浓度短期上升。
在无沉积物组中, 水体的 TN 浓度范围为0.99~12.10mg·L–1, 各组在实验过程中的TN 平均浓度呈DW 组>W 组>FW 组, DW 组水体平均TN 浓度显著高于FW 组和W 组(P<0.05)。在沉积物组中, 水体的TN 浓度范围为2.53~18.45mg·L–1, 各组在实验过程中的TN 平均浓度呈DWS 组>FWS 组>S 组, DWS 组水体平均TN 浓度显著高于FWS 组和S 组(P<0.05), FWS 组又显著高于S 组(P<0.05)。
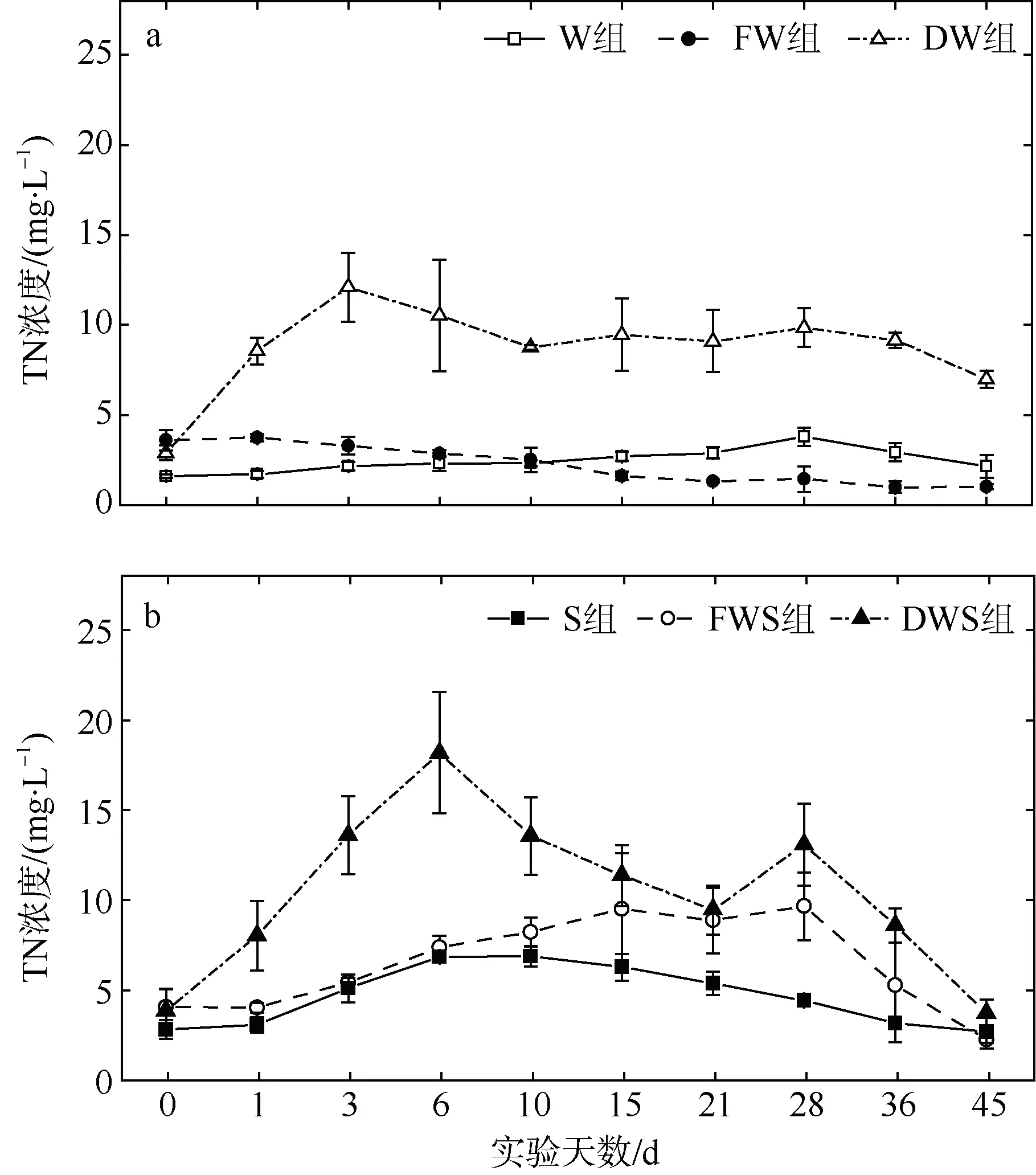
图3 龙须菜分解过程中的水体TN 浓度变化 a. 无沉积物组; b. 有沉积物组 Fig.3 Variation of TN concentration in water body during the G. lemaneiformis litter decomposition period. (a) Treatments without sediments, and (b) treatments with sediments
2.2.3 水体TP 浓度变化
在45d 实验周期中, W 组、S 组及FW 组的水体TP 浓度都较为稳定, 其他组的水体TP 浓度则变化较大(图4)。DW 组中, TP 浓度在第1 天迅速上升, 至第3 天达到最高浓度(2.03±0.28mg·L–1), 之后缓慢下降并趋于稳定; DWS 组中, 第3 天TP 浓度上升至最高浓度(1.69±0.15mg·L–1)后也转为缓慢下降; FWS组的TP 浓度在实验期间缓慢上升, 并在第36 天达到最高值(1.11±0.90mg·L–1), 随后开始下降。各组的水体TP 平均浓度呈DW 组>DWS 组>FWS 组>S 组>FW 组>W 组。以上实验结果表明龙须菜的凋落分解造成水体TP 浓度短期上升。
在无沉积物组中, 水体的 TP 浓度范围为0.03~2.03mg·L–1, 各组在实验过程中的的 TP 平均浓度呈DW 组>FW 组>W 组, DW 组水体平均TN 浓度显著高于FW 组和W 组(P<0.05)。在沉积物组中, 水体的TP 浓度范围为0.15~1.69mg·L–1, 各组在实验过程中的TP 平均浓度呈DWS 组>FWS 组>S 组, DWS 组水体平均TN 浓度显著高于FWS 组和S 组(P<0.05), 而FWS 组又显著高于S 组(P<0.05)。
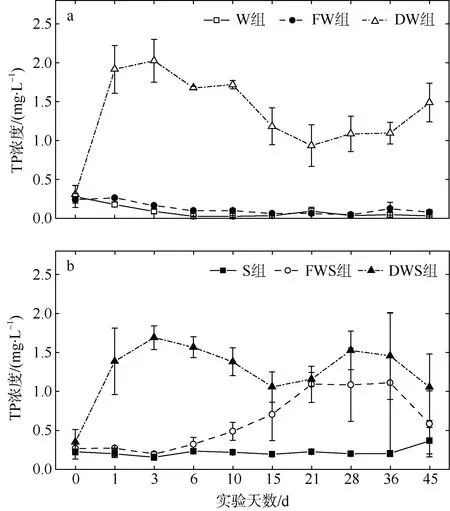
图4 龙须菜分解过程水体TP 浓度变化 a. 无沉积物组; b. 有沉积物组 Fig.4 Variation of TP concentration in water body during the G. lemaneiformis litter decomposition period. (a) Treatments without sediments, and (b) treatments with sediments
2.2.4 龙须菜凋落分解对水体TN、TP 浓度的贡献
各实验组中龙须菜的凋落分解对水体TN、TP浓度影响不同。龙须菜(3g 干重)营养盐净释放量如表2 所示, TN 和TP 单位累积释放量均呈现DW 组>DWS 组>FWS 组>FW 组的趋势, 其中FW 组的TN单位累积释放量为负(–1.81mg·g–1), 表明鲜龙须菜吸收的TN 大于其释放的TN。烘干处理对龙须菜的TN 和TP 释放影响更大, 其中对水体TN 的累积贡献量最大。

表2 龙须菜TN、TP 单位累积释放量 Tab. 2 Unit cumulative release of TN and TP from G. lemaneiformis
3 讨论
3.1 龙须菜分解特征
凋落物分解一般分为两个阶段: 可溶性化合物淋溶引起的凋落物快速失重阶段与随后发生的微生物分解剩余物质阶段(Shilla et al, 2006)。不同大型海藻凋落物完全分解的周期存在较大差异, 例如大型海藻Palmaria 和Desmarestia 的分解周期分别为31d和48d(Braeckman et al, 2019)。本研究中, 干龙须菜在第45 天几乎完全分解, 与上述大型海藻分解周期相近。以DW 组为例, 干龙须菜的分解可分为两个阶段: 第一阶段为第0~6 天, 期间藻体中氮、磷快速释放, 水体中总氮、总磷浓度快速上升; 第二阶段为第6 天至实验结束, 水体中总氮、总磷浓度呈现波动变化或下降趋势。FWS 组的鲜龙须菜在第45 天仅失重62.5%, 新鲜龙须菜(尤其是FW 组)的失重率低于烘干组(表1), 表明自然凋落的龙须菜, 其分解周期长于晒干的龙须菜。Brouwer(1996)发现烘干大型海藻细胞中的磷更易于被微生物吸收, 进而破坏细胞壁, 刺激物质浸出。衰亡大型海藻中的多酚化合物含量减少, 营养价值更高, 而多酚化合物可抑制微生物定殖及底栖动物的同化效率(Dethier et al, 2014), 因此干龙须菜比新鲜龙须菜分解更快, 且释放营养盐更多。
微生物对藻体分解起重要作用, 本研究为室内受控实验, 水体处于静置状态。静水中微生物是最主要的分解者(Battle et al, 2000)。沉积物中存在大量微生物和生物活性酶类, 可有效促进以微生物降解为主的藻体分解(Goecke et al, 2013)。本研究中, FWS 组的龙须菜分解周期比FW 组更短, 营养盐释放率更高, 可能是沉积物中的微生物活动在鲜龙须菜分解中起了主要作用。但是, 干龙须菜的分解过程正好相反, 烘干藻体的快速淋溶作用在沉积物中不如在水体中强烈。水体中的淋溶作用是一个更快的过程, 因为水体流动使分解物质周围的水不断更新, 从而促进有机化合物和矿物的溶解(Brock et al, 1982)。相对于DW 组而言, DWS 组中沉积物的存在可能限制了干龙须菜的分解。因此, 推测可溶性物质的快速淋溶在干龙须菜分解过程中起主要作用, 而沉积物的存在对干龙须菜淋溶可能有抑制作用。
3.2 龙须菜分解对水环境的影响
3.2.1 龙须菜分解对水体营养盐的贡献
一般认为水体TN 浓度在植物分解初期会迅速上升, 在后期又下降到较低水平(叶春 等, 2014)。在分解初期, 植物释放大量有机氮, 微生物迅速进行氨化作用(王博 等, 2009), 导致水体TN 浓度明显上升。微生物利用凋落物分解释放的溶解性有机碳生长, 大量消耗水体中的溶解氧, 且通过反硝化作用将水体中的氮转化为气体并释放至大气中(曹勋 等, 2015), 导致水体TN 浓度下降, 且伴随着溶解氧的消耗。本文的实验过程也展示了这一变化趋势: 水体中的TN 浓度在第3~6 天达到最高, 随后持续下降, 并在第45 天达到与实验前持平的浓度。
干龙须菜凋落物沉降至海底, 可能有利于减弱其对海水氮浓度变化的影响。凋落物分解体系中沉积物是发生反硝化作用的主要场所(Bastviken et al, 2005), 而大型海藻凋落物使沉积物有机质富集及氧渗透力降低, 导致沉积物中的微生物反硝化作用增强(García-Robledo et al, 2013)。因此, 推测本次实验中沉积物的存在可能促进了龙须菜凋落过程中的微生物反硝化作用, 促使更多的氮被还原成氮气进入大气, 从而降低了水体的总氮浓度。
水体TP 浓度在凋落物分解初期快速增加, 随后逐渐降低。由于植物组织中磷的快速物理淋溶主要发生在分解初期, 使水体TP 浓度快速上升(Wang et al, 2018), 其后的降低可能是由于藻体上附着细菌和真菌的繁殖吸收所致(Wu et al, 2017)。本研究中DW 组与DWS 组水体的TP 浓度在前期虽经历了上述过程, 但在实验后期均再次缓慢上升, 这与陈洪森等(2020)的河口水生植物研究结果相似。水体中的磷一般不会因微生物过程而变为气体并逃逸, 水体中磷的浓度波动可能与微生物生长时吸收一部分磷来合成自身结构及死亡时又释放回水体的过程有关(童雄 等, 2019)。Ozalp 等(2007)的研究也发现在凋落物分解后期微生物对磷的矿化程度大于固定程度。
本文的研究结果表明沉积物可吸收龙须菜凋落物分解释放的磷, 缓解其对水质的影响。在凋落物分解过程中磷循环几乎不存在气体释放, 沉积作用是除磷的主要机制(Li et al, 2014)。好氧状态有利于Fe2+转化为Fe3+, 与磷酸盐结合成难溶性磷酸铁, 促进沉积物对磷的吸收; 厌氧时Fe3+被还原, 释放原本沉积状态的磷酸盐及被[Fe(OH)3]x吸附的游离态磷, 导致水体磷浓度上升(王立志 等, 2013)。DWS组中龙须菜的分解释放大量磷到水中, 且DO 浓度在前28d 的降低和后期的升高分别抑制和促进沉积物对水体磷的吸收, 造成水体中磷浓度的波动和后期下降。García-Robledo 等(2008)的研究表明, 由于大型海藻在分解后期剩余生物量少, 沉积物表面被遮光的面积减小, 光照可照射到表层沉积物的底栖微藻群落, 底栖微藻恢复光合活性, 吸收水体营养盐并开始生长。沉积物的沉积作用及底栖生物的生命活动可缓解干龙须菜凋落物造成的水体总磷增加。
收获后的大型海藻龙须菜大部分需要晒干后销售或囤放。龙须菜滞销时将造成仓库大量囤积, 若渔民将收获过程中散落的干龙须菜重新弃置水中, 可对海区造成二次污染。Battle 等(2000)的研究指出, 植物预先烘干后的凋落与自然腐解过程不同。烘干使植物在分解初期迅速发生可溶性物质淋溶作用, 而新鲜植物分解初期需经历叶组织缓慢死亡, 其释放可溶性物质的量比烘干植物要少(Gessner, 1991)。王立志等(2020)指出经过不同处理(干或鲜)后的植物分解速率不同, 在新鲜植物自然分解过程模拟中, 植物仍进行缓慢的光合作用, 分解速率较慢。本研究中, 新鲜龙须菜的生命活动可能在实验过程中缓慢减弱直至完全停止, 在实验中后期(第10~45 天)才开始加速分解, 而干龙须菜则在实验初期就迅速分解, 因此鲜龙须菜组中总体的氮磷变化曲线较干龙须菜组平缓且迟滞。这一研究结果表明干龙须菜的分解对水质影响更大, 故收获后晾干的龙须菜应妥善处理, 避免投入海中分解。
3.2.2 龙须菜分解对氮、磷生物地球化学循环的影响
龙须菜在生长过程中可大量吸收氮和磷, 降低水体营养盐含量(Yang et al, 2015)。刘之威等(2019)在调查中发现龙须菜规模栽培对海水中氮、磷的单位移除量分别为44.48mg·g–1和3.50mg·g–1, 均低于干龙须菜分解对水体氮、磷的单位累积释放量, 而高于鲜龙须菜分解对水体氮、磷的单位累积释放量。但FWS 组中未完全分解的龙须菜的磷单位累积释放量达 3.2mg·g–1, 接近于其生长中对磷的移除量(表2)。2018 年广东省龙须菜产量为49738t(农业农村部渔业渔政管理局, 2019), 若其中的5%脱落形成凋落物, 以DW 组的实验结果为例进行估算, 干龙须菜分解对水体氮、磷释放量分别占其生长吸收量的5.88%和15%。若凋落量进一步增加, 将对水质产生重要影响。研究表明植食性动物可捕获和摄食一部分海藻凋落物(Filbee-Dexter et al, 2020), 其生态过程和影响因不同大型海藻种类和海区环境而有较大差异, 有关龙须菜凋落过程与动物的关系还需要进一步调查和分析。龙须菜规模栽培虽可吸收营养盐, 改善水质, 但若任其脱落物在海水中腐烂分解, 会造成海洋环境污染。因此, 在龙须菜栽培过程中, 应及时清理衰老或脱落的藻体, 妥善处理收获后晾干的龙须菜, 以保障大型海藻规模栽培对海区的生物修复效果。
4 结论
1) 龙须菜凋落分解会对水质造成影响, 导致水体短期缺氧, 水体氮、磷浓度上升。
2) 干龙须菜凋落物分解过程中的碳、氮和磷释放率、失重率及分解速率均高于鲜龙须菜。
3) 沉积物可减缓干龙须菜向水体中释放氮和磷, 有效减缓凋落物对水体环境的影响。
4) 在龙须菜栽培过程中应及时打捞脱落或衰老的藻体, 尤其对已收获的大型海藻应妥善处理, 避免大型海藻腐烂而导致海水二次污染。
