渗透胁迫对构树叶型以及叶片分布分形维数的影响*
2022-02-28张欢欣钱志良姚靖泓王洋文刘禹含胡文涛
龙 硕 张欢欣 钱志良 姚靖泓王洋文 刘禹含 孟 森 胡文涛
(1.华南农业大学 林学与风景园林学院/广东省森林植物种质创新与利用重点实验室,广东 广州 510642;2.中国林业科学研究院 热带林业研究所/国家林业和草原局热带林业研究重点实验室,广东 广州 510520)
构树Broussonetia papyrifera是桑科Moraceae构属Broussonetia落叶乔木,雌雄异株,树可高达16 m,全株富含乳汁[1],广泛分布于我国。构树是绿化荒坡、荒山、荒滩以及盐碱地的先锋树种,具有较强的速生性、适应性及抗逆性等特点,可以富集重金属元素和修复污染的环境[2]。
构树叶片具有异形叶性,可以分为裂缺叶和全缘叶两种类型[3]。构树的叶型比例与年龄有关,构树成株以全缘叶为主,在幼株上表现出明显的异叶形性[4]。慕军鹏和陈红利[3]针对构树的异叶形性进行生态调查研究,表明裂缺叶抵抗病虫害的能力更强。在其他植物裂缺叶的研究中,Zhang等[5]研究发现甘蓝型油菜Brassica napus的裂叶能提高群体的光合作用效率,而且可能与耐盐性呈负相关;李雁玲[6]研究发现胡杨Populus euphratica3 种异形叶的光合特性不同,认为可能与其适应干旱、高温等逆境胁迫有关;曾明[7]研究表明胡杨异形叶性是为提高自身在强光、高温、干旱等不利环境中的生存能力和生产效率的适应性策略。而在构树幼树中,构树叶片缺裂是否与响应渗透胁迫有关有待研究。由于环境胁迫会改变植物叶片分型[3]与分枝格局[8],许多研究用分形维数来分析植物的形态结构[9-10],而构树这种抗逆性较强的树种是否因环境胁迫而发生叶型变化进而改变叶片分布的分形维数鲜有报道。
环境胁迫能影响植物光合能力[11],植物可以通过形态的改变,如叶型分化等提高获取和利用资源的能力[3],同时其内在也有相关抗逆生理生化机制。研究表明,构树中含有多种黄酮物质[12],这类次生代谢产物对植物抵御逆境具有重要的作用[14],且适度的干旱及盐胁迫有利于黄酮类成分的合成积累[11]。拟南芥Arabidopsis thaliana、杭菊Chrysanthemum morifolium、葡萄Vitis vinifera等植物积累黄酮抵抗环境胁迫[15]。然而,不同类型渗透胁迫下构树黄酮积累的程度尚未报道。
干旱胁迫和盐胁迫均不利于植物的生长,但构树能在一定程度上适应这些逆境,表明构树中存在着某种抗逆机制,能削弱干旱胁迫和盐胁迫的不利影响[2]。因此,本研究对构树幼苗进行干旱胁迫和盐胁迫处理,通过统计叶型、测定光合气体参数和黄酮含量以及分析叶片分布的分形维数,以期探究渗透胁迫对构树叶型分化以及叶片分布分形维数的影响。
1 材料与方法
1.1 试验材料
构树,1 年生实生苗,苗高23.00±5.00 cm,地径4.00±0.50 mm。采种于华南农业大学校园。供试基质为蛭石和沙子按照1 ∶1 体积比混合。
1.2 试验设计
采用盆栽方法,在华南农业大学板栗园温室大棚内进行。2020 年9 月12 日将1 年生构树实生苗移栽至口径21 cm×高16 cm 的塑料盆(底带托盘),每盆定植1 株,每盆加2.475 kg 供试基质。移栽入盆之后,保证每株苗的管理一致,缓苗期每株每2 天浇1 次100 mL Long Ashton 营养液[16],共浇20 次。缓苗期间保持盆土湿润。预实验发现土壤保持75%左右田间持水量为一般正常生长情况,1 年生构树苗能存活的最低田间持水量为20%左右。缓苗48 d 后(10 月30 日),选取生长状况相同的健康幼苗进行干旱胁迫和盐胁迫处理,盆栽构树苗共60 盆,分为对照组、盐胁迫处理和干旱胁迫处理3 组,每组重复20 盆。一组正常水分处理(75%田间持水量)即为对照组,每隔1 天傍晚通过称重法补足水分至75%田间持水量;二组干旱处理(20%田间持水量),每隔1 天傍晚通过称重法补足水分至20%田间持水量;3组盐胁迫处理(75%的田间持水量),每盆每隔1天浇100 mL100 mM NaCl 溶液,同时每隔1 天傍晚通过称重法补足水分至75%田间持水量,并将花盆托中的水溶液倒回盆中以防止处理盐分的流失;盐胁迫共处理10 次。2020 年12 月13 日进行摘叶处理。
于2021 年4 月21 日统计叶型(全缘、浅裂、深裂),拍照后统计并计算构树叶片分布分形维数,测定构树叶片的光合气体参数,最后从3 组处理里各取7 盆,每处理分开取成熟叶和老叶,分别杀青烘干粉碎后测总黄酮含量。试验在华南农业大学大学板栗园温室大棚内完成,试验地属海洋性亚热带季风气候,实验观测期间,正午有效光强180~360 μmol·m-2·s-1,光照时间12~14 h/d,广州年平均温度为22 ℃,相对湿度为50%~90%。
1.3 指标测定
1.3.1 光合气体参数的测定 用Li-6400 便携式光合仪(LI-COR,USA)测定各处理组的光合作用参数;每株选取植株顶端下数第3~5 片功能叶,在天气晴朗无云的上午9:00—11:00 时进行测定,每处理测定7~10 片叶,待其示数稳定后,每叶片连续手动测定4 个数值,取平均值;测定时用红蓝光源叶室(2 cm×3 cm),光强为600 μmol·m-2·s-1;测定:净光合速率(photosynthetic rate,Pn)、气孔导度(stomatal conductance,Gs)和胞间CO2浓度(intercellular CO2concentration,Ci)。
1.3.2 构树叶型的测定 建立构树叶片分型的等级指标(全缘叶、浅裂叶、深裂叶),统计3 组处理中每株各叶型叶片数量占比,每组处理统计10盆。其中,未裂到半个叶片1/2 宽度的为浅裂叶、裂到半个叶片1/2 宽度的为深裂叶。1.3.3 分形维数的测定 3 组处理每组拍摄7 株,相机固定拍摄高度,没有倾角,从正面水平拍摄和正上方垂直拍摄,分别记为正视图和俯视图,再用Photoshop 软件对每张图片进行处理,采用网格法对正视图和俯视图进行覆盖。即在图上确定一个正方形边框,将图片框在边框内,然后将正方形边框每边的边长2 等分,这时得到4 个小正方格子,记数此时覆盖到叶片分布的格子数,之后一直沿用此法划分、覆盖下去(每1 次都将上1 次形成的格子边长2 等分),能够分别得到每1 个格子边长时对应的非空格子数(覆盖到分枝结构的格子数);划分次数的确定是依据本实验研究对象划分为5 级;分枝格局的分形维数采用计盒维数(Box-counting dimension)公式进行计算;其中D为分形维数,N(ε)为边长为ε 时的非空格子数,ε 为对应的格子边长;在实际操作中,一般不求算当ε →0(格子边长趋于0 时的极限值,而是在双对数坐标下,对获得的一系列成对的非空格子数N(ε)和格子边长ε 值进行线性回归,所得拟合方程斜率的绝对值是分形维数的近似估计)[17]。
1.3.4 总黄酮含量的测定 采用代容春等的总黄酮提取以及分光光度法测定黄酮含量。即3 组处理,每处理随机取7 盆;每盆取成熟叶和老叶,从主脉处剪断;分别杀青烘干研磨后称重;取0.1 g 研磨后的叶片粉末(不足0.1 g 取最大量)装入15 mL 离心管中,按1:100 加入35%乙醇,80°C 水浴加超声波40 KHz 处理45 min,共2 次,期间摇匀1 次;放入制冰机中,静置沉淀,放置15 小时左右;取沉淀后的上清液0.1 mL 加入5 mL EP 管,加入0.9 mL35%乙醇,摇匀,加入5%NaNO2溶液60 μL,放置6 min;加入10% Al(NO3)3溶液60 μL,放置6 min;加入1 M NaOH溶液0.8 mL,摇匀,放置15 min 后取200 μL(做3 个平行重复)在510 nm 波长处测定吸光值。与此同时,建立芦丁标准曲线并计算总黄酮的含量[18]。
1.4 数据处理
使用SPSS 19(SPSS Inc., Chicago, IL, USA)进行统计分析,采用Duncan 检验法检测差异显著性,用Photoshop 软件统计非空格子数,Excel 进行曲线回归和制作叶型堆积图,使用SigmaPlot 14.0(Systat Software Inc, San Jose, CA, USA)绘 图。
2 结果分析
2.1 胁迫对构树叶片的胞间CO2 浓度、气孔导度、净光合速率的影响
干旱胁迫与盐胁迫都显著降低了构树叶片胞间CO2浓度、净光合速率与叶片气孔导度,其中叶片气孔导度变化量最大(图1)。相较于对照组,干旱胁迫与盐胁迫的构树叶片胞间CO2浓度、气孔导度和净光合速率分别显著下降了23.41%与41.16%、62.50% 与69.72%、16.43% 与17.60%,且两种胁迫处理间的差异并不显著。但是胞间二氧化碳浓度在3 个处理间均产生了显著性差异,其中盐胁迫处理较对照和干旱胁迫分别下降了29.16%和12.57%。

图1 3 组处理对构树叶片的胞间CO2 浓度、气孔导度和净光合速率的影响Fig. 1 Effects of three treatments on intercellular CO2 concentration, stomatal conductance and photosynthetic rate of B.papyrifera leaves
2.2 胁迫对构树3 种叶型数量的影响
干旱胁迫和盐胁迫对全缘叶和浅裂叶的数量占比无显著影响。两种胁迫使深裂叶的占比增加,其中盐胁迫较对照组和干旱胁迫的深裂叶数量占比显著增加(P<0.05),分别增加了58.96%和45.52%。但对照组和干旱胁迫间无显著差异(图2,表1)。
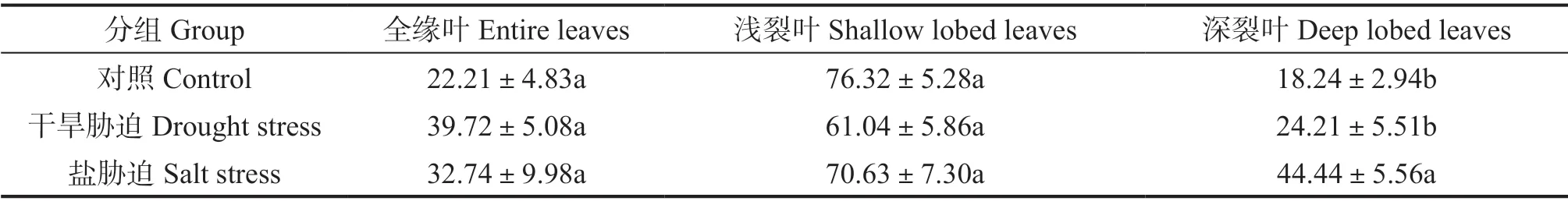
表1 3 种处理对构树的3 种叶型叶片数量占比 %Table 1 Effects of three treatments on B. papyrifera leaves’ quantity ratio of three leaf types
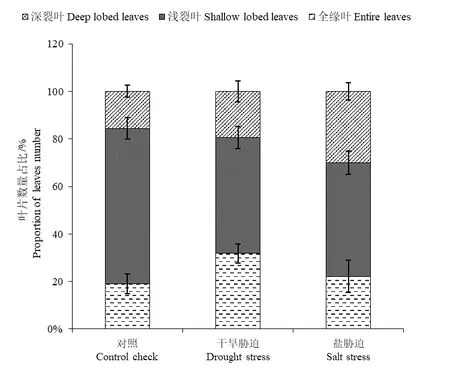
图2 不同处理下3 种叶型的构树叶片占比Fig. 2 The proportion of B. papyriferal leaves of three leaf types under three groups of treatments
2.3 胁迫对构树的分形维数的影响
在正视图中,干旱胁迫和盐胁迫显著增加了构树叶片的分形维数,较对照组分别提高了7.90%和11.58%。在俯视图中,盐胁迫处理组较对照组和干旱胁迫的分形维数增大,但没有显著差异。
2.4 胁迫对构树叶片中黄酮总含量的影响
在3 组处理中,干旱胁迫和盐胁迫均使构树成熟叶和老叶的黄酮总含量下降,各处理下老叶的黄酮含量均高于成熟叶,且在对照组中差异显著。对于老叶,盐胁迫的黄酮含量显著低于对照组和干旱胁迫的黄酮含量,分别降低了17.85%,11.46%。而在成熟叶中,长期干旱胁迫和盐胁迫处理均使叶片黄酮含量降低,但无显著差异。
3 讨论与结论

图3 干旱胁迫和盐胁迫对构树的分形维数的影响Fig. 3 Effects of drought stress and salt stress on fractal dimension of B. papyrifera
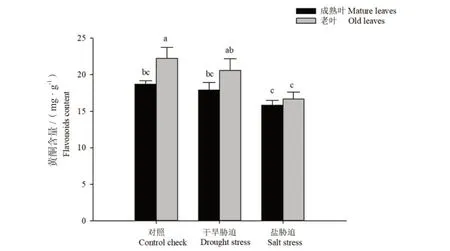
图4 干旱胁迫与盐胁迫对构树叶片内黄酮含量的影响Fig. 4 Effects of drought stress and salt stress on flavonoids content in B. papyrifera leaves
干旱胁迫和盐胁迫能显著降低植物叶片的净光合速率,导致植物生长受到抑制[19-20]。本研究表明干旱胁迫和盐胁迫显著降低了构树幼苗的净光合速率、气孔导度和胞间CO2浓度。这与多数干旱胁迫下植物光合作用的研究结果类似[21-22],其中叶片光合速率降低与气孔的部分关闭和叶肉细胞光合活性下降有关[23]。本研究中盐胁迫抑制了植物光合作用,这与闻志刚用0~300 mM 中7 个梯度的盐浓度处理发现构树叶片净光合速率均显著降低的研究结果一致[24],表明盐胁迫显著降低了构树幼苗的净光合速率、气孔导度和胞间CO2浓度。因此,推断盐胁迫可能影响气孔导度,从而使净光合速率降低。本研究中盐胁迫处理的土壤NaCl 含量为2.36 g/kg,所得结果与丁菲等[25]研究中构树幼苗的净光合速率在土壤NaCl 含量大于2 g/kg 时显著降低的结果一致。因此,本研究中的干旱胁迫和盐胁迫对构树造成了逆境胁迫,抑制了其光合作用。
在长期的进化中,植物为减轻干旱胁迫和盐胁迫等渗透胁迫的危害而进化出了一些保护机能[26]。植物为了适应环境胁迫也会做出相应的调节来减少水分散失,如比叶面积变小、叶片退化为针刺状等[27-28]。本研究表明,干旱胁迫和盐胁迫导致构树叶片深裂增多,盐胁迫更显著增加构树深裂叶比例。这与苟蓉等[29]的研究中提出构树减小叶面积和使浅裂叶片增多应对干旱胁迫略有不同,可能与空气湿度或光照强度等相关。同时,本研究也表明构树受到干旱胁迫和盐胁迫时,通过改变叶型、减小叶面积即增加浅裂叶和深裂叶的数量来适应环境的变化。
除了植物单个叶片发生叶型改变外,植物整体生长与叶片分布状况也会响应外部条件而发生适应性改变[30-31]。植物可以通过使叶片向上伸展或向下弯曲以调整位置,最大程度获取光能[32]。本研究结果表明,干旱胁迫和盐胁迫均使构树俯视图的分形维数较对照组有一定增加,而这两种胁迫均使构树正视图的分形维数显著增加。这表明干旱胁迫与盐胁迫均影响了构树茎干上叶片的形态或分布位置,并最终导致分形维数出现变化。分形维数数值可反映植物占据生态空间的能力,分形维数值高,植物占据生态空间的能力强[8]。颜扬杰等[33]针对红枫Acer palmatum‘Atropurpureum’的研究中发现红枫在向阳方向的分形维数普遍略大于背阳方向,其认为植物会在向阳方向上占据更多的空间区域以获得更多能量。结合两种渗透胁迫导致构树叶片光合速率降低以及叶片深裂变多,本研究结果推测构树通过提高自身占据空间的有效程度,即提高叶片分布的分形维数,来确保得到尽可能多的光能以适应渗透胁迫。
植物为响应逆境胁迫可以通过形态的改变,如叶型分化等提高获取和利用资源的能力[3],同时其内在也有相关抗逆的生理生化机制。植物面对环境胁迫会产生黄酮类物质,保护植物组织免受胁迫损伤[34-35],适度干旱胁迫与盐胁迫均能增加植株叶片中的黄酮含量[36-37]。而本研究中干旱胁迫的黄酮含量与对照组无显著差异,这可能与构树较强的抗逆性及其叶片成熟程度有关。本研究发现黄酮在老叶中含量均大于在成熟叶中含量,与枇杷Eriobotrya japonica叶中黄酮含量随叶片生长时间增加而递增类似[38]。此外,本研究还发现受到盐胁迫的构树老叶中的黄酮含量显著低于对照组的老叶,可见盐胁迫抑制了黄酮在老叶中的积累。植物在耐受逆境时会保护幼嫩组织,植物中的可移动资源包括部分水分、矿质元素、可溶性糖和可溶性蛋白等渗透调节物质会从老叶移动到嫩叶,以及光合作用的减缓等[39-40],同时加速老叶衰老死亡。结合本研究结果,盐胁迫减少黄酮在老叶中的积累,可能是为加快老叶衰老,将可循环代谢物传递给新生组织。结合以上的结果,构树可能是为减小盐胁迫对黄酮积累的抑制,通过增加占据空间的有效程度来适应渗透胁迫的土壤环境。
本研究中干旱胁迫和盐胁迫均降低了两年生构树幼苗叶片的气孔导度和胞间CO2,抑制构树的净光合作用(图5),从而阻碍构树生长。两年生构树幼苗为应对干旱胁迫和盐胁迫对其光合生理造成的损伤,其自身通过调整叶型和叶片生长分型来弥补光合缺陷,即表现为深裂叶增多,通过减小叶面积适应环境;叶片分布的正视图和俯视图的分形维数变大(图5),即构树叶片在水平面和垂直面的覆盖程度变大,以用有限的叶面积更充分地利用光进行光合作用。与此同时,盐胁迫显著降低了黄酮在构树幼苗老叶中的积累(图5),说明盐胁迫极大地损伤了构树幼苗的抗逆生理,这可能与盐胁迫显著增加叶片分布的分形维数来弥补生理保护有关。本研究的结果为干旱胁迫和盐胁迫下构树幼苗响应逆境的叶片分型和叶片分布的分形维数的变化提供一定借鉴,其内在机制还需通过更全面的叶片分型生理代谢通路来进行探究。
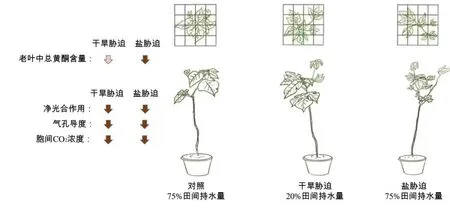
图5 干旱胁迫和盐胁迫对构树的光合气体参数、分形维数和黄酮含量的整体影响模拟Fig. 5 Overall impact simulation diagram of drought stress and salt stress on photosynthetic gas exchange parameters, fractal dimension, flavonoids content of B. papyrifera
