葡萄糖修饰苦杏仁粕谷蛋白糖基化反应条件的优化
2022-02-28张玥李芳李菊梅徐昕孔令明
张玥,李芳,李菊梅,徐昕,孔令明*
(1.新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052;2.新疆轻工职业技术学院,新疆 乌鲁木齐 830021)
苦杏仁是一种优良的药食两用资源,营养价值和经济利用价值丰富。我国苦杏仁产量丰富,年产量约为2万吨~3万吨,但是未充分发挥苦杏仁加工增值率优势。当前,我国杏仁产业大都以原料形式卖出,部分产品处于初加工,苦杏仁制油过程中产生的约50%的副产物杏仁粕未得到充分利用,造成了一定程度的浪费[1]。苦杏仁粕中含有25%左右的蛋白质,氨基酸种类齐全、易于人体消化吸收,可作为一种食用价值较高的植物蛋白资源[2]。目前,杏仁蛋白的研究主要集中在分离蛋白提取方法及功能特性的研究和杏仁蛋白酶解制备多肽工艺及酶解产物分离、纯化、药理药效方面。李大文[2]考察了超声波辅助盐溶法、微波辅助盐溶法和碱溶法对苦杏仁分离蛋白提取和功能特性的影响,结果表明,3种提取工艺各有优劣,就提取率的大小而言,碱溶法>超声波辅助法>微波辅助法,但物理辅助法提取时间短,提取效率高,且中性介质对蛋白质破坏小。解春艳等[3]对苦杏仁蛋白组成及蛋白的加工特性进行了研究,并对可溶性蛋白的提取条件进行了优化,得到杏仁蛋白的最佳提取工艺条件下,蛋白提取量最高可达43.79 mg/g。薛蕾[4]釆用风味蛋白酶与碱性蛋白酶对苦杏仁蛋白进行双酶组合水解,确定了最佳酶解工艺条件,并对酶解产物的体外抗氧化活性进行了测定。劳斐[5]利用杏仁粕中的蛋白质资源,采用酶解法制备出高活性的降血压肽。
杏仁蛋白具有优良的品质和风味,可广泛应用于食品工业中。天然的苦杏仁蛋白由于自身结构的局限,在某些功能性方面无法达到工业生产要求,开发利用程度较低,采用蛋白质修饰性改性技术对其功能特性的各个影响因素进行调节,使其具有良好的加工特性,获得功能性加强的产品,对扩大苦杏仁蛋白的应用领域、增强利用效果具有重要的现实意义。研究表明,苦杏仁蛋白在pH 4.0附近溶解度最小为12.79%;温度达到55℃时溶解度最大为65.2%[4]。蛋白质溶解性的大小在实际应用中非常重要,蛋白质的一些功能性质,如乳化、起泡、增稠等特性均与之相关。糖基化反应是将糖类物质与蛋白质以共价键连接,使得改性后的蛋白具备蛋白分子及糖分子的特性。经研究,对大豆蛋白[6-7]、花生蛋白[8]、肌原纤维蛋白[9]、玉米醇溶蛋白[10]、酪蛋白[11]等进行糖基化改性可有效改善蛋白质功能特性和营养性。
本试验将榨油后的饼粕进一步加以利用,以苦杏仁粕谷蛋白为原料,采用糖基化改性的方法对苦杏仁粕谷蛋白进行一定的改性处理,针对蛋白在食品加工中溶解性的功能特性需要,考察反应温度、反应时间、pH值、蛋白与糖质量比等不同因素对葡萄糖改性蛋白溶解度的影响,确定高溶解性葡萄糖改性蛋白最优制备条件,为后续苦杏仁粕谷蛋白-葡萄糖共价复合物的理化性质提供基础,以期提高苦杏仁蛋白的综合开发利用率,为苦杏仁精深加工、资源的循环利用提供有力支撑。
1 材料与方法
1.1 材料与试剂
苦杏仁粕谷蛋白(bitter apricot kernel meal gluten,AKG):新疆农业大学食品科学与药学学院农产品加工与综合利用研究室自制;大豆油:新疆友好集团股份有限公司。
葡萄糖、NaOH、HCl(均为分析纯):天津市致远化学试剂有限公司;邻苯二甲醛(o-phthaldialdehyde,OPA)(分析纯):上海高鸣化工有限公司;考马斯亮蓝G-250(分析纯)、20%十二烷基硫酸钠(sodium dodecyl sul fate,SDS)溶剂(生化试剂):北京索来宝科技有限公司;2-巯基乙醇(生化试剂):北京津同乐泰化工产品有限公司。
1.2 仪器与设备
Testo205便携式数显pH计:德图仪表(深圳)有限公司;DZKW-S-6电热恒温水浴锅:北京市永光明医疗仪器有限公司;TDL-5-A低速离心机:上海安亭科学仪器厂;TU-1810PC紫外可见分光光度计:北京普析通用仪器有限责任公司;ALPHA 1-2型真空冷冻干燥机:德国Marin Christ公司。
1.3 试验方法
1.3.1 苦杏仁粕谷蛋白-葡萄糖共价复合物的制备
准确称取一定量AKG置于去离子水中,配制蛋白质量分数为1%,室温25℃下搅拌1 h,用1 mol/L HCl或NaOH调节至不同pH值,加入一定量的葡萄糖,于不同反应温度下恒温反应一段时间,反应过程中不断搅拌,反应结束后冰浴冷却至室温25℃,4 500 r/min离心15 min除去不溶物,上清液透析24 h,冷冻干燥后制得苦杏仁粕谷蛋白-葡萄糖共价复合物,即葡萄糖改性蛋白(glucose modified protein,GMP)[12]。
1.3.2 溶解度的测定
根据HORAX法[13]稍作改动。配制1%的AKG、GMP,室温 25℃下磁力搅拌 20 min~30 min,4500 r/min离心15 min,留取上清液;取空试管,加入上清液和考马斯G-250,混匀;放置10 min,在波长595 nm处测量。对照组加入去离子水和考马斯G-250。溶解度为上清液中蛋白质含量(m1)与样品中蛋白质含量(m0)的比值,其计算公式如下。
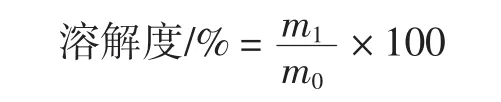
式中:m0为样品中蛋白质含量,mg/g;m1为上清液中蛋白质含量,mg/g。
1.3.3 单因素试验
1.3.3.1 不同反应温度对葡萄糖改性蛋白溶解度的影响
固定蛋白质量分数1%,在反应时间2 h、pH 9.0、蛋白与糖质量比1∶2的条件下,选择反应温度30、40、50、60、70、80、90、100 ℃,进行单因素试验,考察不同反应温度对GMP溶解度的影响。
1.3.3.2 不同反应时间对葡萄糖改性蛋白溶解度的影响
固定蛋白质量分数1%,在反应温度90℃、pH 9.0、蛋白与糖质量比1∶2的条件下,选择反应时间0、0.5、1.0、2.0、3.0、4.0、5.0、6.0 h,进行单因素试验,考察不同反应时间对GMP溶解度的影响。
1.3.3.3 不同pH值对葡萄糖改性蛋白溶解度的影响
固定蛋白质量分数1%,在反应温度90℃、反应时间2 h、蛋白与糖质量比1∶2的条件下,选择pH值为6.0、7.0、8.0、9.0、10.0、11.0,进行单因素试验,考察 pH值对GMP溶解度的影响。
1.3.3.4 不同蛋白与糖质量比对葡萄糖改性蛋白溶解度的影响
固定蛋白质量分数1%,在反应温度90℃、反应时间2 h、pH 9.0的条件下,选择蛋白与糖质量比为4∶1、3∶1、2∶1、1∶1、1∶2、1∶3、1∶4,进行单因素试验,考察不同蛋白与糖质量比对GMP溶解度的影响。
1.3.4 接枝度测定
参考管军军[14]OPA试剂改进法测定接枝度(degree of grafting,DG)。接枝度计算公式如下。
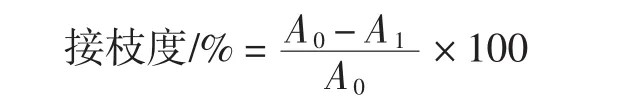
式中:A0为接枝反应前溶液吸光度;A1为接枝反应后溶液吸光度。
1.3.5 褐变程度的测定
用0.1%SDS溶液作为溶剂,稀释样液,磁力搅拌20 min,在波长420 nm下测定吸光度A420[15];以0.1%SDS溶液做空白对照组。
1.4 响应面分析试验的建立
响应面试验因素与水平见表1。
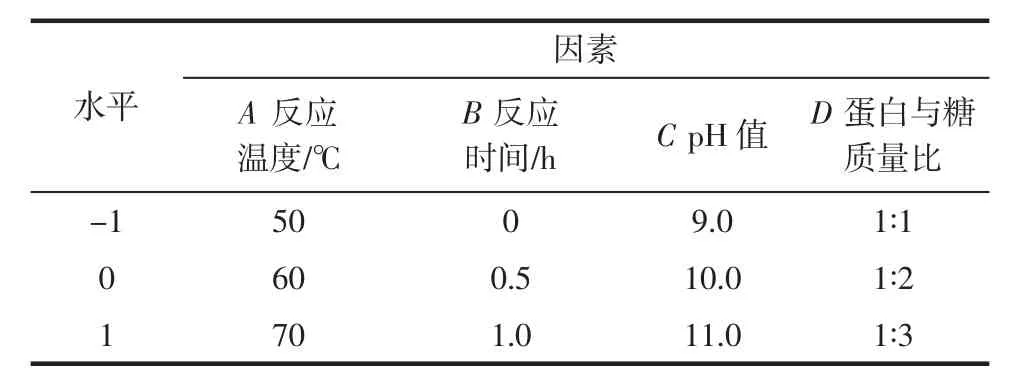
表1 因素与水平Table 1 Factors and levels
1.5 数据处理
采用OriginPro软件进行制图及Design Expert软件和Box-Behnken试验方法设计响应面优化分析。利用SPSS 21.0软件进行显著性分析。每个样品处理均作3个平行。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 不同反应温度对葡萄糖改性蛋白溶解度的影响
不同反应温度对葡萄糖改性蛋白溶解度的影响见图1。
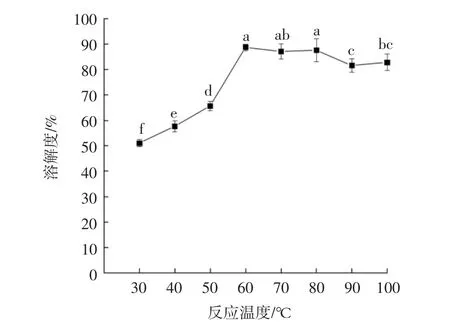
图1 反应温度对葡萄糖改性蛋白溶解度的影响Fig.1 Effect of reaction temperature on the solubility of GMP
如图1所示,随着温度的升高,产物的溶解度呈先升高后降低的趋势,GMP的溶解度在60℃时达到最大值为88.77%。这表明溶液中蛋白质在热处理作用下,蛋白分子发生伸展,构象发生轻微改变,引入糖链,糖基化反应速度加快,产物溶解性增大。有研究表明,适度的热处理可提高蛋白的溶解度,有利于蛋白质和水分子的相互作用,对苦杏仁粕谷蛋白的溶解性起到促进作用[16]。温度过高部分蛋白质变性,蛋白质分子内部疏水基团暴露,粒子重新聚集,使得蛋白结合水的能力降低,导致溶解度下降[17]。因此,选择温度50、60、70℃进行响应面优化分析。
2.1.2 不同反应时间对葡萄糖改性蛋白溶解度的影响
不同反应时间对葡萄糖改性蛋白溶解度的影响结果见图2。

图2 反应时间对葡萄糖改性蛋白溶解度的影响Fig.2 Effect of reaction time on the solubility of GMP
由图2可知,GMP的溶解度在糖基化反应0.5 h时有最高值为91.15%。此后溶解度随着反应时间的延长呈现下降趋势。反应时间过长,使原本断裂的肽键重新聚合,蛋白的疏水基团增多,美拉德反应逐渐进入高级阶段,形成了不溶于水的大分子聚合物,导致产物溶解度下降,这与王鲁慧等[18]研究结果一致。另外,延长时间并不能提高葡萄糖改性蛋白的溶解度,也表明糖基化中的化学反应均处于变化初期。因此,选择反应时间为0、0.5、1.0 h进行响应面优化分析。
2.1.3 不同pH值对葡萄糖改性蛋白溶解度的影响
不同pH值对葡萄糖改性蛋白溶解度的影响结果见图3。
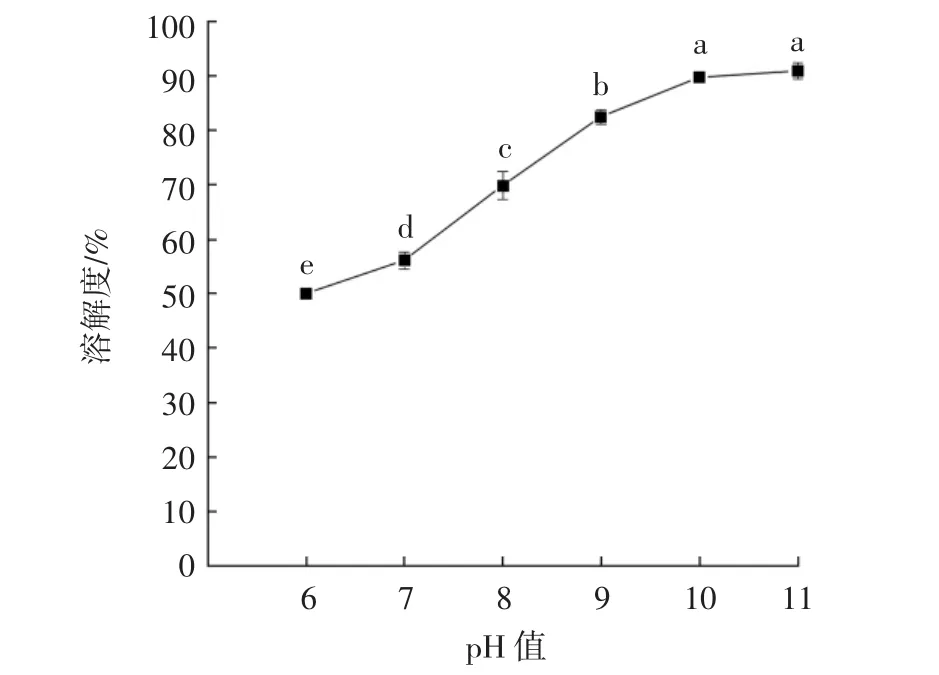
图3 pH值对葡萄糖改性蛋白溶解度的影响Fig.3 Effect of pH on the solubility of GMP
由图3可知,随着pH值的增大,葡萄糖改性蛋白的溶解度呈现先上升趋势,pH值为6.0~10.0时,溶解度显著上升(P<0.05),pH 值在 10.0~11.0 趋于平缓,差异不显著(P>0.05)。一方面与蛋白质自身性相关[19],蛋白质偏离等电点的酸性或碱性条件下,体系中电荷的增加,有利于蛋白分子与水分子间作用,溶解性呈现逐渐增大趋势[20];另一方面这是由于pH值的增大,引入了更多的糖链,可溶性蛋白随着反应进程更易与葡萄糖共价结合,从而使得亲水性基团不断增加[6]。因此选择pH值9.0、10.0、11.0进行响应面优化分析。
2.1.4 不同蛋白与糖质量比对葡萄糖改性蛋白溶解度的影响
不同蛋白与糖质量比对葡萄糖改性蛋白溶解度的影响结果见图4。
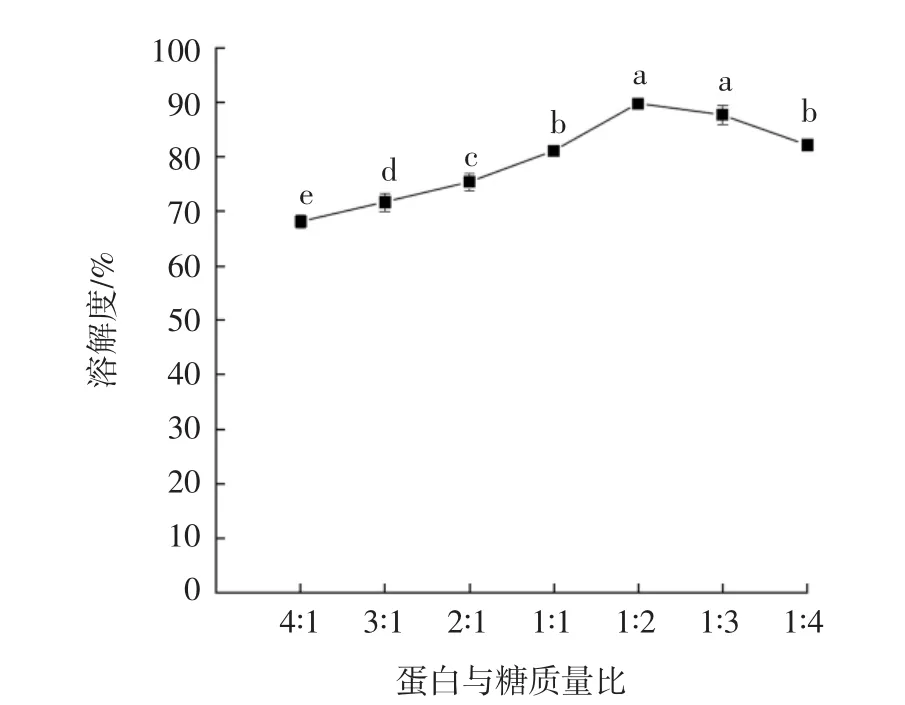
图4 蛋白与糖质量比对葡萄糖改性蛋白溶解度的影响Fig.4 Effect of protein-sugar mass ratio on solubility of GMP
由图4可知,蛋白与糖质量比为1∶2时,GMP的溶解度最高为89.79%,此后溶解度随着糖添加比例的改变呈现出小幅度下降,这可能是因为蛋白添加量变小,而糖化剂添加量较多,使得溶液有一定黏度,具有稠厚感,不利于糖基化反应的发生,从而导致溶解度的下降[21]。这与王祺[22]的研究结果一致。TANG等[23]对豌豆球蛋白改性研究也表明不同蛋白与糖质量比及反应时间会不同程度地影响改性后蛋白溶解性。因此选择蛋白与糖质量比为 1∶1、1∶2、1∶3 进行响应面优化分析。
2.2 响应面试验结果分析
2.2.1 响应面试验模型建立
响应面结果见表2,回归方程方差分析结果见表3。
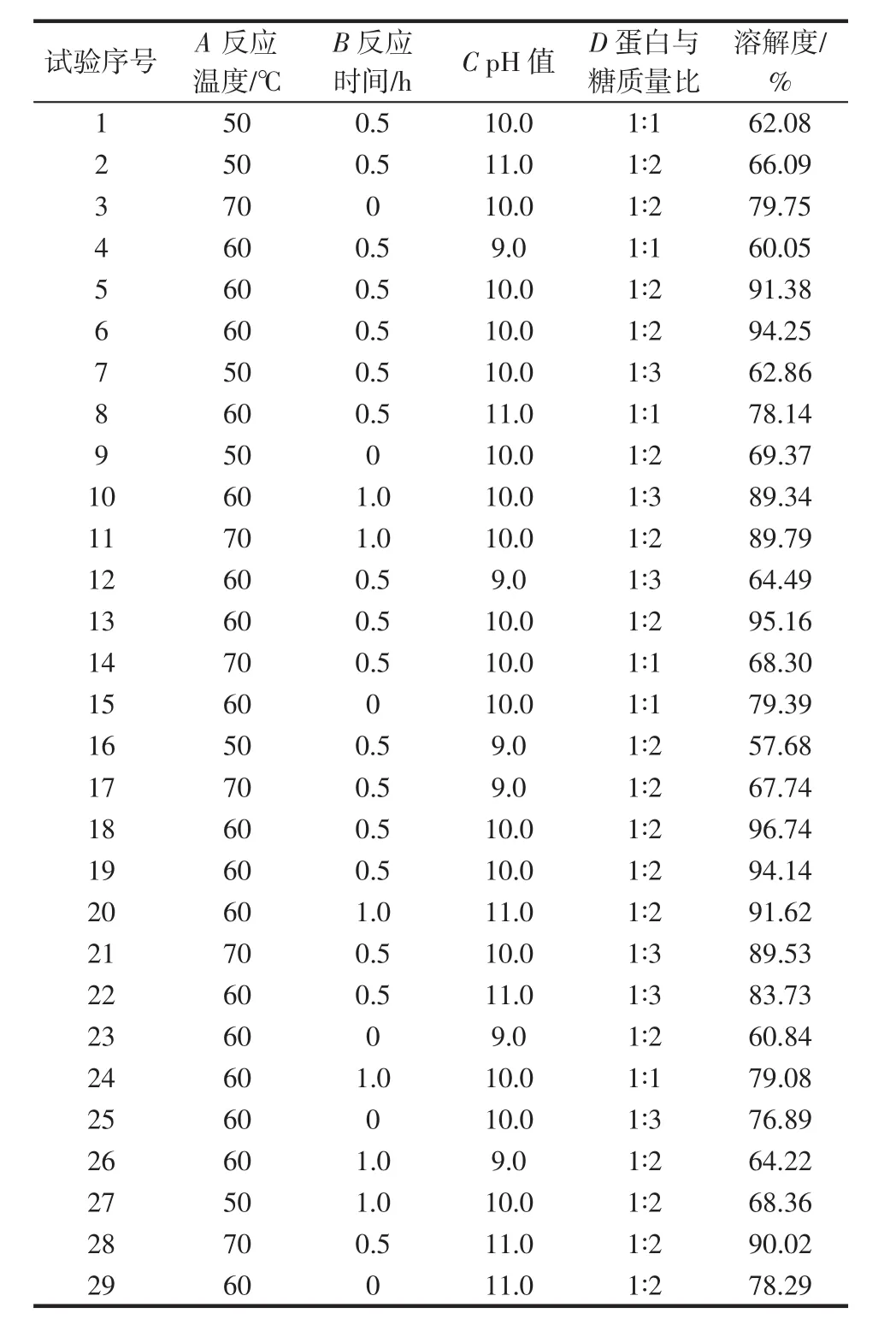
表2 响应面试验方案及结果Table 2 Design of response surface test scheme and results
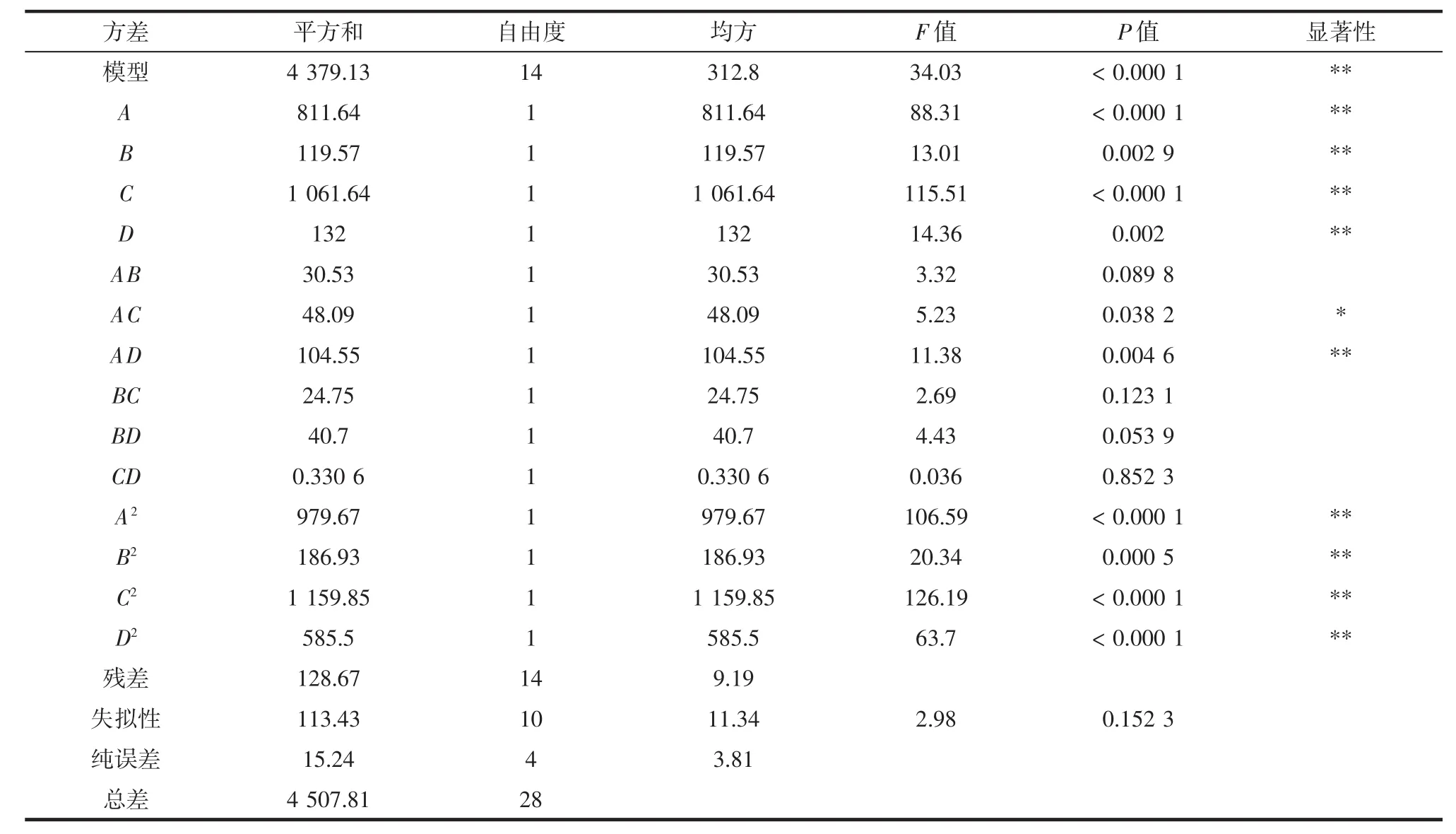
表3 响应面回归方程方差分析结果Table 3 Results of variance analysis of response surface regression equation
回归方程为Y=94.33+8.22A+3.16B+9.41C+3.32D+2.76AB+3.47AC+5.11AD+2.49BC+3.19BD+0.2875CD-12.29A2-5.37B2-13.37C2-9.50D2。
由表 3 可知,该模型 P<0.000 1,R2=0.971 5,说明该模型具有高度的显著性,方程的可行性较好,失拟项不显著(P=0.1523),说明了回归模型和实际试验拟合充分,具备可行性且精确度高,可以用该模型对葡萄糖改性蛋白的制备进行分析预测。反应温度、反应时间、pH值、蛋白与糖质量比4个因素对响应值的影响显著性可用F值来评价,由表3可知,各因素对葡萄糖改性蛋白的溶解度影响顺序为pH值>反应温度>蛋白与糖质量比>反应时间,pH值、反应温度、反应时间、蛋白与糖质量比对葡萄糖改性蛋白的溶解度影响为极显著(P<0.01)。
2.2.2 响应面分析与优化
影响葡萄糖改性蛋白溶解度的各个因素之间的交互作用图见图5~图8。
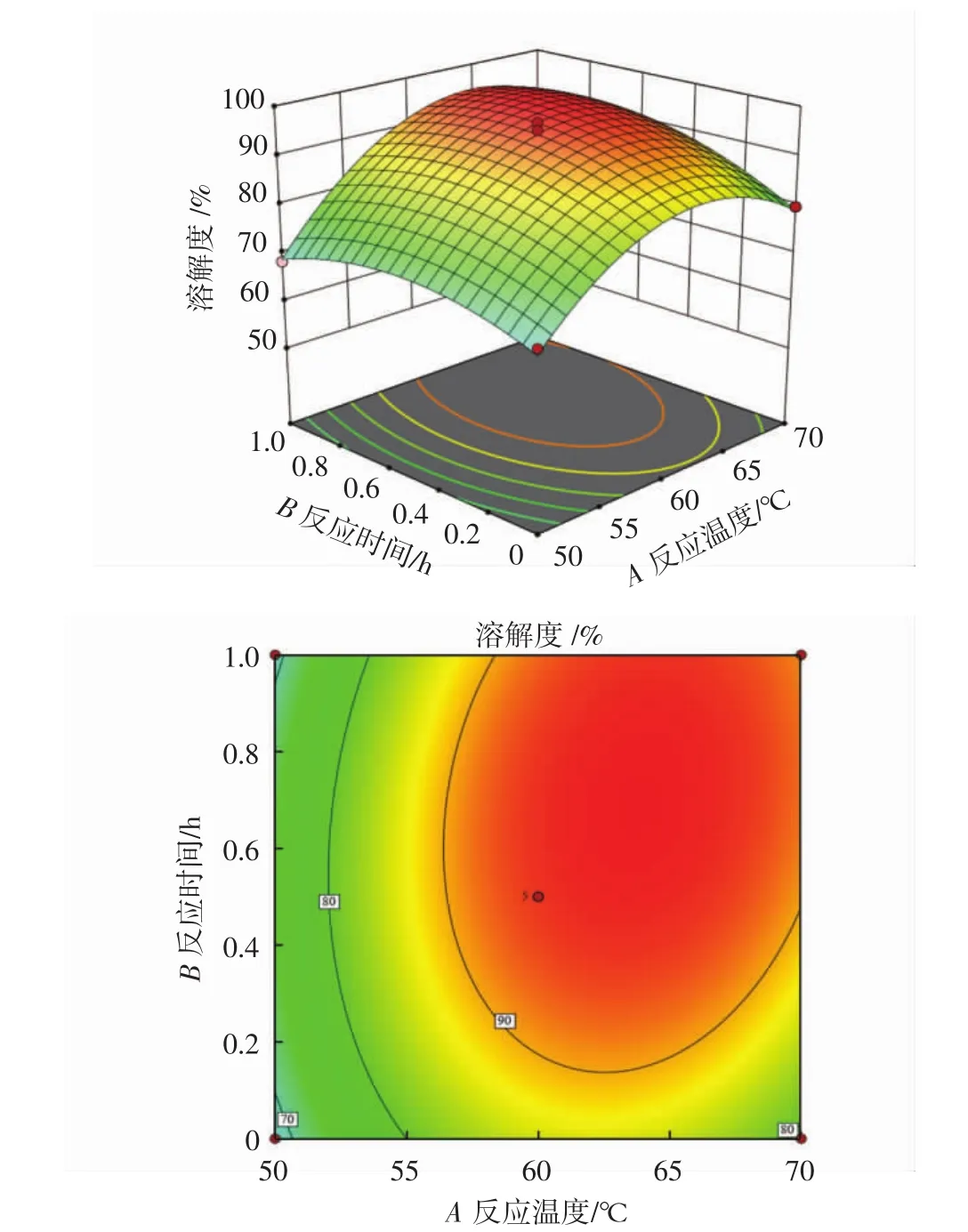
图5 反应温度和反应时间对溶解度影响的响应面和等高线Fig.5 Response surface and contour plots of the effect of reaction temperature and reaction time on solubility
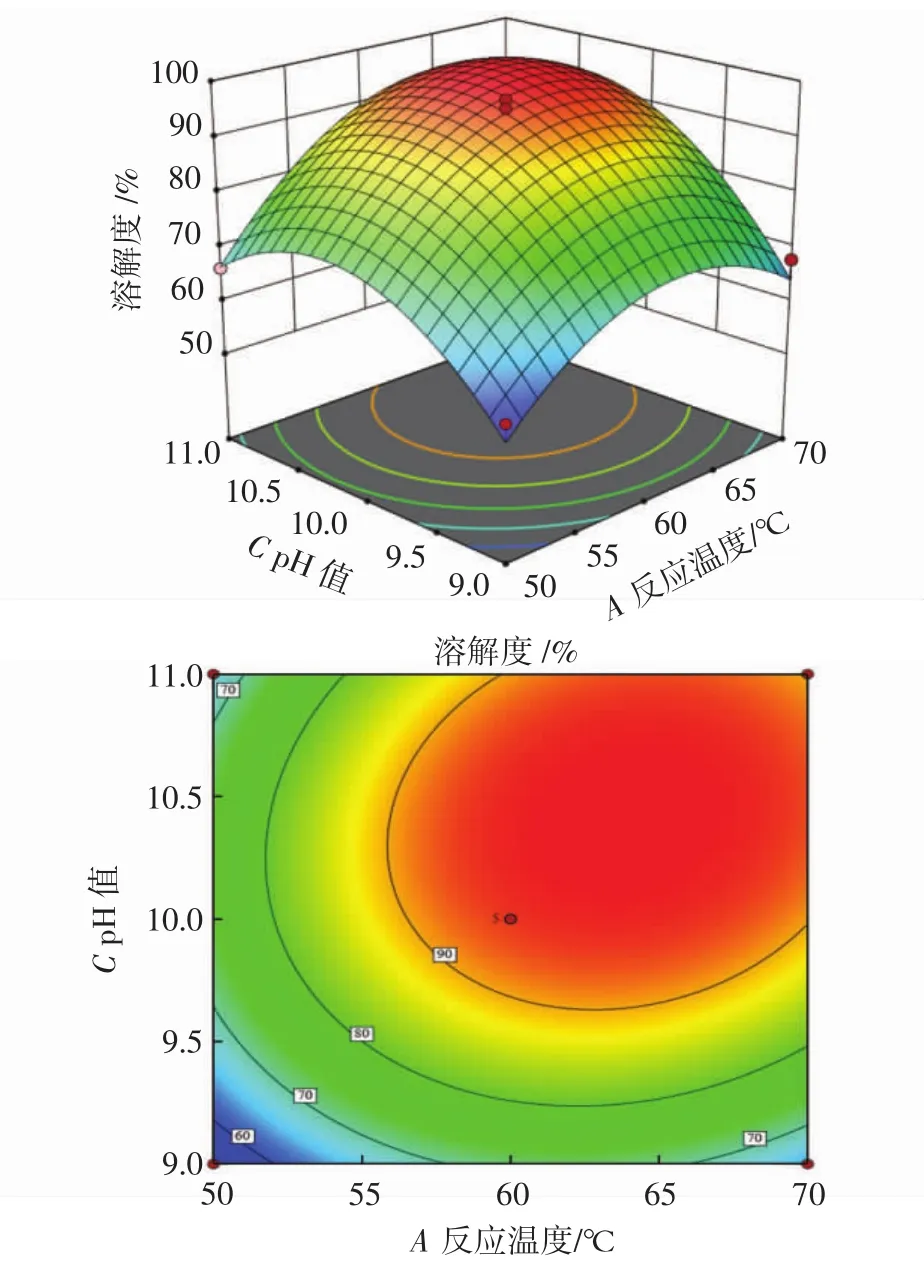
图6 反应温度和pH值对溶解度影响的响应面和等高线Fig.6 Response surface and contour plots of the effect of reaction temperature and pH on solubility

图7 反应时间和pH值对溶解度影响的响应面和等高线Fig.7 Response surface and contour plots of the effect of reaction time and pH on solubility

图8 反应时间和蛋白与糖质量比对溶解度影响的响应面和等高线Fig.8 Response surface and contour plots of the effect of reaction time and protein-sugar mass ratio on solubility
结合表3和图5可知,在响应组合试验中,一次项A(反应温度)、B(反应时间)和二次项 A2、B2差异为极显著(P<0.01),对GMP的溶解度的影响大。A(反应温度)的曲面的弯曲程度较B(反应时间)高。二维等高线的椭圆状不明显,交互项AB(反应温度-反应时间)不显著(P>0.05)。
结合表3和图6可知,一次项A(反应温度)和C(pH值)的响应面坡度较陡,差异极显著(P<0.01)。AC(反应温度-pH值)影响因素差异显著(P<0.05),因素之间交互作用显著,交互作用对溶解度影响较大。
结合表3和图7分析可知,一次项C(pH值)和二次项C2曲面效应极显著(P<0.01),交互项BC(反应时间-pH值)不显著(P>0.05),且等高线的形状趋近圆形,对糖基化改性蛋白溶解度影响不大。
结合表3和图8分析可知,一次项D(蛋白与糖质量比)和二次项D2因素差异为极显著(P<0.01),交互项BD(反应时间-蛋白与糖质量比)不显著(P>0.05)。各因素对GMP溶解度的影响不是一个简单的线性关系。响应面坡度越陡,响应值对各因素变化越强。反之坡度越平缓,影响越小。
2.2.3 最佳条件的确定及验证试验
该模型得到最优工艺为反应温度63.21℃、反应时间0.61 h、pH 9.39、蛋白与糖质量比1∶2。在此条件下葡萄糖修饰苦杏仁粕谷蛋白制备葡萄糖改性蛋白的溶解度为98.69%。考虑到实际操作,将实际试验条件调整为反应温度63℃、反应时间0.6 h、pH 9.40,蛋白与糖质量比1∶2、进行3次重复试验,取平均值得到溶解度为96.24%,与模型相符,则模型可以较好地预测葡萄糖改性蛋白的制备。
2.3 接枝度与褐变度的测定
接枝度与褐变度的测定结果见表4。

表4 葡萄糖改性蛋白的接枝度与褐变度Table 4 Grafting degree and browning degree of GMP
糖基化反应是碳水化合物以共价键与蛋白质分子上的游离氨基连接而形成糖蛋白的化学反应,又称美拉德反应。接枝度是通过自由氨基的含量来表现美拉德反应程度。由表4可知,在最优工艺下GMP的接枝度为33.03%。美拉德反应会有褐色产物产生,褐变度是通过呈色物质吸光度的变化来表现美拉德反应的高级产物的形成程度。GMP的褐变度为0.235。反应结果与张玥等[24]研究结果相似,说明糖基化反应较为充分。
3 结论
本研究以苦杏仁粕谷蛋白为原料,采用糖基化方法对影响蛋白质溶解特性的各个因素进行调节,以期提高其在溶液中的分散性,增强蛋白质与水的相互作用,使其具有良好的加工特性,从而能够广泛应用于食品体系。试验分析了不同因素对苦杏仁粕谷蛋白-葡萄糖共价复合物溶解度的影响。优化后的最佳工艺参数为反应温度63℃、反应时间0.6 h、pH 9.4、蛋白与糖质量比1∶2。在此条件下,GMP溶解度为96.24%。最优糖基化改性产物的制备条件为后续苦杏仁粕谷蛋白理化特性和功能活性的研究提供了基础。