光学成像技术活体评价PAEs促皮损愈合的药效
2022-02-28李俐霜孙娅楠糜志远
陈 思,李俐霜,王 毅,孙娅楠,糜志远
(1 湖北工业大学生物工程与食品学院,湖北 武汉 430068;2 中国中医科学院医学实验中心,北京 100700)
皮肤是脊椎动物全身最大的器官,是保护各种组织和器官免受物理、机械、化学和病原微生物侵害的第一道防线[1-2]。皮肤创伤愈合是一个动态的过程,涉及一系列复杂的生物过程[3],包括防止炎症的产生、细胞的增殖与分化、血管系统的重塑与恢复和结缔组织的形成,对伤口愈合都具有重要意义[4-5]。皮肤由表皮层、真皮层、皮下组织构成,真皮层位于表皮层下方,是构成皮肤的主体。真皮层是致密的结缔组织,有许多弹力纤维和胶原纤维,故具有弹性和韧性;有丰富的血管和神经,故能感受外界刺激[6]。因此,创面愈合过程中胶原纤维的变化与血管及其他附属器官的重建直接影响了创面愈合后的皮肤屏障功能,所以活体评估创面部位的病理变化,可为临床用药和治疗提供指导。
鹿茸是迄今为止所发现的唯一一个具有完全再生能力的哺乳动物附属器官[7],可在90~120 d内完成血管、神经、表皮等组织的分化、发育到成熟的全过程[8]。鹿茸中存在表皮生长因子[9],可以推测其含有一些有效活性成分,具有很强的促进皮肤创伤愈合的能力。
本实验通过利用双光子激发荧光(Two-Photon Excitation Fluorescence,TPEF)成像、二次谐波(Second Harmonic Generation,SHG)成像与毛细血管镜系统活体评估鹿茸蛋白粗提物(Pilose Antler Extract,PAEs)给药后创面组织表皮厚度、真皮层胶原纤维的含量情况及毛细血管的构建情况,建立一种基于光学成像技术活体评价皮肤愈合过程的实验方法,为研究药物促愈合过程提供新的研究思路与研究方法;并以PAEs为代表药物应用该方法评价其促进创伤愈合的药效作用。
1 材料
1.1 试验动物
SD大鼠,15只,雄性,体重(150±10)g,由北京维通利华实验动物技术有限公司提供,动物许可证号为SCXK(京)2016-0006。将其饲养于12 h光照/12 h黑暗的环境中,自由摄食和饮水。
1.2 仪器与试剂
鹿茸来源为吉林云鹿集团,为鹿茸上段。
氨基酸标品(Aglient);HPLC-MS/MS系统(Sciex);BCA蛋白含量测定试剂盒(Thermo,23227);蛋白marker(Thermo,26619);重组人表皮生长因子(易孚,国药准字S20020112);SDS-PAGE电泳预制胶试剂盒(索莱宝,P1200);凝胶成像仪(BIO-RAD,733BR2310);电泳仪(BIO-RAD,MP Tetra);酶标仪(Bio-Rad, PR4100);双光子扫描显微镜(Olympus,FV1000MPE);CapiScope毛细血管镜系统(KK Technology,CAM1CVF)。
2 方法
2.1 鹿茸水溶性蛋白粗提取
2.1.1鹿茸水溶性蛋白粗提取按照本实验室前期提取工作进行提取[9],得到PAEs。
2.1.2PAEs蛋白成分分析按照Thermo公司BCA蛋白含量测定试剂盒的要求测定蛋白含量。
PAEs采用10%的分离胶,5%浓缩胶进行SDS-PAGE凝胶电泳。利用SDS-PAGE进行分离,电泳结束后,经考马斯亮蓝染色后,白光下观察蛋白条带,与蛋白质量标准条带的相对位置确定蛋白分子量分布范围。
PAEs交由华大基因有限公司进行蛋白质鉴定。
2.1.3PAEs游离氨基酸成分分析
1)色谱条件 PFP色谱柱(2.1 mm×100 mm,1.8 μm,Waters);流动相为A(水,含0.1%甲酸)∶B(甲醇),梯度洗脱程序:0~6.0 min,5%~95% B;6.0~8.0 min,95% B~95%B;8.0~8.01 min,95% B~5%B;8.01~10.0 min,5% B~5% B。流速为0.2 mL·min-1;柱温为35℃;样品室温度为6 ℃;进样量为1 μL。
2)质谱条件 电喷雾离子源(ESI),气帘气(N2)为276 kPa,碰撞气(N2)为9×6.895kPa,喷雾电压为+5500.00 V,雾化温度为550.00 °C,雾化气(Ion Source Gas1, N2)和辅助气(Ion Source Gas2, N2)均为55.00×6.895 kPa。采用多反应监测(MRM)模式正离子扫描。
2.2 动物实验
2.2.1模型建立异氟烷气麻大鼠,用脱毛膏脱去背部区域毛发,温水擦干。手术区域局部消毒后,于大鼠背部脊柱两侧旁开1 cm处减去一块直径1.4 cm,创面面积1.54 cm2的圆形。全层切除皮肤,开放创面,深达肌层,充分止血,单笼饲养。做好标记。
2.2.2分组给药15只大鼠随机分为阳性药(rh-EGF)组,鹿茸蛋白(PAEs-H/M/L)高、中、低剂量组,模型组(Konjac gum)等5组,每组3只。每只实验动物左侧创口外敷生理盐水;依据前期实验结果PAEs水溶后混合魔芋胶制成水凝胶外敷:低剂量组(2 mg/mL)PAEs,中剂量组(4 mg/mL)PAEs,高剂量组(8 mg/mL)外敷100 μL;阳性药组用生理盐水配成浓度为 7IU/μL的溶液外敷100 μL。待吸收后,将大鼠置于清洁笼内单笼饲养,自由食水,每天用药。
2.2.3创面愈合情况测定造模首次敷药10 d后用游标卡尺分别测量未愈合创面的纵径和横径,计算创面愈合率。创面愈合率=(原始创面面积-残余创面面积)/原始创面面积×100%。
2.2.4创面TPEF成像扫描将用异氟烷气麻后的大鼠固定于双光子显微镜载物台上,采用数值孔径为1.05的25倍水浸显微物镜对表皮组织进行Z轴扫描。采用激射波长750 nm,步进2 μm,图像采集像素512×512 pixel,采集速度4 μm/pixel。
2.2.5创面皮肤病理染色给药10 d后进行大鼠皮肤活组织取材。取创面及皮肤周围的全层及皮下组织,将皮肤组织置于4%多聚甲醛中固定48 h,常规组织修块、脱水、透明、石蜡包埋后,制成4 μm组织切片后行常规HE染色,光镜观察创面组织结构改变。
2.2.6创面SHG信号采集将用异氟烷气麻后的大鼠固定于双光子显微镜载物台上,采用数值孔径为1.05的25倍水浸显微物镜收集创面皮肤SHG信号,分色镜690 nm,激射波长950 nm,滤光片475 nm/10nm(中心波长/带宽),对创面皮肤进行纵向扫描,步进2 μm,图像采集像素512×512 pixel,采集速度4 μm/pixel。
2.2.7创面毛细血管数据采集将麻醉后的大鼠固定于毛细血管镜系统下,记录创面部位新生的毛细血管及毛囊的生长情况。
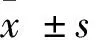
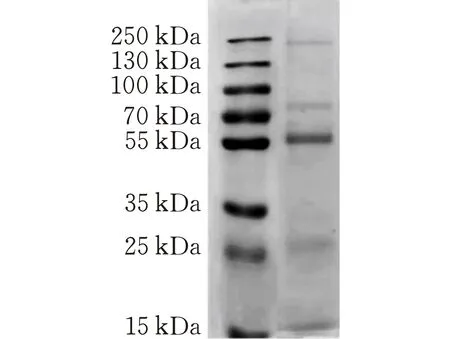
图 1 鹿茸蛋白电泳图
3 实验结果
3.1 PAEs总蛋白含量测定及蛋白成分测定
使用BCA法蛋白含量测定试剂盒测得的OD值均在标准曲线y= 0.9431x+ 0.198上(R2=0.9965),计算得出蛋白含量为61.29%。由SDS-PAGE蛋白电泳图(图1)可以得出鹿茸蛋白广泛分布于55~250 kD 之间,且多为大分子蛋白。通过PAEs蛋白质鉴定分析共鉴定出135种蛋白。其中,Kelch-like protein 20促进肌动蛋白聚合和高尔基体后转运,在血管生成过程中作为内皮细胞迁移的调节剂。
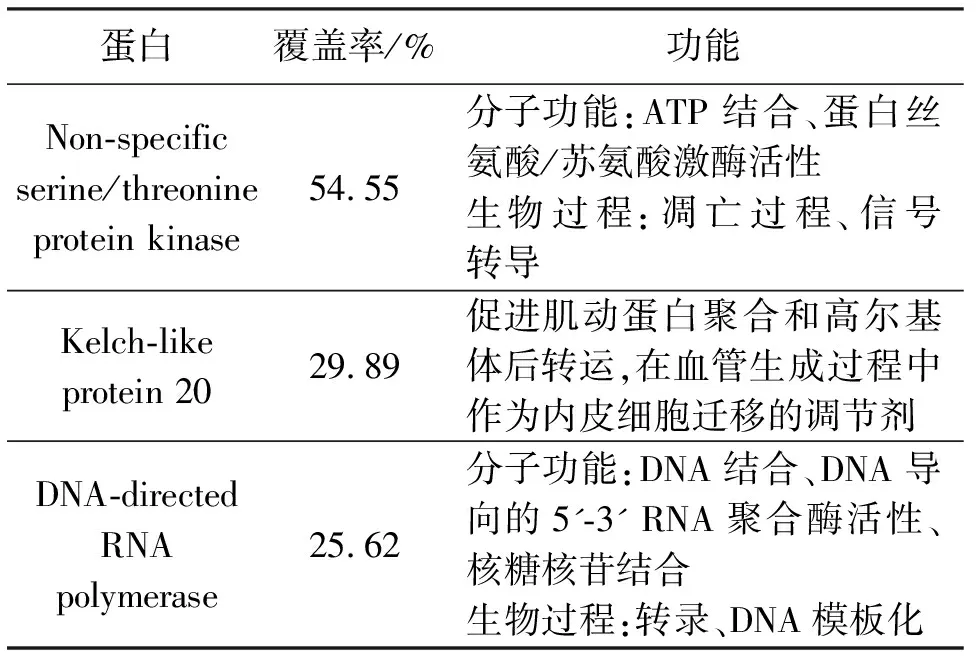
表1 PAEs中主要蛋白质
3.2 PAE成分分析
由图2可知,确定了PAEs中的18种游离氨基酸。其中Glycine、Leucine、Alanine含量最高,为生物体内组成蛋白质的主要氨基酸。另外,还检测出了Proline、Hydroxyproline等组成动物胶原蛋白的重要成分。由表2可知,18种游离氨基酸大多在生物体内的蛋白质代谢过程中处于重要地位,参与许多重要化学反应,主要功能为促进身体正常生长,修复组织、肌肉,并给身体组织提供能量。
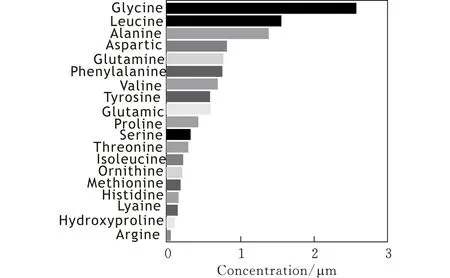
图 2 PAEs中游离氨基酸含量

表2 主要氨基酸功能
3.3 创面愈合情况测定
给药10 d后,对大鼠创伤部位进行拍照,观察创面愈合情况(图3a)。实验结果表明,在未给予PAEs时创面缓慢愈合,模型组左(N.S)、右(Konjac gum)无显著性差异,表明药物所用基质魔芋胶及生理盐水不具有促进伤口愈合的作用,造模成功(图3b);由图3c可见,造模后1 d各给药组均具有促进伤口愈合的作用,但创面愈合率无显著性差异;给药10 d,PAEs中高剂量组及rh-EGF组创面愈合率显著高于空白对照组(p<0.05)。
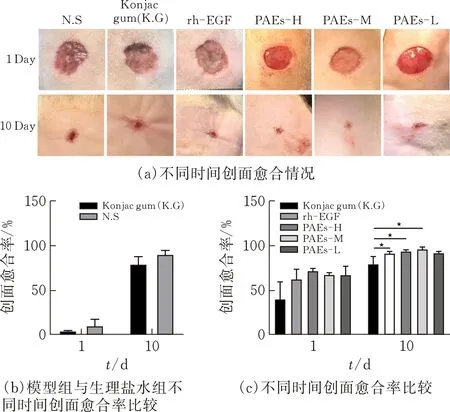
图 3 PAEs促创面愈合情况
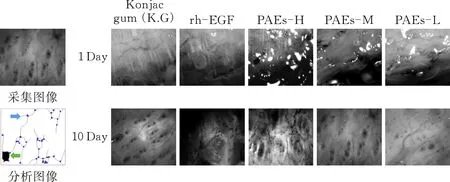
3.4 创面TEPF成像
通过TPEF成像技术对大鼠新生皮肤边缘表皮厚度进行检测。结果表明,在10 d,与模型组比较,PAEs-H/M组大鼠表皮厚度明显增加(p<0.05)(图4c)。
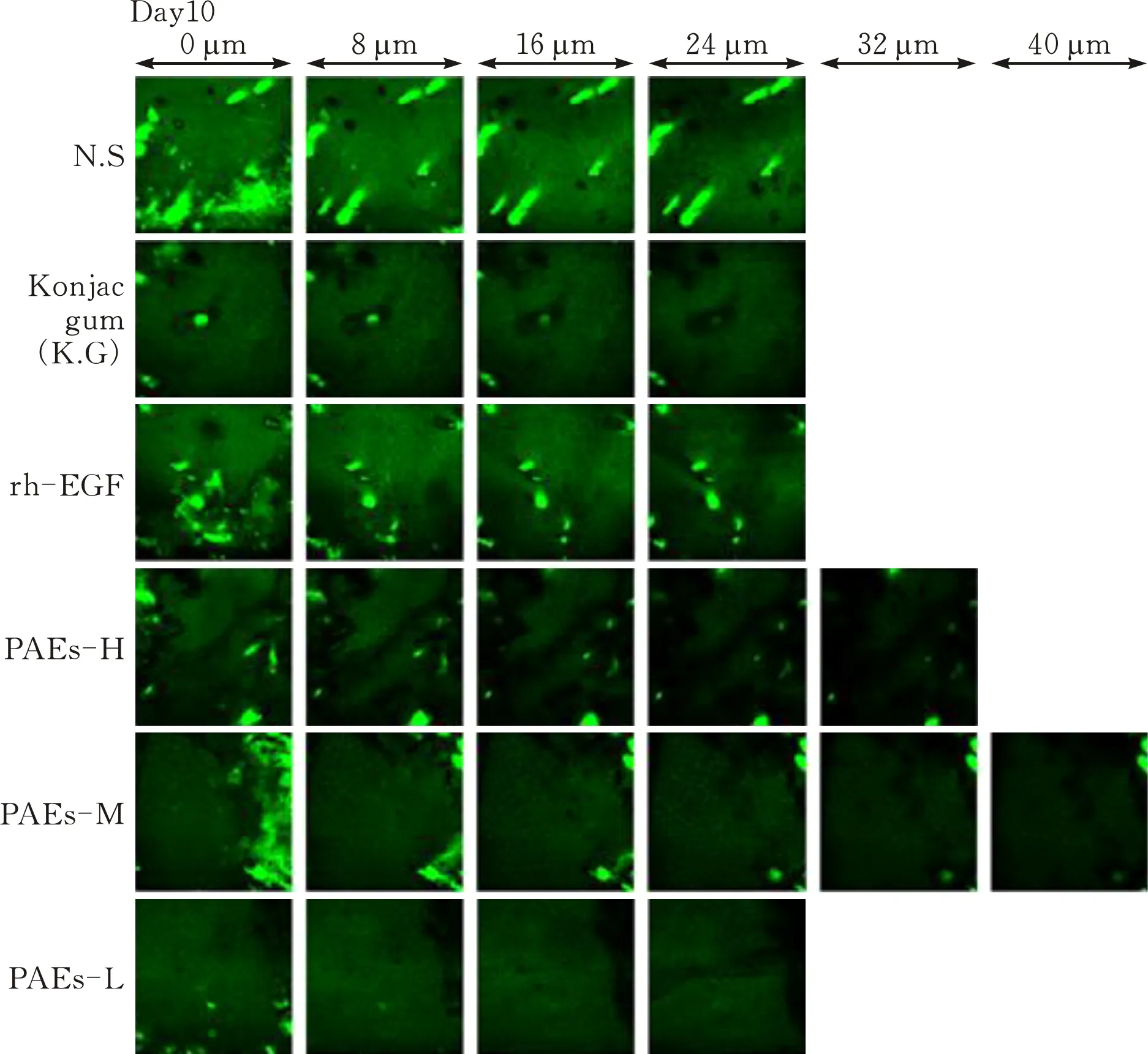
(a)大鼠创面皮肤TEPE成像
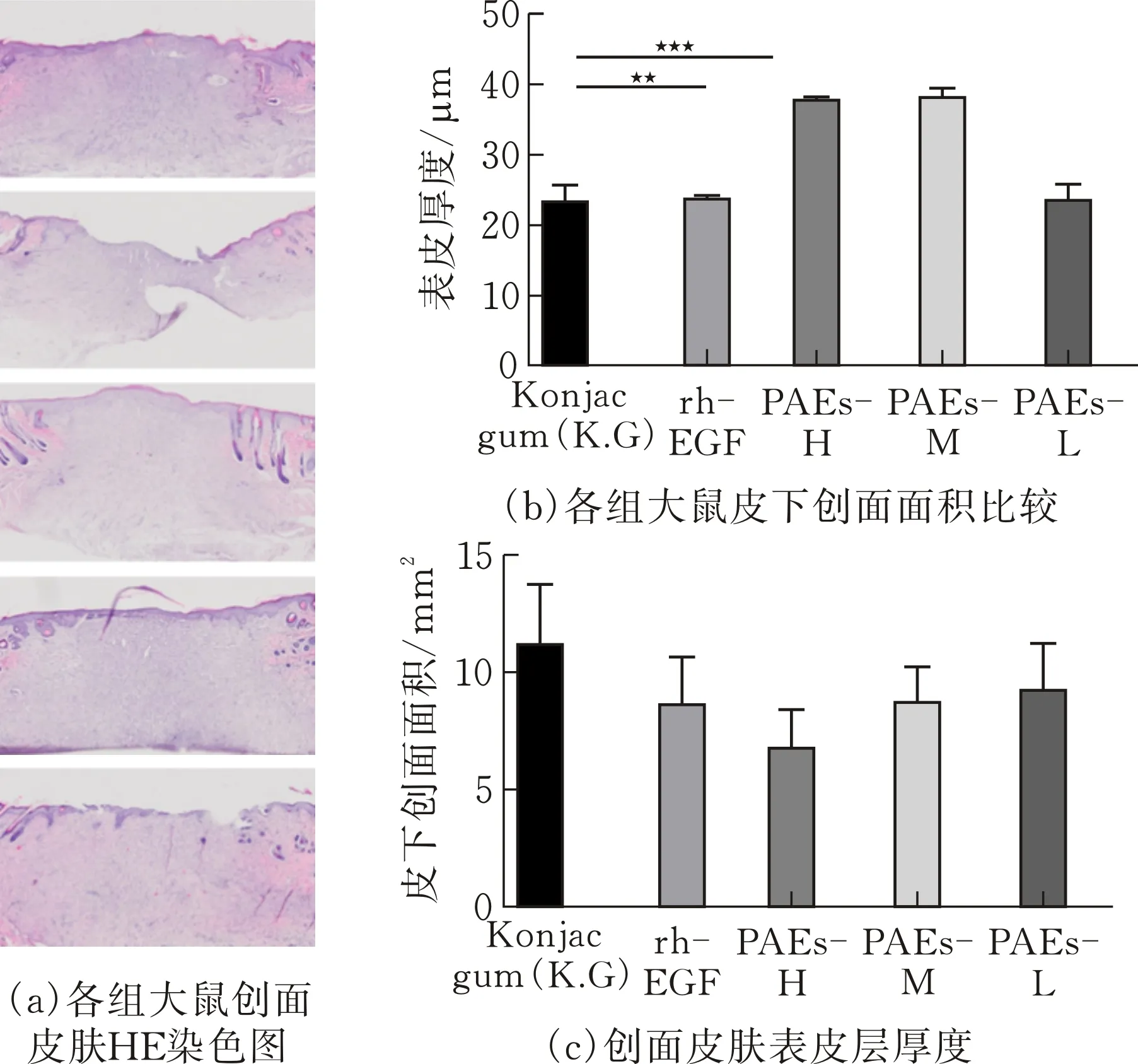
图 5 创面皮肤切片HE染色结果
3.5 创面皮肤病理染色
给药10 d,除模型组外,各组创口边缘出现大量处于生长期的毛囊,外侧可见少量毛发,创面面积有不同程度的缩小。模型组创口面积较大,区域内完全缺乏附件生长。其余各组创面收缩明显,表皮层厚度增加,PAE-H/M组厚度较模型组显著增加(p<0.05)。
3.6 创面SHG信号采集
为了研究创伤周围胶原纤维的排列及含量变化,通过SHG成像技术检测真皮层胶原纤维,并通过Image J软件分析胶原纤维[11]含量变化情况图6a显示,网状层、乳头层均向创口方向延伸填充修复创口,胶原纤维呈随机排列的网状结构。如图6b显示,模型组左、右胶原纤维的排列及含量无统计学差异。给药10 d后各组胶原纤维变粗增多,SHG信号增强。与模型组相比,PAEs-H、M组胶原纤维显著增多(p<0.05),SHG信号更强,表明PAEs组新生胶原含量较高。
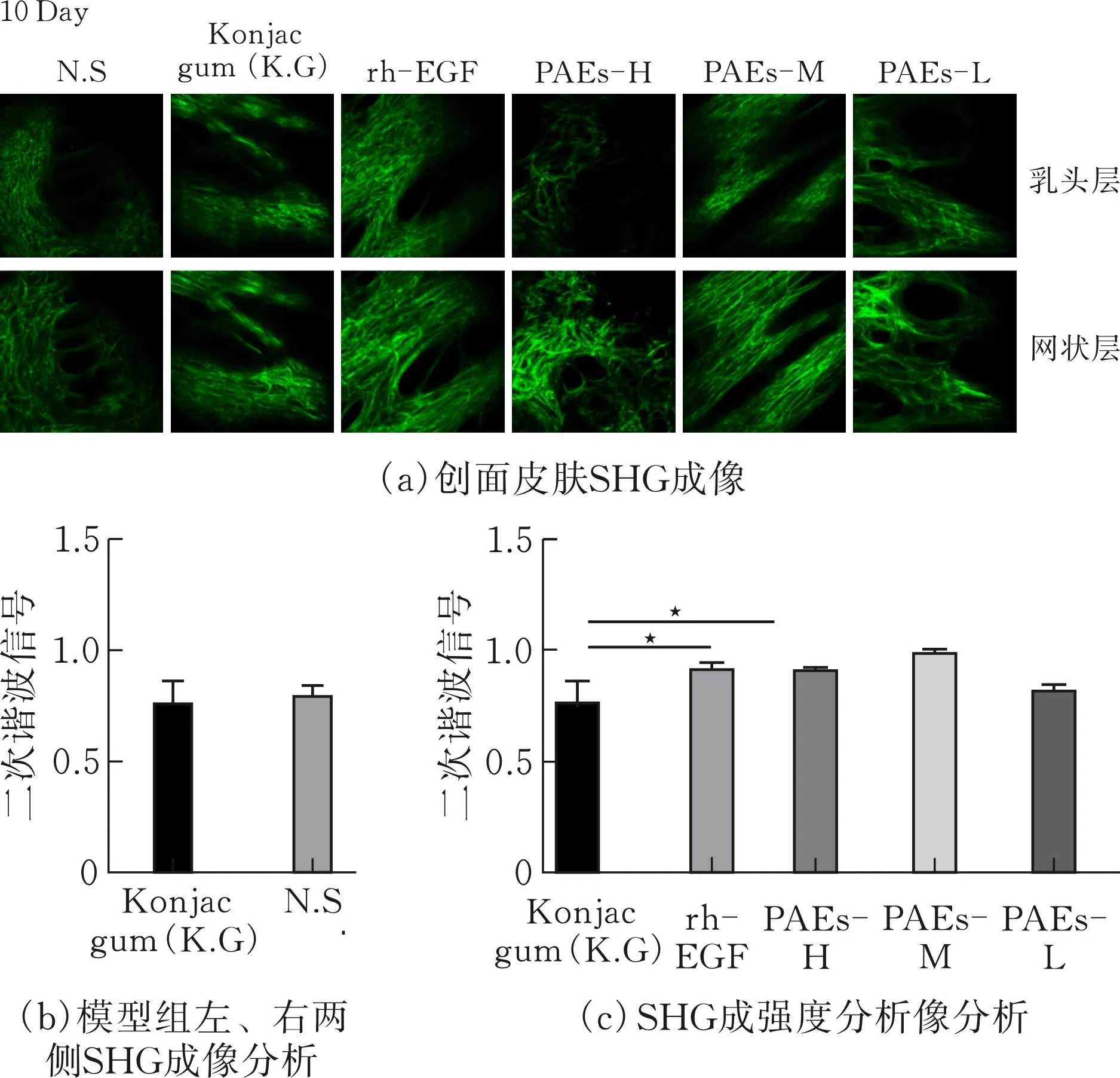
图 6 创面愈合过程中真皮层胶原纤维SHG成像
3.7 创面毛细血管数据采集
将麻醉后的大鼠固定于毛细血管镜系统下,记录创面部位的毛细血管的生长情况。10 d,创口边缘出现较多新生血管,交织成网状(图7a)。其中:模型组毛细血管未交织成网,新生游离毛细血管较多;给药组毛细血管交织成网,毛细血管网数目增多,游离毛细血管较少。如图7b所示,给药10 d后,各给药组较正常皮肤毛细血管网数目显著降低(p<0.01),与模型组相比略有增加但无统计学差异。rh-EGF、PAEs-H/M/L组较正常皮肤游离毛细血管数目显著降低(p<0.01),与模型组相比PAEs-L组游离毛细血管数目显著降低(p<0.05)。PAEs-H组较模型组血流量显著下降(p<0.05),提示毛细血管构建良好,血流趋于稳定(图7d)。
蓝色箭头:游离毛细血管,绿色箭头:毛细血管网
4 讨论与结论
对鹿茸蛋白进行成分分析,其蛋白含量为61.29%,主要为大分子蛋白,存在多种具有促进身体组织修复、生长相关的蛋白质和氨基酸。这很好地解释了其具有促创伤愈合的作用,与“鹿茸具有加速创伤愈合的能力”的记载相一致。
既往研究创伤愈合过程的方法主要为切片染色。由于对切片的主观选择性导致只能对局部创面进行检测分析而无法评估整个创面在愈合过程中的三维结构变化[12]。而TPEF可以直接获得生物组织样本不同深度的图像和光谱信息[13]。TPEF成像技术具有灵敏度高、分辨率强和无创的特点,可以活体追踪表皮层活细胞组织中内源性荧光基团的动态过程,反映表皮厚度的变化[14],这弥补了HE染色不能检测活体组织的缺点。结果显示,与模型组相比,给药10 d后PAEs-M/H组表皮厚度明显增加,推测此时期表皮层中的皮肤附属物较成熟,皮肤分层和皮肤附属物重建是皮肤成熟的关键步骤[15-17]。在PAE-H/M表皮层厚度的显著增加和腺体、细胞器的生成方面,传统HE染色的验证与光学成像结果基本吻合。
SHG成像技术以生物组织非中心对称性的内源性信号为来源而进行激光扫描非线性光学显微术,无需进行离体组织染色,可以活体成像,对组织探测深、损伤小、分辨率高[18]。胶原纤维具有强烈的二阶非线性极化率和结构非中心对称性,可以产生SHG。SHG成像技术可以活体观察胶原纤维的病理变化。结果显示,给药10 d后PAEs-H/M组SHG信号强度增加。
毛细血管镜系统是一种非侵入性、无创性检测手段,能够直接获得皮肤表面毛细血管的高分辨率成像图,同时进行实时量化分析,通过分析可得皮肤表面的毛细血管的生长情况。在受损皮肤区域能否快速建立血液循环,也是对正常皮肤功能的一种评价[19]。给药10 d后,各给药组较正常皮肤毛细血管网数目显著降低,与模型组相比略有增加但无统计学差异,PAEs-H组较模型组血流量显著下降,提示毛细血管构建良好,血流趋于稳定。毛细血管镜系统观察新生毛细血管具有一定的局限性,既往研究表明部分新生毛细血管垂直于创面生长[20],而毛细血管镜系统只拍取平行于皮肤表面的一些新生毛细血管。
综上所述,本研究通过TEPF、SHG和毛细血管镜系统联合使用检测皮肤创伤大鼠皮下表皮层厚度变化、真皮层胶原纤维的排列与含量变化和新生毛细血管的生长情况,评估PAEs促创伤愈合后表皮层、真皮层及血管的功能恢复和重建。结果表明,PAEs中高剂量具有良好的促创伤愈合作用,能够加速创伤愈合,改善愈合质量,促进胶原纤维的形成和毛细血管的重建,为鹿茸蛋白促创伤愈合提供了新的证据。而TEPF成像、SHG成像和毛细血管镜系统将成为一种新型对无创活体皮下组织和附属器官直接进行成像,为创伤相关疾病的诊断和药物治疗提供新的检测方法,为促创伤愈合的研究提供新思路。
