霍乱弧菌新发菌株中vipA,vipB和clpV对T6SS转录调控
2022-02-28吴文轩张幸鼎赵文婧
吴文轩,郭 扬,张幸鼎,赵文婧
(中山大学医学院,广东深圳 518107)
霍乱是一种烈性传染病,2010 年海地爆发霍乱疫情,相对于El Tor 经典株海地变种El Tor 霍乱弧菌不仅在临床上表现出更快的传播力和更高的死亡率,也在动物模型上表现出更强的定植力和毒力[1-2]。已有研究表明,六型分泌系统(Type Ⅵsecretion system,T6SS)对霍乱弧菌的生存和致病起着关键作用,例如其效应因子VgrG-1 靶向真核生物,可以引起巨噬细胞或捕食性阿米巴细胞毒性肌动蛋白交联,从而逃避捕食[3-5]。霍乱弧菌T6SS 基因簇由一个编码结构蛋白的主基因簇(VC0105-VC0124)和至少3 个附轴(VCA0017-VCA0021、VCA1415-VCA1419 和 VCA0284-VCA0286)构成[6]。有研究报道通过转录组测序的方法,将第七次霍乱流行的El Tor 菌株N16961、C6706 和海地变异菌株H1 的T6SS 转录水平进行比较,H1 株T6SS有着更高的转录水平;尤其是T6SS 鞘蛋白(VipA,VipB)和鞘水解蛋白(ClpV)[5]。我们猜测基因vipA,vipB和clpV中是否存在转录调控因子调控T6SS转录。虽然霍乱弧菌是研究T6SS 调控的模式菌株,但是霍乱弧菌会随着环境的变化会快速产生适应性突变。在2016 也门爆发近代史上最大的霍乱疫情,也门霍乱弧菌同样为El Tor 霍乱弧菌的变种,同样表现出更强的持续时间和严重程度[7-8]。探索新发疫情细菌H1 的T6SS 调控机制对于深刻了解T6SS 对于病原菌致病性,以及在细菌进化中的作用,有着重要意义。为了探索霍乱弧菌新发菌株H1 的T6SS 转录调控机制,本研究以转录组测序为基础,分析H1 株分别由于vipA敲除(H1ΔvipA),vipB敲除(H1ΔvipB)和clpV敲除(H1ΔclpV)时T6SS基因簇的转录水平,并对其差异基因进行了基因本体论(Gene ontology,GO)富集和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集。旨在分析H1 株中结构相关基因与T6SS 转录调控的相关性,完善霍乱弧菌T6SS 调控图谱;H1 株的T6SS 调控对将T6SS 作为靶标来防治霍乱弧菌等病原菌的传害提供重要理论基础。
1 材料与方法
1.1 实验菌株
根据实验需求将霍乱弧菌H1 株wt 和突变株培养于添加终浓度为100 μg/mL 的链霉素的LB 培养基,37 ℃,1.4×g的摇床中培养;添加100 μg/mL的链霉素和1%琼脂粉的LB 培养基,37 ℃静置培养。实验操作严格遵守《生物安全保障承诺书》中的相关规定,按照标准操作展开实验活动,确保实验室安全。
1.2 主要试剂
载体(pWM91 Vector,实验室自存);限制性内切酶(NotI-HF 和SacI,NEB 公司);连接酶(T4 DNA Ligase,NEB 公司);Taq 酶(PrimeSTAR Max Premix,Takara 公司);感受态(SM10 和DH5α λ pir,实验室自存);TRIzol 试剂(TRIzol Reagent,Thermo公司);RNA 提取试剂盒(Pure Link RNA Mini Kit,Invitrogen 公司);DNA 清除试剂盒(Ambionogen-RNA Mini Kit,Invitrogen 公司);RNA-seq 建库试剂盒(Next® Ultra Ⅱ™Directional RNA Library Prep Kit for Illumina,NEB 公司);反转录试剂盒(Evo MMLV RT Kit with gDNA Clean for qPCR,艾科瑞公司);荧光定量试剂盒(SYBR® Green Premix Pro Taq HS qPCR Kit,艾科瑞公司)。
1.3 突变菌株构建
选取目标基因上下游各800 bp 的序列分别进行扩增,将上下游片段的黏性末端相连组成1 600 bp片段克隆到pWM91自杀质粒中。将重组质粒转化至SM10 感受态中,并与H1 wt 于37 ℃共培养2 h;保证重组质粒整合至H1菌株的基因组中完成第1 次同源重组。将完成第一次同源重组的H1 菌株在含有6%蔗糖的平板上涂布,由于重组质粒携带sacB基因。迫于蔗糖的选择压力,此时发生第2 次同源重组,目标基因被敲除突变菌株构建完成。按照以上方法在H1 wt基础上构建H1ΔvipA,H1ΔvipB和H1ΔclpV。
1.4 细菌总RNA提取
于37 ℃培养过夜,取109CFU 细菌于1 mL 的TRIzol 中,加入250 mg 的玻璃砂,匀浆2 次每次1 min。加入400 μL 的氯仿于样品中混匀,在4 ℃预冷离心机中13 200 ×g离心30 min。取水相上清,按照Pure Link RNA Mini Kit 说明书提取总RNA,随后根据Ambionink RNA Mini Kit 的说明书去除样品中的DNA,得到纯化的总RNA 样品。利用Nanodrop One,1%琼脂糖电泳(120V,30 min)和Agilent 4200检测RNA 样品的完整性、纯度和总量,合格者进行接下来的测序分析。每个菌株重复3 次,作为3次生物学重复。
1.5 转录组建库、测序及数据分析
将合格的RNA 样品按照Next® Ultra Ⅱ™Directional RNA Library Prep Kit for Illumina 的说明书进行cDNA 双链合成和测序文库构建,利用Agilent 2100 对文库质量进行评估;合格的文库通过llumina Hiseq 平台进行RNA-seq 测序得到RNA-seq 原始数据。CLC Workbench 12.0 对数据进行质量检测和过滤。将过滤后的数据与从NCBI(https://www.ncbi.nlm.nih.gov/)下载H1 wt 菌株的参考基因组文件进行比对,得到测序片段计数矩阵并运用TMM 的方法进行均一化。最后以H1 wt 菌株转录组作为内参获得差异基因的表达矩阵,并用BH 方法对P-value 进行矫正;以FDR<0.01 且|log2FC|≥1为标准定义差异基因。
1.6 逆转录和荧光定量PCR检测
利用荧光定量PCR 方法,对T6SS 基因簇中部分基因的RNA-seq 结果进行qPCR 验证。RNA 样品1 μg 按照Evo M-MLV RT Kit with gDNA Clean for qPCR 说明书进行逆转录得到cDNA。实时定量PCR 反应体系如下:2×SYBR® Green Pro Taq HS Premix 10 μL、cDNA 2 μL、上下游特异性引物(10 μmol/L)各0.4 μL、ROX Reference Dye 0.4 μL、RNase free water 6.8 μL,引物序列均在NCBI 中验证。扩增程序:95 ℃运行30 s循环1次,95 ℃运行5 s,60 ℃运行30 s循环40次。每个样本重复测3次,以gyrB作为管家基因,以H1 wt的CT值作为样本间标准化内参,使用log2FC计算基因的相对表达量。
1.7 统计学方法
使用Hiplot(https://hiplot.com.cn)对RNA-seq的差异基因进行聚类分析、可视化分析和交叉关系展示。将H1 wt 基因组序列与eggNOG(http://eggnog-mapper.embl.de/)数据库比对,得到有GO和KO功能注释的差异基因,并使用clusterProfiler R 进行GO 和KEGG 富集。采用GraphPad Prism 8 统计软件进行数据分析,计量资料以均数±标准误(Mean±SEM)表示。
2 结果
2.1 H1ΔvipA,H1ΔvipB 和H1ΔclpV 的T6SS 基因簇转录水平不同
利用RNA-seq 技术,将H1 wt 转录组作为样本间标准化的内 参,得 到H1ΔvipA,H1ΔvipB和H1ΔclpV的T6SS 基因簇log2FC 趋势图(图1)。以|log2FC|≥1 为基准,认为有差异。由图1 可知,H1ΔvipA株T6SS 主 轴vipB(log2FC=4.18)、hsiF(log2FC=4.28)、vasA(log2FC=3.59)、vasB(log2FC=3.71)、vasC(log2FC=3.91)、vasD(log2FC=3.81)、vasE(log2FC=3.41)、vasF(log2FC=3.58)、clpV(log2FC=3.39)、vasH(log2FC=3.38)、vasI(log2FC=3.71)、vasJ(log2FC=3.40)、vasK(log2FC=3.31)、vasL(log2FC=2.60)和vgrG-3(log2FC=1.51),以及T6SS 附轴hcp-1(log2FC=3.59)、vgrG-1(log2FC=1.62)、hcp-2(log2FC=3.45)和vgrG-2(log2FC=2.21)的转录水平都呈增高趋势;仅vipA(log2FC=-11.78)转录水平由于敲除呈降低趋势。H1ΔvipB株tsiV-3(log2FC=-1.23)、VC1420(log2FC=-1.06)和vipB(log2FC=-9.02)的转录水平呈降低趋势,其余基因|log2FC|均小于1。H1ΔclpV株tsiH(log2FC=1.32)转录水平呈增高趋势;仅clpV(log2FC=-8.45)转录水平由于敲除呈降低趋势。
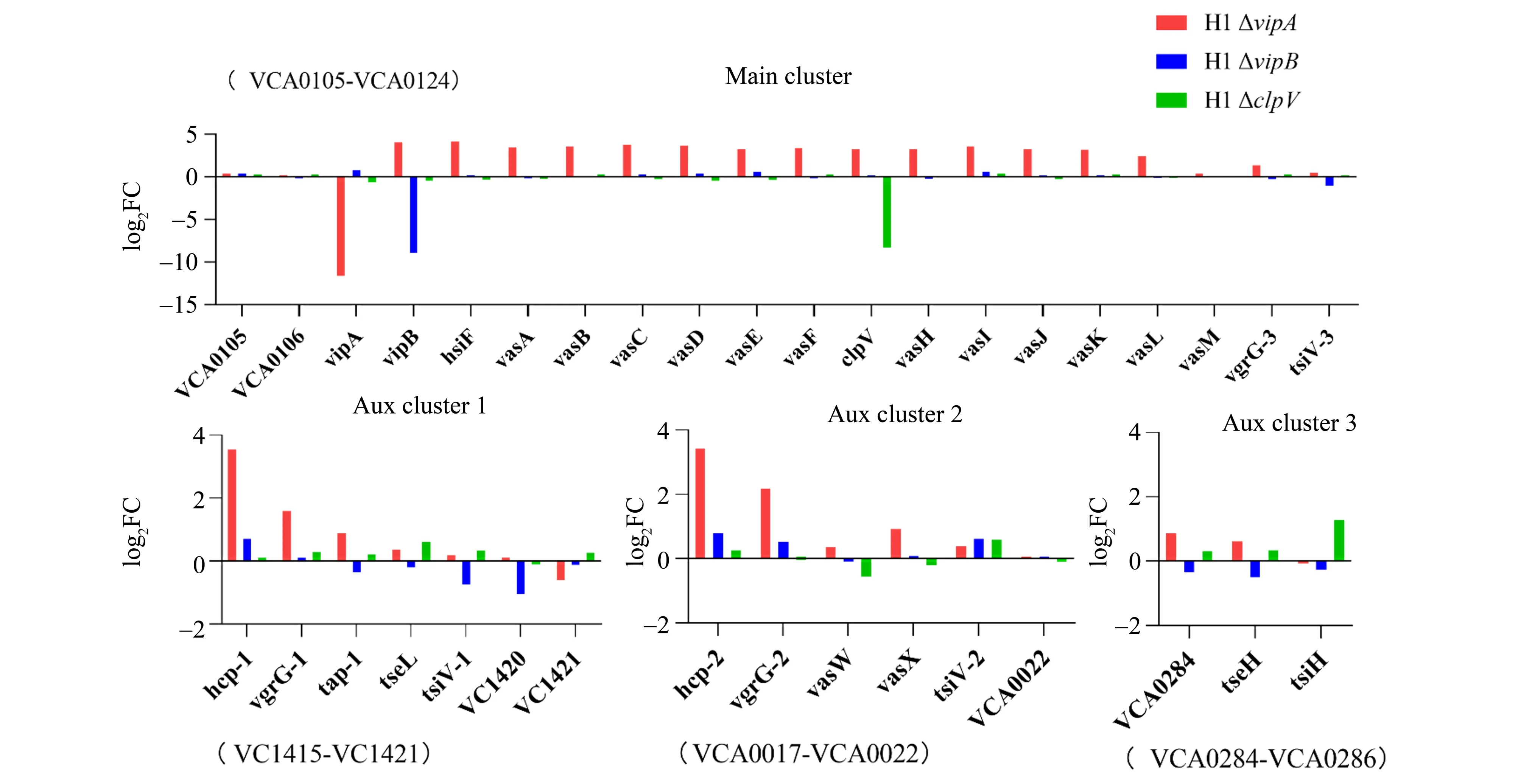
图1 H1ΔvipA,H1ΔvipB和H1ΔclpV株的T6SS基因簇转录水平Fig.1 The expression level of genes of T6SS clusters across H1ΔvipA,H1ΔvipB and H1ΔclpV
2.2 H1ΔvipA,H1ΔvipB和H1ΔclpV转录组分析
以H1 wt 转录组为样本间标准化的内参,寻找由于vipA,vipB和clpV基因敲除引起的转录差异。以FDR<0.01 且|log2FC|≥1 为标准定义差异表达基因,并且对差异基因进行聚类分析(图2A)。H1ΔvipA的差异基因共有22 个,其中19 个基因转录水平上调,3 个基因转录水平下调(图2B);H1ΔvipB的差异基因有44 个,其中17 个基因转录水平上调,27 个基因转录水平下调(图2C);H1ΔclpV的差异基因有86 个,其中49 个基因转录水平上调,35 个基因转录水平下调(图2D)。并且H1ΔvipB和H1ΔclpV拥有相同的23 个差异基因;H1ΔvipB和H1ΔvipA有4 个相同的差异基因(hapA,hapR,vipB,KW3_RS0115980);H1ΔvipA和H1ΔclpV有4 个相同的差异基因(hapA,hapR,clpV,KW3_RS0115980);H1ΔvipA,H1ΔvipB和H1ΔclpV共同拥有的差异基因有3 个(hapA,hapR,KW3_RS0 115980;图2E)。
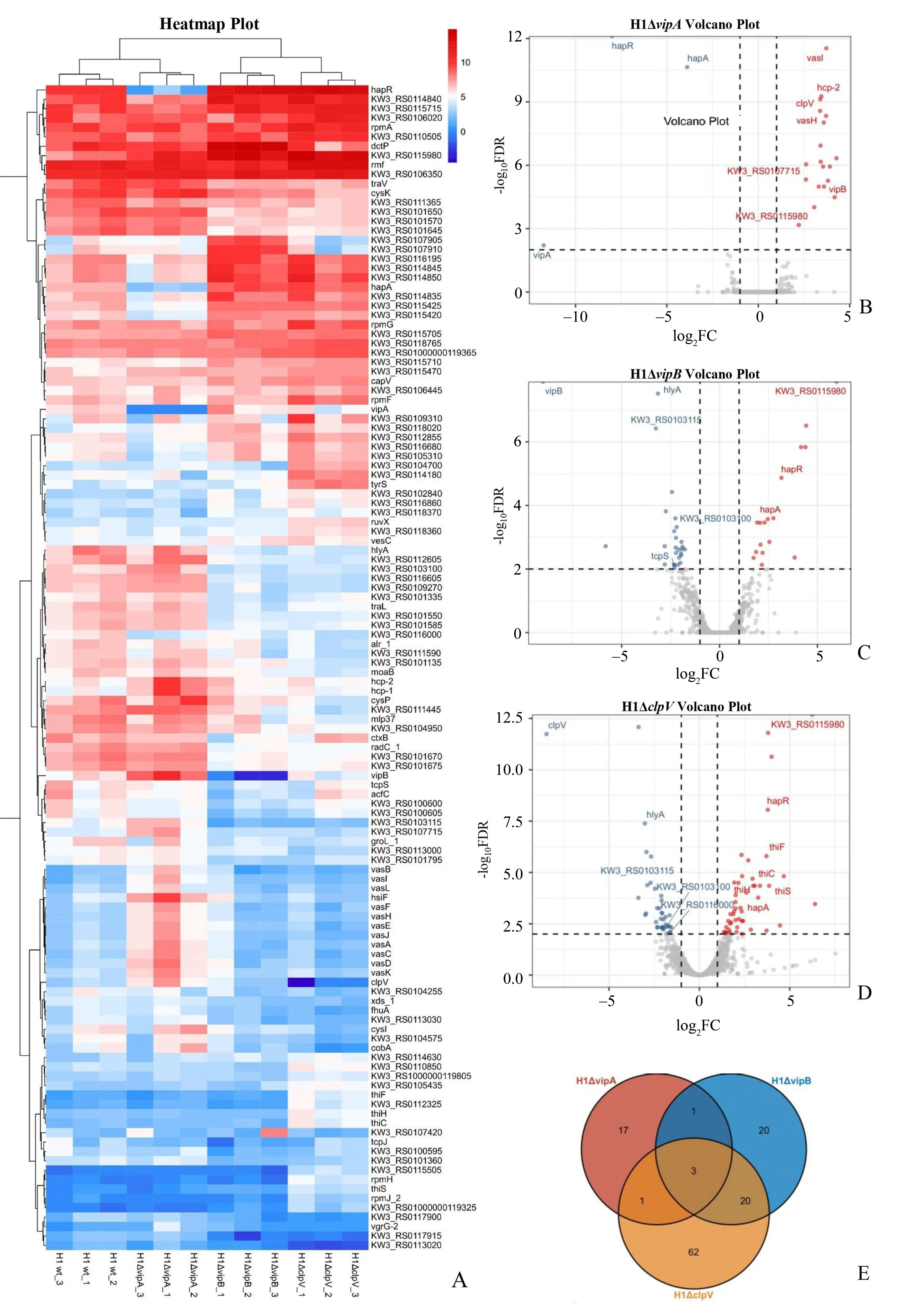
图2 H1ΔvipA,H1ΔvipB和H1ΔclpV差异基因分析Fig.2 Differentially expressed genes across H1ΔvipA,H1ΔvipB and H1ΔclpV
2.3 H1ΔvipA,H1ΔvipB 和H1ΔclpV 的差异表达基因的GO和KEGG分析
以H1 wt 的GO 注释作为基因背景,对H1ΔvipA,H1ΔvipB和H1ΔclpV的差异基因进行GO 富集。H1ΔvipA的差异基因GO 富集通路主要涉及细胞外区域(extracellular region)、多机体过程(multi-organism process)、发病机制(pathogenesis)和物种间相互作用(interspecies interaction)等(图3A)。H1ΔvipB的差异基因GO 富集通路主要涉及二甲基酸运输(dicarboxylic acid transport)、C4-二甲基运输(C4-dicarboxylate transport)、有机酸运输(organic acid transport)和有机离子运输(organic anion transport)等(图3B)。H1ΔclpV的差异基因GO 富集通路主要涉及结构分子活性(structural molecule activity)、核糖体的结构成分(structural constituent of ribosome)、肽代谢过程(peptide metabolic process)和肽生物合成过程(peptide biosynthetic process)等(图3C)。
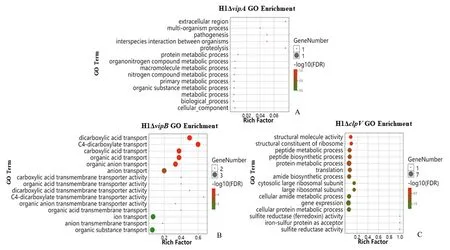
图3 H1ΔvipA,H1ΔvipB和H1ΔclpV差异表达基因的GO富集Fig.3 GO enrichment of DEGs across H1ΔvipA,H1ΔvipB and H1ΔclpV
以H1 wt 的KEGG 注释作为基因背景,对H1ΔvipA,H1ΔvipB和H1ΔclpV的差异基因进行KEGG 富集。H1ΔvipA的差异基因KEGG 富集通路主要涉及霍乱弧菌生物膜形成(biofilm formation-Vibrio cholerae,图4A)。H1ΔvipB的差异基因KEGG富集通路主要涉及布塔诺酸盐代谢(butanoate metabolism)、双组件系统(two-component system)、霍乱弧菌生物膜形成(biofilm formation-Vibrio cholerae)和酮体的合成和降解等(synthesis and degradation of ketone bodies,图4B)。H1ΔclpV的差异基因KEGG 富集通路主要涉及硫铵代谢(thiamine metabolism)等(图4C)。

图4 H1ΔvipA,H1ΔvipB和H1ΔclpV差异表达基因的KEGG富集Fig.4 KEGG enrichment of DEGs across H1ΔvipA,H1ΔvipB and H1ΔclpV
2.4 荧光定量PCR验证
挑选T6SS 基因簇中部分基因以及hapR对H1ΔvipA,H1ΔvipB和H1ΔclpV的转录组结果进行qPCR 验 证。H1ΔvipA的决定性系数为0.801 3;H1ΔvipB的决定性系数为0.816 5;H1ΔclpV的决定性系数为0.800 0,各个菌株T6SS 部分基因和hapR转录水平变化趋势与RNA-seq结果基本一致(图5)。
3 讨论
为了探究霍乱弧菌H1 新发株T6SS 结构蛋白编码基因是否调控T6SS 转录,我们构建了多个T6SS 敲除株。通过H1ΔvipA,H1ΔvipB和H1ΔclpV的T6SS 转录水平比 较,发现 仅vipA缺 失,H1 株T6SS 下游基因整体转录水平显著性增高,包括下游的vipB和clpV;与其共编码VipA/VipB 鞘蛋白复合体的vipB缺失和编码鞘蛋白水解酶的clpV缺失,T6SS 转录水平却无整体变化。同时RNA-seq 的结果表示H1ΔvipA有22 个差异基因,其中有18 个属于T6SS 基因簇(图2B)。已有研究表明,霍乱弧菌的鞘蛋白是高度保守的,其同源物已在所有T6SS结构中发现;并且VipA 和VipB 蛋白相结合是保证T6SS 活性的必要条件。在霍乱弧菌O1 V1552 中,vipA缺失会导致VipB 不能稳定产生[9]。在同样拥有T6SS 的土拉弗朗西斯菌(Francisella tularensis)中,vipA同源物基因的缺失,使vipB同源基因的转录水平下降两倍,而vipB同源基因的缺失对vipA同源基因的转录水平并无影响[10]。以往研究表明vipA与vipB转录水平应当是相对稳定的,而将vipA缺失vipB水平却增高400 多倍(图5),这种结果是从未报道过的。

图5 H1ΔvipA,H1ΔvipB和H1ΔclpV T6SS基因簇RNA-seq数据的qPCR验证Fig.5 Verification of RNA-seq data of genes of T6SS clusters by qPCR across H1ΔvipA,H1ΔvipB and H1ΔclpV
H1ΔvipA,H1ΔvipB和H1ΔclpV共同拥有的差异基因有3 个(hapR,hapA,KW3_RS0115980)(图2E)。在霍乱弧菌中,HapR是一种群体感应通路主要的调节因子,可通过抑制霍乱弧菌多糖合成的调控基因vpsT及vpsR的表达,来抑制霍乱弧菌生物膜形成和毒力基因的表达;同时HapR 也可与T6SS附轴启动子结合,激活T6SS附轴的转录[11-13]。当细胞密度较低时,磷酸化的LuxO 激活Qrr sRNA 产生,激活AphA 的翻译并抑制HapR 的翻译,从而降低T6SS 附轴的转录水平;Qrr sRNA 也可通过与T6SS主基因簇的mRNA 碱基互补配对直接抑制T6SS 主轴转录[14]。当细胞密度较高时,LuxO 未磷酸化,Qrr sRNA 不转录,HapR 稳定表达,此时T6SS 主轴中的调控因子vasH 与HapR 一起促进T6SS 附轴转录[11]。结合我们的实验结果,H1ΔvipA株中hapR是转录差异基因,并呈现明显下降趋势;而hapR在H1ΔvipB和H1ΔclpV中呈明显增高趋势(图2B-D)。这提示我们,hapR可能参与H1 株中vipA对T6SS 基因簇的转录调控,并与vipA转录趋势一致。同时,vipA可以调控T6SS 转录水平可能由于vipA与其他T6SS主轴基因共用一个启动子[6],并且vipA是T6SS主轴启动子后的第一个基因,可能作为反式作用因子结合阻遏蛋白,从而抑制后续T6SS基因簇转录。
HapA 是hapA编码的金属蛋白酶,是一种霍乱弧菌O1 分泌的辅助毒素。其通过水解宿主黏蛋白、降低宿主细胞间的紧密连接、水解宿主的免疫蛋白等放方式加速疾病进程[15]。在霍乱弧菌中,hapA的转录由HapR和RpoS共同调控,在营养受限或细胞密度较高时,群体感应调控蛋白HapR 稳定表达,从而直接激活hapA的转录[16]。本实验中hapA和hapR表达趋势一致并且与野生型有显著差异性,即 在H1ΔvipA中hapA(log2FC=-3.89)和hapR(log2FC=-8.00)表达共降低,H1ΔvipB中hapA(log2FC=2.46)和hapR(log2FC=3.16)表达共增高,且H1ΔclpV中hapA(log2FC=2.27)和hapR(log2FC=3.78)表达共增高,提示hapA的转录变化可能由hapR变化引起。而三个敲除株中KW3_RS0115980转录水平均显著上调(图2B-D),但其基因编码蛋白目前仅预测为假想蛋白,其具体功能需要进一步揭示。
ClpV 是由clpV编码的ATP 酶,可通过水解VipA/VipB 鞘蛋白复合体,达到移除已收缩过的T6SS以启动新的T6SS分泌过程[17-18]。但将clpV敲除后,有多达86 个基因转录水平发生显著改变,这些差异基因GO 富集到蛋白质代谢相关通路(图3C),KEGG 通路包括硫胺代谢通路(图4C)。维生素B1又名硫胺素,是参与碳水化合物和氨基酸代谢的酶的辅因子,几乎所有的生命体都需要硫胺素[19]。大多数细菌可以从头合成硫胺素,当缺乏硫胺素合成基因缺乏时则需要通过转运蛋白从外界摄取硫胺素[20]。目前细菌已经进化出许多硫胺素及前体转运蛋白,ABC 转运蛋白(ThiBPQ、ThiXYZ、ECFThiT和YkoEDC)、二级转运蛋白(NiaP)和促进转运蛋白(PnuT)。在H1ΔclpV中thiC、thiF、thiH和thiS呈明显转录增高趋势(图2D)。thiC在硫胺素合成中起着重要作用,其编码蛋白ThiC 将硫胺素和嘌呤合成的分支点代谢物5-氨基咪唑核糖苷转化为磷酸化的4-氨基-5-羟甲基-2-甲基嘧啶,这是合成有活性的焦磷酸硫胺素的关键[21]。有研究表示,在细菌、真菌和植物中硫胺素及其衍生物可以和RNA 结合以控制其基因的转录或翻译[22]。可见硫胺素在转录调节方面有着重要作用,但至于在霍乱弧菌中是否也有基因转录调控的功能以及clpV缺失引起硫胺素合成相关基因转录水平升高,需要进一步的实验探索。
生物膜提供霍乱弧菌稳定的生存环境,自然状态下霍乱弧菌可以在浮游,单层生物膜中和成熟生物膜的生存状态中切换,在不同的生存状态下其体内转录情况不同[23]。H1ΔvipA,H1ΔvipB和H1ΔclpV的KEGG 均富集到霍乱弧菌生物膜形成相关途径(图4A-C),其中H1ΔvipA的生物膜形成相关差异基因有hapA、hapR、KW3_RS0 107715;H1ΔvipB的生物膜形成相关差异基因有hapA、hapR、tcpS、KW3_RS0103100 和KW3_RS0 103115;H1ΔclpV的生物膜形成相关基因有hapA、KW3_RS0116000、hapR、KW3_RS0103100 和KW3_RS0103115 等。霍乱弧菌生物膜形成过程受多种途径调控,其中包括群体感应途径[24]。已有研究表明霍乱弧菌C6706中hapR的表达时间与生物膜厚度,生物膜脱离率和霍乱弧菌定植率密切相关[25]。H1ΔvipA,H1ΔvipB和H1ΔclpV的KEGG 富集不仅富集到霍乱弧菌生物膜形成通路还都富集到群体感应通路,推测H1株中群体感应调控生物膜形成相关基因的转录水平变化。
综上所述,本研究发现:vipA基因是一个存在与H1 菌株中具有多重功能的基因,一是编码T6SS鞘结构蛋白,二是参与T6SS 调控。同时,研究表明hapR可能参与H1 菌株vipA对T6SS 的转录调控。结合前期研究结果,将存在于H1 菌株中的可能调控通路绘制简图(图6)。本研究为将霍乱弧菌新发菌株H1 的T6SS 作为防治靶标奠定基础;也为霍乱弧菌T6SS的转录调控提供新的思路。
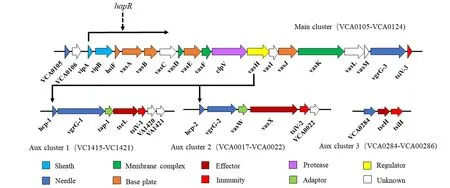
图6 霍乱弧菌H1株T6SS转录调控网络Fig.6 T6SS transcription regulation network in Vibrio cholerae H1
