辅酶Q10抑制过氧化氢诱导的血小板线粒体功能紊乱
2022-02-28施译琳杨奥林王锐杰牙甫礼陈彦球燕1
施译琳,杨奥林,王锐杰,牙甫礼,陈彦球,杨 燕1,
(1.中山大学公共卫生学院,广东广州 510080;2.中山大学公共卫生学院(深圳),广东深圳 518106;3.广东省营养膳食与健康重点实验室,广东广州 510080;4.广东省营养转化工程技术研究中心,广东广州 510080;5.大理大学公共卫生学院,云南大理 671003;6.广州市妇女儿童医疗中心,广东广州 510623)
血小板是成熟巨核细胞上脱落下来的细胞质小块,具有止血、凝血的基本生理功能[1]。线粒体是能量代谢的主要场所,对维持细胞生理功能和生存所需的代谢底物生成至关重要[2]。越来越多的证据表明,血小板线粒体通过能量产生以外的途径(氧化还原信号和细胞凋亡途径)激活血小板,发挥促血栓形成作用[3]。在糖尿病患者的血小板中,功能紊乱的线粒体比例增加,导致血小板凋亡率升高、存活率降低,伴随血栓事件的风险增加[4]。已有实验证明过氧化氢(hydrogen peroxide,H2O2)极易透过细胞膜,与细胞内铁离子通过Fenton反应形成高活性的自由基,导致一系列反应,H2O2性质相对稳定、易于获得,已成为研究细胞氧化损伤的重要工具[5]。氧化应激状态下的血小板,线粒体发生轻度损伤,膜电位下降,三磷酸腺苷(adenosine triphosphate,ATP)合成速率下降,导致线粒体活性氧簇(mitochondrial reactive oxygen species,mtROS)累积。活性氧簇(reactive oxygen species,ROS)可促进胞内氧化应激的失衡,导致线粒体膜电位进一步下降,直至线粒体严重损坏,释放细胞色素c 诱发细胞凋亡[6]。辅酶Q(coenzyme Q,CoQ)是一种类似于维生素的脂溶性苯醌,是线粒体电子传递链上重要的中间体,人体中主要以CoQ10形式存在[7]。流行病学、临床试验和动物实验研究表明,CoQ10具有广泛的抗氧化、调节线粒体等功能[8]。CoQ10对血小板的研究报道不多,集中在对血小板体积和活化、聚集功能的效应研究[9]。我们前期的研究结果表明,CoQ10具有通过整合素αIIbβ3 调节血小板活化、聚集功能的作用[10],但是CoQ10是否具有血小板线粒体功能紊乱的保护作用尚无报道。因此,本研究拟在H2O2诱导的血小板氧化应激模型中探讨CoQ10对线粒体功能的调节效应,并探究其抗氧化机制,为CoQ10保护血小板线粒体功能提供重要的理论依据。
1 材料与方法
1.1 对 象
招募健康志愿者,性别不限,年龄25~65 岁之间,4 周内未饮用浓茶、咖啡、红酒等可能影响血小板功能的饮料,无吸烟史,未补充维生素及CoQ10等营养补充剂,未服用阿司匹林等抗血小板药物。所有研究均依照赫尔辛基宣言进行,所有志愿者均签署知情同意书,并由中山大学伦理委员会批准同意。
1.2 材料与试剂
CoQ10(>98%)、二甲基亚砜(DMSO)、H2O2、无水氯化钙(CaCl2)购自Sigma 公司。JC-1、Annexin-V 购自BD 公司;ATP 检测试剂盒购自上海碧云天公 司;Total ROS Assay Kit、Mitochondria Isolation Kit、MitoSOX™Red 探针购自Thermo Fisher 公司。一抗p53、p-p53、Bcl-2、Bcl-xL 购自CST公司,一抗β-actin 购自Sigma 公司;二抗goat anti-rabbit、goat anti-mouse购自Abcam公司。
1.3 仪器与设备
多功能酶标仪,购自美国伯腾公司;流式细胞仪CytoFlex S,购自美国Beckman 公司;Mini-Protean电泳、转膜设备,购自美国伯乐公司;全自动化学发光成像分析系统,购自中国Tanon公司。
1.4 方 法
1.4.1 人纯化血小板的制备 健康志愿者在清晨空腹状态下,抽取外周静脉血约10 mL,按9:1的体积比加入枸橼酸钠抗凝剂,轻轻混匀,静置15 min后,将全血以300×g离心10 min,获得富血小板血浆(platelet-rich Plasma,PRP);将PRP 通过凝胶柱,收集到纯化血小板,用PIPES 缓冲液(1 L 溶液含8.38 g PIPES、8.01 g NaCl、0.298 g KCl 和1 g 葡萄糖,pH 7.0)稀释至2×108~3×108个/mL。
1.4.2 血小板线粒体膜电位测定 用100 μmol/L CoQ10与纯化血小板(1×106个/mL)避光孵育50 min。加入为5 μg/mL 的JC-1 工作液,室温避光孵育15 min,然后在1 mmol/L 的CaCl2溶液存在下,加入1 mmol/L 的H2O2激活血小板30 min。孵育结束后加入PBS,立即上机检测。用流式细胞仪检测JC-1 单体及复合物荧光信号的变化,实验至少重复3次,下同。
1.4.3 血小板PS 外翻阳性率测定 用100 μmol/L CoQ10与纯化血小板(1×106个/mL)避光孵育50 min。加入1 mmol/L H2O2激活血小板15 min。避光加入Annexin V 抗体,室温下孵育15 min 后,加入Binding buffer 终止反应,30 min 内用流式细胞仪检测荧光强弱,确定PS外翻阳性率。
1.4.4 血小板线粒体分离 干预后的血小板离心弃上清。加入线粒体分离试剂A,中速旋涡5秒,冰上反应2 min。加入试剂B,高速涡旋5 s,在冰上孵育5 min,每分钟涡旋1 次。加入试剂C,颠倒混匀(不要涡旋)。在4°C 下以700×g离心10 min。将上清液转移到新的EP 管中,4°C 下以12 000×g离心15 min。将上清(胞浆部分)转移到新的EP 管中。沉淀则为线粒体组分。向沉淀中加入试剂C,12 000×g离心5 min,弃上清即得纯化的线粒体。
1.4.5 血小板ATP 含量测定 干预后的血小板通过离心(12 000 ×g,15 min,4℃)得到细胞沉淀,或按照1.4.4 分离出线粒体组分,加入细胞裂解液,反复吹打使其充分混匀,在冰上裂解30 min,每隔10 min 涡旋约10 s。裂解完成后,进行离心(12 000 ×g,15 min,4℃),上清液即为血小板蛋白,收集上清并进行ATP浓度的检测,根据标准曲线计算出样品中ATP的浓度。
1.4.6 血小板ROS 水平检测 按照试剂盒说明书检测。100 μmol/L CoQ10与纯化血小板悬液(1×106个/mL)避光孵育50 min 后,加入ROS 荧光探针孵育30 min,与1 mmol/L 的H2O2孵育30min。离 心(200×g,10 min,室温)弃上清,洗去多余探针,用酶标仪检测ROS水平。
1.4.7 血小板mtROS 水平检测 用100 μmol/L CoQ10与纯化血小板(1×106个/mL)避光孵育50 min。加入终浓度为2 μmol/L 的mitoSOX Red 探针,室温下避光孵育30 min,然后在1 mmol/L 的Ca-Cl2溶液存在的条件下,加入1 mmol/L 的H2O2激活血小板30 min。洗去多余探针,立即用流式细胞仪检测平均荧光强度。
1.4.8 Western Blot 检测血小板蛋白水平 血小板加入细胞裂解液冰上裂解30 min,12 000 ×g离心15 min,所得上清即为细胞总蛋白。测量并调整蛋白浓度后,100 ℃煮5 min,分装,-80 ℃保存备用。取20~30 μg 样本上样,将样本电泳、转膜,用5%BSA 室温封闭1 h,TBST 洗膜3 次。分别加入特异性一抗,放入4 ℃冰箱孵育过夜。洗膜3次后,加入二抗,室温孵育1 h,洗膜3 次。使用ECL 化学发光,用凝胶成像仪成像。
1.5 统计学处理
使用SPSS 20.0 软件进行统计分析。结果用均数±标准差(±s)表示,多组间比较采用单因素方差分析,并且使用Dunnett-t检验将每个CoQ10组与对照组进行比较,以P<0.05 为差异有统计学意义。
2 结果
2.1 CoQ10降低H2O2诱导的总ROS、线粒体ROS
在1 mmol/L H2O2诱导下,血小板胞内总ROS显著升高,且线粒体氧化应激水平也升高。与对照组相比,CoQ10显著降低ROS 水 平(F=71.66,P<0.000 1,指定组间比较P<0.05;图1)。
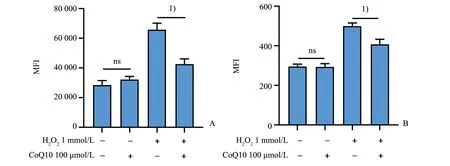
图1 CoQ10降低H2O2诱导的总ROS、mtROS Fig.1 The inhibitory effect of CoQ10 on H2O2-induced platelet intracellular ROS and mtROS
2.2 CoQ10改善H2O2诱导的线粒体膜电位下降
由图2 可知,在1 mmol/L H2O2诱导下,血小板线粒体膜电位显著下降。与对照组相比,CoQ10显著抑制膜电位下降(F=81.00,P<0.000 1,指定组间比较P<0.05;图2)。
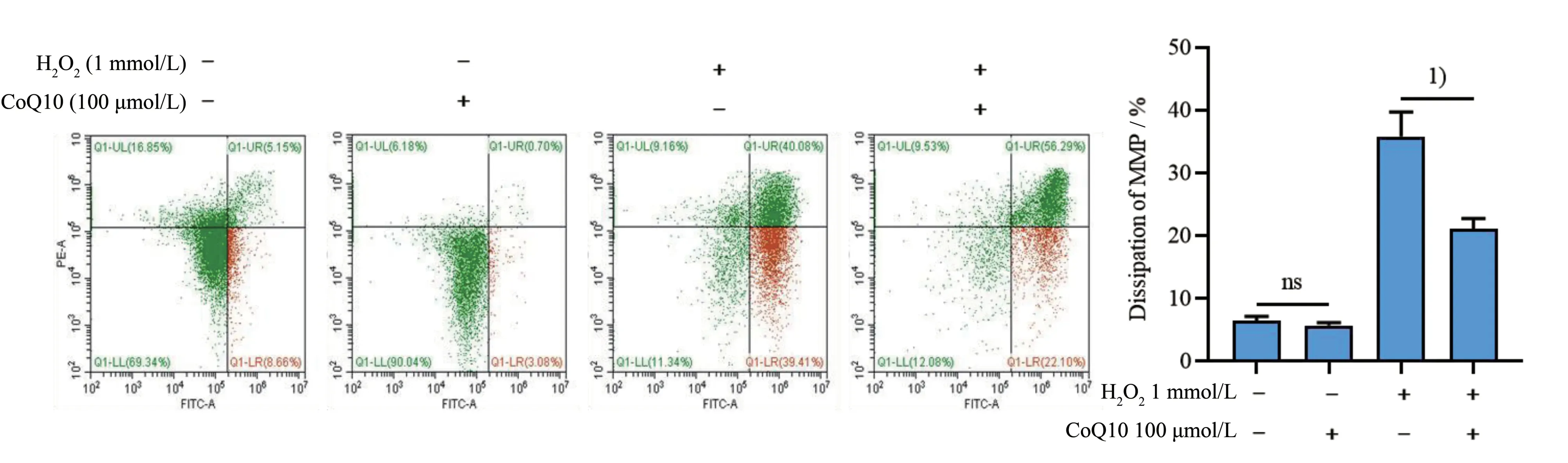
图2 CoQ10改善H2O2诱导的线粒体膜电位下降Fig.2 The protective effect of CoQ10 on H2O2-induced platelet mitochondrial membrane potential dissipation
2.3 CoQ10对H2O2诱导的PS外翻阳性率无影响
在1 mmol/L H2O2诱导下,血小板PS 外翻显著增加。与对照组相比,CoQ10显著对PS 外翻的抑制作用差异无统计学意义(方差分析F=653.9,P<0.000 1,指定组间比较P>0.05;图3)。

图3 CoQ10对H2O2诱导的PS外翻无影响Fig.3 CoQ10 did not affect the H2O2-induced platelet PS exposure.
2.4 CoQ10 对H2O2 诱导的细胞总ATP、线粒体ATP含量无影响
在1 mmol/L H2O2诱导下,血小板ATP 含量显著下降。与对照组相比,CoQ10对ATP 含量下降无抑制作用(方差分析F=30.24,P<0.000 1,指定组间比较P>0.05,图4A;方差分析F=15.50,P=0.001 8,指定组间比较P>0.05,图4B)。

图4 CoQ10对H2O2诱导的细胞总ATP、线粒体ATP含量无影响Fig.4 CoQ10 did not affect the H2O2-induced platelet cellular or mitochondrial ATP content.
2.5 CoQ10 降低H2O2诱导的p53 磷酸化水平、增加Bcl-2家族蛋白表达水平
p53 是调节氧化应激的关键通路蛋白,Bcl-2、Bcl-xL 是抗凋亡蛋白。由图5 可知,在1 mmol/L H2O2诱导下,血小板p53 磷酸化水平显著升高而Bcl-2、Bcl-xL 下降。与对照组相比,CoQ10显著抑制p53 磷酸化水平(F=40.41,P=0.001 9,指定组间比较P<0.05;图5A),升高Bcl-2、Bcl-xL 蛋白表达水平(图5BF=18.79,P=0.007 9,图5CF=19.89,P=0.007 2,指定组间比较P<0.05)。

图5 CoQ10降低H2O2诱导的p53磷酸化水平并升高Bcl-2、Bcl-xL蛋白表达水平Fig.5 CoQ10 reduced H2O2-induced platelet phosphorylation level of p53 and increased Bcl-2 and Bcl-xL expression level.
3 讨论
氧化应激是指细胞暴露于高浓度氧分子或氧的化学衍生物而引起的细胞损伤。H2O2是ROS 的一种,通过作用于膜上受体或直接进入胞内,发挥促氧化作用[11]。氧化应激与代谢综合征密切相关。代谢紊乱人群存在H2O2等氧化代谢产物堆积的现象,循环中氧化应激水平更高,线粒体功能发生紊乱[12]。血小板线粒体是ATP 产生的关键场所,然而,近年来大量研究表明线粒体还参与了能量产生以外的许多过程,如ROS的产生、钙离子稳态、凋亡调节[13]。健康的血小板含有5~8 个线粒体,大多数线粒体必须保持正常,血小板才能维持正常功能。线粒体受损会导致血小板凋亡,诱导动脉血栓形成[14]。因此,保持血小板线粒体的健康至关重要[3]。线粒体功能紊乱可能导致代谢紊乱人群的血栓风险增加[15]。本研究发现,在H2O2的诱导下,血小板氧化应激水平显著升高,线粒体功能紊乱。CoQ10可以显著抑制线粒体膜电位下降,清除ROS和mtROS,抑制血小板凋亡的早期信号。然而CoQ10无法抑制血小板PS外翻,这可能是因为PS外翻的血小板内的线粒体损伤是不可逆的,包括ROS大量生成、线粒体膜的剧烈去极化和线粒体通透性转换孔的形成[16]。这提示针对线粒体损伤应当及早预防、注重早期修复,减少进入凋亡后期的细胞。
p53 蛋白是细胞对于多种损伤产生应答的中心传感器,它能在氧化应激反应中调节细胞的凋亡。体内心梗模型、体外高葡萄糖处理模型中,心肌细胞内丝氨酸(Ser)15 处位点的p53 磷酸化增加[17-18],介导心肌细胞凋亡。氧化应激条件下血小板ROS 累积介导的p53 磷酸化导致线粒体损伤、线粒体膜电位下降,进而参与促进血小板凋亡[19]。通过抗氧化剂NAC 治疗可明显减轻p53 磷酸化导致的线粒体功能障碍[20]。我们的结果发现在H2O2诱导下,血小板p53 磷酸化水平显著升高,CoQ10可以显著逆转这一现象,表明CoQ10可能是通过清除ROS 降低p53 磷酸化水平,发挥抑制线粒体损伤的作用。Bcl-2、Bcl-xL 是Bcl-2 家族抗凋亡蛋白,位于线粒体表面,具有维持线粒体膜稳定的功能[21]。在H2O2诱导下,细胞活力降低,Bcl-2、Bcl-xL 表达量下降[22],药物干预后可显著增加其表达量,抑制H2O2诱导的细胞凋亡[23]。我们的结果与文献一致,氧化应激条件下其表达水平下降,而CoQ10可以恢复其表达水平,避免细胞进入凋亡程序。p53 还可与Bcl-2、Bcl-xL形成两种异二聚体,拮抗其抗凋亡功能[24-25]。因此p53与Bcl-2、Bcl-xL是否通过共定位调控凋亡值得后续研究深入探讨。
CoQ10是存在于各种食物中的脂溶性抗氧化成分,也是重要的内源性细胞组分,参与线粒体能量代谢[26]。作为常见的膳食补充剂,CoQ10具有广泛的抗氧化效应。我们的研究发现CoQ10可以显著抑制p53 的磷酸化,这可能是其发挥抗ROS 的机制之一。本课题组前期研究发现,CoQ10能够提高静息血小板胞内cAMP 水平[10],cAMP 的提高与氧化水平负相关[27],因此这也是CoQ10抗氧化的可能机制。CoQ10对于凋亡早期的线粒体功能紊乱具有显著抑制作用。然而,CoQ10是否通过调节cAMP参与抑制血小板线粒体功能紊乱还有待证实。CoQ10补充具有很高的安全性,长时间大剂量的摄入无毒副作用[28]。CoQ10的体外孵育剂量设置参考前期研究结果,但由于血小板体外培养时间限制,因此我们未能观察CoQ10对线粒体功能的长期保护效应。
综上,本实验证实CoQ10能够抑制H2O2诱导的血小板线粒体功能紊乱,其作用机制与抑制ROS/p-p53 和Bcl-2/ Bcl-xL 信号通路有关。本研究为CoQ10预防线粒体损伤相关的血栓风险提供了理论依据。
