有关二氧化硫知识的梳理与拓展
2022-02-28李晓峰正高级教师
■李晓峰(正高级教师)
二氧化硫是高中化学氧族元素(第ⅥA族)硫的氧化物中最重要的氧化物,具有多种性质,知识涉及面广。为了全面地学习有关二氧化硫的知识,现从性质、制备、环保等多方面对二氧化硫知识进行归纳总结,并适当拓展延伸,来帮助同学们提高学习效率。
一、二氧化硫的性质与知识延伸
【物理性质】二氧化硫为无色、有刺激性气味的有毒气体,密度比空气大,易溶于水。通常状况下,1体积的水可以溶解约40体积的SO2。
注意:(1)在对SO2物理性质的学习中,还要掌握闻气体气味的正确方法,即用手轻轻地在瓶口扇动,使少量气体飘进鼻孔。(2)会设计气体溶于水的探究实验,即将充满气体的试管倒扣到水中,观察描述现象,得结论。(3)熟知SO2可用于抑制酒类中细菌生长,可在葡萄酒中微量添加。
【化学性质】SO2化学性质思维导图(见图1):

图1
1.具有酸性氧化物的通性。
(1)SO2与H2O 反应。
SO2可溶于水,能与水反应生成中强酸H2SO3,化学方程式为SO2+H2OH2SO3。
延伸:H2SO3H++使指示剂变色,SO2能使石蕊试液变红色。注意:SO2不能使指示剂褪色。
(2)SO2与碱反应。
①SO2与NaOH 溶液反应。
a.当NaOH 足量时,反应的化学方程式为SO2+2NaOH==Na2SO3+H2O。
b.当NaOH 不足量时,反应的化学方程式为SO2+NaOH==NaHSO3。
②SO2逐渐通入少量澄清石灰水中。
离子 方程式:SO2+Ca2++2OH-==CaSO3↓+H2O,CaSO3+SO2+H2O==Ca2++HSO-3。
现象:先生成白色沉淀,后沉淀溶解。
延伸:①SO2尾气可用NaOH 溶液吸收。②SO2或CO2逐渐通入少量澄清石灰水中,如何区别这两气体?
(3)SO2可与碱性氧化物或某些盐反应。
①SO2与CaO 反应生成CaSO3,化学方程式为SO2+CaO==CaSO3。
②SO2与Na2SO3溶液反应生成NaHSO3,化学方程式为SO2+Na2SO3+H2O==2NaHSO3。
延伸:烟气脱硫,可在煤中加入一定量的生石灰,以减少SO2的排放。
2.SO2的还原性(主要)。
由于SO2中硫元素处于+4 价,可升可降,氧化性、还原性均具有,多数情况下其还原性占主导。
(1)SO2被O2氧化成SO3,反应化学方程式为2SO2+O2。
延伸:①工业制硫酸的过程中,为防催化剂中毒,在SO2催化氧化前必须净化。②SO2与O2通常情况下不发生反应,可以共存。③由S不能通过一步反应生成SO3。
(2)SO2的水溶液能被X2(Cl2、Br2、I2)氧化,如SO2能使溴水褪色,反应的化学方程式为SO2+Br2+2H2O==2HBr+H2SO4。
(3)SO2的水 溶液能被酸性KMnO4溶液氧化,如SO2能使酸性KMnO4溶液(紫红色)褪色,离子反应方程式为。
(4)SO2能被Fe3+溶液氧化,溶液由浅黄色变为浅绿色。离子反应方程式为2Fe3++。
延伸:①由 反 应SO2+Cl2+2H2O==2HCl+H2SO4,即离子反应方程式为Cl2+,可解释SO2与Cl2等体积混合,通过水蒸气,毒性消失、漂白性丧失,及向二氧化硫的水溶液中通入氯气,溶液酸性增强、导电能力增强等原因。②二氧化硫通入溴水或酸性高锰酸钾溶液,溶液褪色的实质是二氧化硫还原性所致,并不是因为二氧化硫的漂白性。
3.SO2的氧化性(次要)。
将SO2通入氢硫酸(H2S 溶液)中的实验现象:产生淡黄色沉淀。化学反应方程式为2H2S+SO2==3S↓+2H2O。
延伸:①常考查氧化产物及还原产物比值。②可用来举例解释个别酸性氧化物能和酸发生氧化还原反应。③解释可溶性亚硫酸盐(如Na2SO3)与可溶性金属硫化物(如Na2S)在酸性条件下混合产生淡黄色沉淀的原因。
例1下列实验报告记录的实验现象正确的是( )。

解析
SO2溶于水生成H2SO3,溶液呈酸性,通入石蕊试液显红色;通入品红溶液中,品红褪色;c中SO2被氯水氧化为,再生成硫酸钡白色沉淀,同时因Cl2的消耗,溶液变无色。d 中SO2与氢氧化钠反应生成Na2SO3,再生成BaSO3白色沉淀。
答案:C
4.SO2的漂白性。
漂白原理:SO2+H2O+有色物质不稳定无色物质有色物质
特别注意:SO2的漂白具有局限性,不能漂白酸碱指示剂等有色物质。
延伸:①SO2与Cl2的漂白性比较(见表1),两种气体虽然都有漂白性,但原理及现象不同。Cl2的漂白性是由于溶于水生成的HClO 有强氧化性,将有色物质氧化成无色物质,褪色后不能恢复到原来颜色,即永久漂白;而SO2是由于溶于水生成的H2SO3与有色物质直接结合,形成不稳定的无色化合物,褪色后在一定条件下又能恢复原来的颜色,即暂时漂白。②尽管SO2具有漂白性,但它有毒,所以禁止用二氧化硫对食品进行熏制。

表1

续表

图2
例2某学生课外活动小组利用图2所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是____溶液;加热时溶液由红色逐渐变浅的原因是____。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是____溶液;加热时溶液由无色变为红色的原因是_____。
解析
实验装置的特点:试管口上套有气球,说明加热时会有气体逸出。①“红色溶液”可能是溶有酸性气体的石蕊溶液或溶有碱性气体的酚酞溶液。若是前者,加热后溶液由红色变为紫色,不符合“溶液颜色逐渐变浅”的条件,结论只有稀氨水和酚酞。②由无色溶液气体+溶液变气体+溶液无色。加热后放出气体且溶液变红,冷却后该气体可使红色溶液褪色,显然该气体有漂白作用,并且漂白是可逆的,符合条件的无色溶液只能是SO2漂白过的品红溶液。
答案:(1)稀氨水和酚酞 稀氨水中的NH3逸出,所以溶液的颜色变浅
(2)溶有SO2的品红 SO2气体逸出,品红溶液恢复红色
延伸(见表2):

表2

续表
二、二氧化硫的制备
(1)实验室制备。
方法1:实验室采用的是较浓的硫酸和Na2SO3固体,利用强酸制弱酸的原理,其化学方程式为Na2SO3+H2SO4Na2SO4+SO2↑+H2O。
方法2:实验室也可用铜和浓硫酸加热制取二氧化硫,利用浓硫酸强氧化性的原理,其化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。
延伸:上述两种方法尽管都是固体与液体的反应,由于条件不同,装置类型不同。注意:尽管方法1的装置不需要加热,但因Na2SO3呈粉末状,所以不能用启普发生器制备。
(2)工业制备。
方法1:煅烧黄铁矿,化学方程式为4FeS2+11O22Fe2O3+8SO2。
延伸:方法1 也是工业制硫酸的第一步反应,此反应常考氧化还原反应中电子转移的情况,也考查硫酸生产中黄铁矿样品与硫酸的有关计算。
例3如果用硫酸和亚硫酸钠反应制取二氧化硫,并能控制反应速度,图3中可选用的发生装置是____(填写字母)。

图3
解析
因Na2SO3与中等浓度浓硫酸反应不需加热且Na2SO3呈粉末状,所以可选用的发生装置为a和d。
答案:a、d
例4某课外研究性学习小组设计了如图4所示装置制取和验证SO2的性质。请回答下列问题:
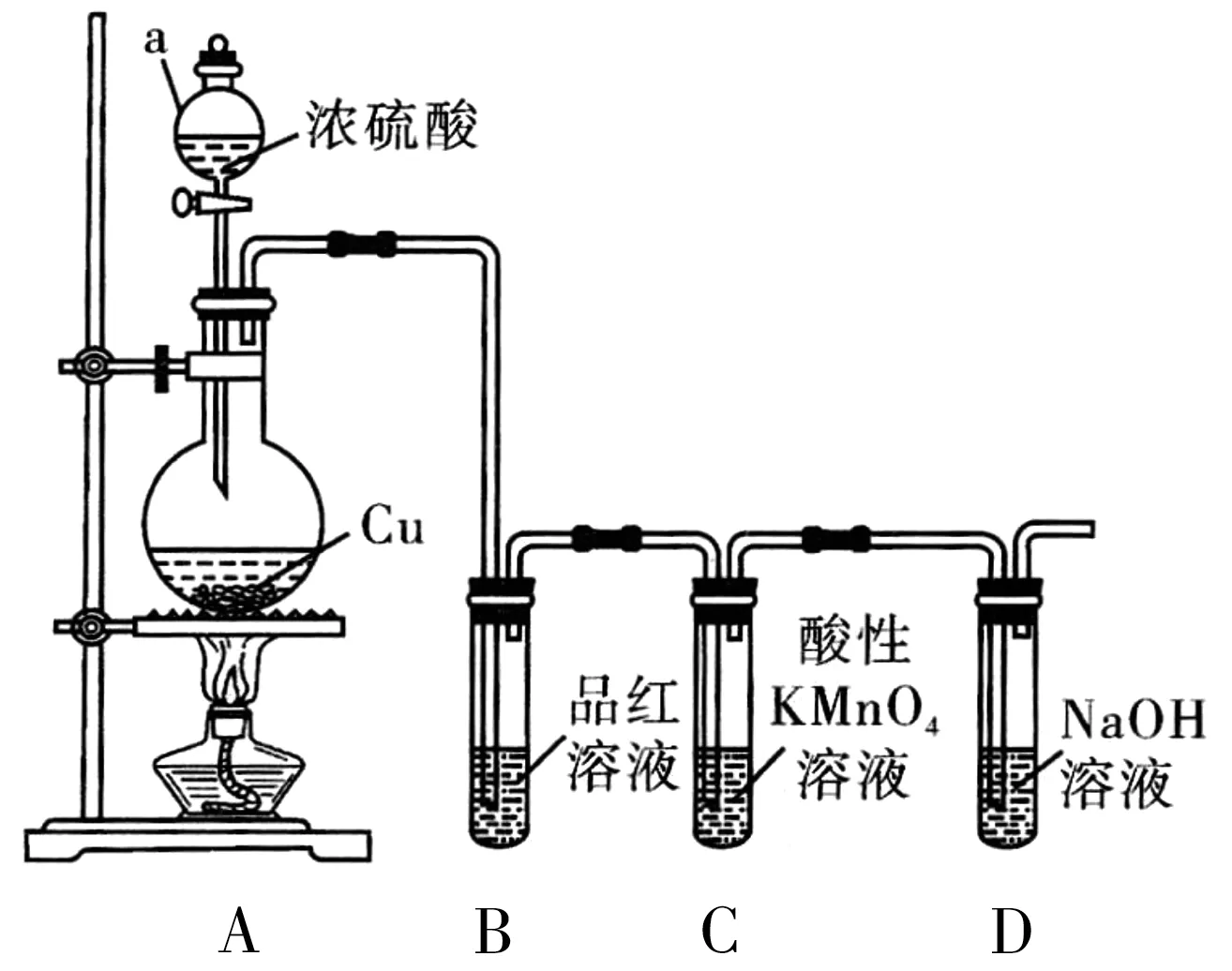
图4
(1)图中仪器a的名称为_____。
(2)A 中发生反应的化学方程式是____。
(3)若C中溶液褪色,体现SO2具有_____性。
(4)过量NaOH 溶液与SO2反应的离子方程式为_____。
(5)向两支装有品红溶液的试管中,分别通入Cl2和SO4,发现两支试管中品红溶液均褪色,请设计实验证明哪支试管中通入的是SO2:___。
(6)该小组继续设计实验,相同条件下将Cl2和SO2两种气体按体积1∶1混合,再通入品红溶液中,观察溶液几乎不褪色。查阅资料知:两种气体按体积1∶1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式为_____。
解析
本实验考查二氧化硫漂白的可逆性及不稳定性,同时也考查二氧化硫的还原性,即可被酸性KMnO4溶液、Cl2等氧化;装置图也体现了二氧化硫尾气的处理。
答案:(1)分液漏斗

(5)将两支试管中的液体加热,恢复红色的液体中通入的是SO2。

三、硫的氧化物(SO2)的污染与治理
(1)来源:化石燃料的燃烧及含硫矿石的冶炼。
(2)危害:危害人体健康,污染大气,形成酸雨(pH 小于5.6)。
(3)治理:开发新能源,燃煤脱硫,改进燃烧技术,处理工业废气。
(4)硫酸型酸雨形成的两个途径:

延伸:酸雨样品放置时,随着时间的推移pH 变小,变化的主要原因是2H2SO3+O2==2H2SO4。
例5某实验小组采集了酸雨样品,随着时间的推移,多次对该样品的pH 进行测定,得到了如表3中的数据。
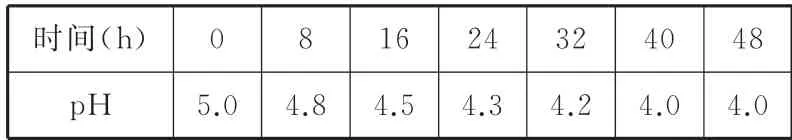
表3
试回答下列问题:
(1)酸雨样品放置时pH 变化的主要原因是(用化学方程式表示)____。
(2)如果将刚取样的上述酸雨和适量自来水混合,pH 将____(填“增大”“减小”或“不变”),原因是(用化学方程式表示)___。
解析
(1)酸雨样品放置过程中H2SO3被空气氧化。(2)和自来水混合,酸雨样品中的H2SO3被自来水中的Cl2氧化。
答案:(1)2H2SO3+O22H2SO4
(2)减小 H2SO3+Cl2+H2O2HCl+H2SO4
四、SO2 尾气处理的四种常见方法
方法1:钙基固硫法(见图5)。为防治酸雨,工业上常用生石灰和含硫的煤混合后燃烧,燃烧时硫、生石灰、O2共同反应生成硫酸钙,从而使硫转移到煤渣中,反应原理为

图5
方法2:氨水脱硫法。该脱硫法采用喷雾吸收法,雾化的氨水与烟气中的SO2直接接触吸收SO2,其反应的化学方程式为2NH3+SO2+H2O==(NH4)2SO3,2(NH4)2SO3+O2==(NH4)2SO4(或生成NH4HSO3,然后进一步氧化)。
方法3:钠、碱脱硫法。钠、碱脱硫法是用NaOH/Na2CO3吸收烟气中的SO2,得到Na2SO3和NaHSO3,发生反应的化学方程式为2NaOH+SO2==Na2SO3+H2O,Na2CO3+SO2==Na2SO3+CO2,Na2SO3+SO2+H2O==2NaHSO3。
方法4:双碱脱硫法。先利用烧碱吸收SO2,再利用熟石灰浆液进行再生,再生后的NaOH 碱液又可循环使用。化学反应原理:①吸收 反应2NaOH+SO2==Na2SO3+H2O,2Na2SO3+O2==2Na2SO4。②再生反应Na2SO3+Ca(OH)2==CaSO3↓+2NaOH,Na2SO4+Ca(OH)2==CaSO4↓+2NaOH。
例6为防治酸雨,降低煤燃烧时向大气排放SO2,工业上将生石灰和含硫煤混合后使用。试写出燃烧时,有关“固硫”反应的化学方程式:___。
解析
煤中含硫,硫燃烧时生成的酸性氧化物SO2与碱性氧化物CaO 作用生成含氧酸盐CaSO3,即CaO+SO2==CaSO3;在有空气存在和高温条件下,CaSO3易被空气中的O2氧化成CaSO4。即2CaSO3+O22CaSO4(注意:该反应易漏写)。
答案:CaO+SO2CaSO3,2CaSO3+O22CaSO4
五、SO2 与CO2 的比较与鉴别
1.SO2与CO2的性质的比较(见表4)。

表4
2.SO2与CO2的鉴别。
SO2与CO2都能使澄清的石灰水变浑浊,若通入的气体过量,则沉淀都可消失。所以不能只用澄清的石灰水鉴别CO2和SO2。通常可用以下方法:
(1)用品红溶液。使品红溶液褪色的为SO2,不能使品红溶液褪色的为CO2。
(2)用氢硫酸。出现浑浊的为SO2,无明显现象的为CO2,2H2S+SO2==3S↓+2H2O。
(3)用酸性KMnO4溶液。紫色褪去的为SO2,无明显现象的为CO2,2KMnO4+5SO2+2H2O==K2SO4+2MnSO4+2H2SO4。
(4)用溴水。使橙色褪去的为SO2,无明显现象的为CO2,Br2+2H2O+SO2==2HBr+H2SO4。
(5)用HNO3酸化的Ba(NO3)2。溶液产生白色沉淀的为SO2,无明显现象的为CO2,2HNO3+3SO2+2H2O==3H2SO4+2NO↑,Ba(NO3)2+H2SO4==BaSO4↓+2HNO3。
(6)用FeCl3溶液,使棕黄色变绿色的为SO2,无明显现象的为CO2。
例7下列溶液能够区别SO2与CO2气体的是( )。
①澄清的石灰水 ②H2S溶液 ③酸性KMnO4溶液 ④氯水 ⑤品红溶液
A.①②③B.②③④
C.②③④⑤ D.全部
解析
SO2与CO2均属于酸性氧化物,它们都能与石灰水反应生成不溶性的盐,所以无法利用这一性质来区别SO2与CO2。但SO2具有氧化性,能将H2S溶液氧化生成单质硫(有淡黄色沉淀生成);同时SO2也具有还原性,能被酸性KMnO4溶液和氯水氧化(溶液褪色);SO2还具有漂白性,能使品红溶液褪色。而CO2没有这些性质。所以可以用②③④⑤来区别SO2与CO2。
答案:C
3.检验SO2和CO2同时存在的一般流程。
由于SO2与CO2都可使澄清的石灰水变浑浊,检验二者同时存在的一般流程如表5所示。
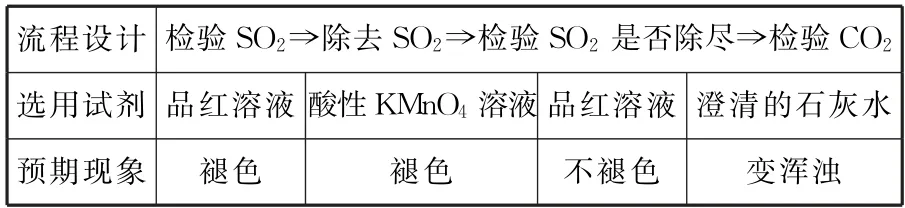
表5
注意:有时为了简化装置,可将除去SO2和检验SO2是否除尽合并为同一装置,并用较浓的酸性 KMnO4溶液,现象为酸性KMnO4溶液颜色变浅。
例8图6是检验某无色气体A 是SO2和CO2的混合气体的装置图,按要求回答下列问题。

图6
(1)B中加入的试剂是_____,作用是_____。
(2)C中加入的试剂是____,作用是____。
(3)D中加入的试剂是____,作用是____。
(4)实验时,C中应观察到的现象是_____。
解析
该题目的是检验某无色气体的成分,检验二氧化硫常用品红溶液,吸收二氧化硫一般可用酸性KMnO4溶液,检验二氧化碳常用澄清石灰水。但还要清楚在检验二氧化碳之前,必须除尽二氧化硫,因为二氧化硫也能使澄清石灰水变浑浊,否则SO2对二氧化碳检验有干扰。C 装置的作用是除去SO2并检验SO2是否除尽,所以在叙述酸性高锰酸钾溶液颜色时只能变浅,但不能褪成无色,若褪成无色则不能证明二氧化硫已除尽。
答案:(1)品红溶液 检验SO2
(2)酸性KMnO4溶液 除去SO2并检验SO2是否除尽
(3)澄清石灰水 检验CO2
(4)酸性KMnO4溶液的颜色变浅但不褪成无色
