胸腔镜治疗低体质量食管闭锁患儿的短中期疗效评价:单中心临床经验
2022-02-27严磊吴典明方一凡
严磊,吴典明,方一凡
福建省儿童医院(上海交通大学医学院附属上海儿童医学中心福建医院,福建省妇幼保健院,福建医科大学附属医院)普通外科,福建福州 350300
先天性食管闭锁发病率约为1/3 000~1/4 000,是一种严重的新生儿消化道畸形[1],其临床特征为母孕期彩超常提示羊水增多,胎儿出生后呕吐大量泡沫,喂养时出现咳嗽、发绀和呼吸费力,如果不及时救治,大多数患儿会在3~5 d内死亡。目前国内外有许多单中心研究报道胸腔镜手术在食管闭锁的治疗中是安全、可行的,但报道的大多数患儿手术体质量>2 500 g,这类正常体质量患儿对胸腔镜手术及麻醉的耐受力好,随着技术的成熟,胸腔镜手术治疗的成功率提高。然而针对低体质量患儿行胸腔镜手术治疗仍是临床面临的重大挑战,其安全性和可行性仍在讨论中。本研究回顾性分析2015年1月—2020年1月因患有食管闭锁而就诊于福建省妇幼保健院小儿外科的46例患儿的临床资料,将不同体质量食管闭锁患儿的临床资料进行对比研究,分析不同体质量的胸腔镜治疗疗效及并发症发生情况,以评估胸腔镜手术在低体质量食管闭锁患儿治疗中的可行性及短中期预后情况。现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析于本院小儿外科住院治疗的46例食管闭锁患儿的临床资料,患儿均接受胸腔镜手术治疗。根据手术时体质量是否低于2 500 g分为低体质量组(11例)和正常体质量组(35例)。两组一般资料对比,差异无统计学意义(P>0.05),具有可比性,见表1。手术均由同一位主任医师完成。本研究通过本院医学伦理委员会批准。手术前均详细告知患儿监护人手术方式选择、相关手术风险及并发症,确认知情并且签署知情同意书后进行手术治疗。
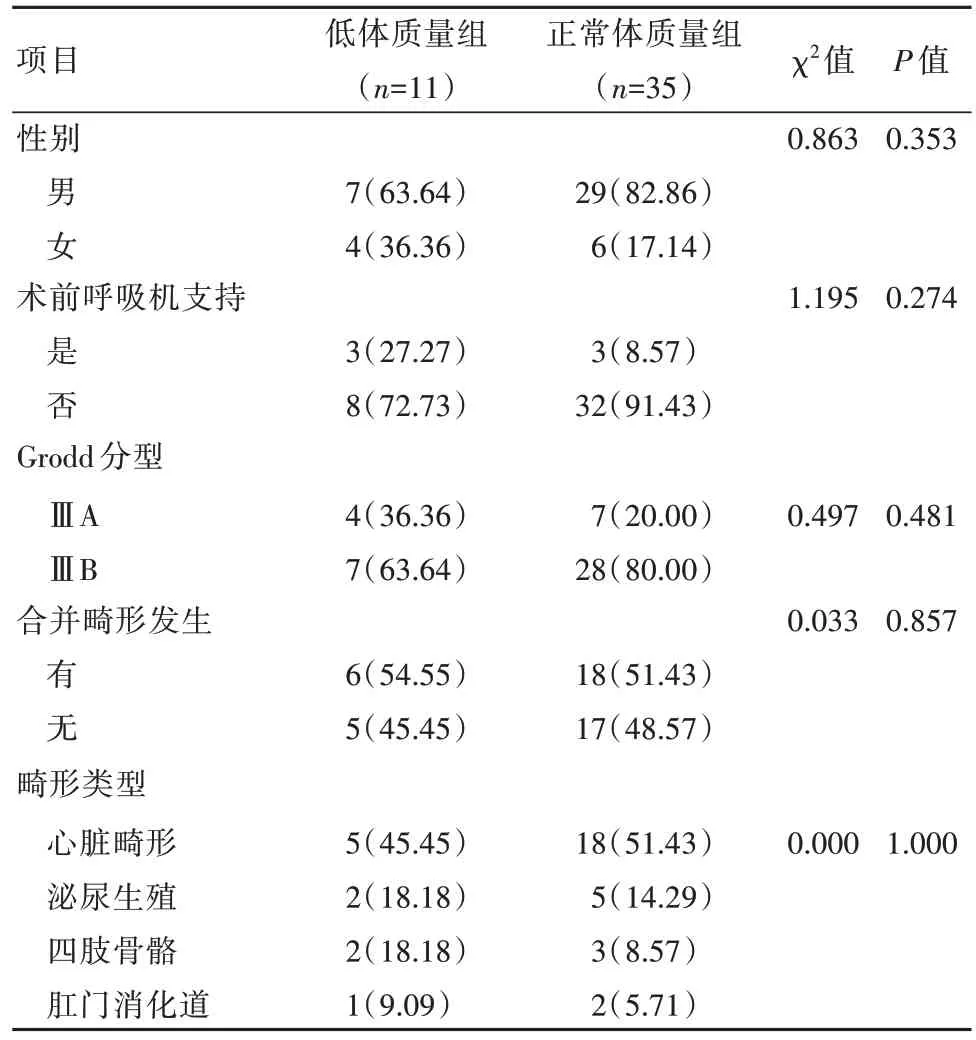
表1 两组患儿一般资料对比[n(%)]Table 1 Comparison of general information between the two groups of children [n(%)]
1.2 纳入与排除标准
纳入标准:①术前诊断为Ⅲ型食管闭锁;②患儿家长了解本研究,自愿参与;③患儿有明确手术指征,无手术禁忌证。
排除标准:①患儿家属因个人原因,不同意手术,放弃治疗;②患儿有手术禁忌证;③患儿的重要临床资料缺失或无法按要求定期于本院随访复查;④患儿术中中转开胸手术。
1.3 方法
1.3.1 术前诊断 术前经鼻或口留置胃管受阻并折返,完善上消化道优维显造影或食管CT三维重建证实为食管闭锁,术前患儿均出现不同程度的吸入性肺炎。
1.3.2 手术方法 食管闭锁一旦诊断明确,均需手术治疗。胸腔镜下Ⅲ型食管闭锁一期成形术:术前取左侧卧位,向左倾斜约45°,右上肢抬高并固定。选择右侧肩胛下角线第4肋间置入1个5 mm Tro⁃car作为观察孔,压力设置为4~6 mmHg(1 mmHg=0.133 kPa),随后分别在腋中线第3及第5肋间各置入1个5 mm Trocar作为操作孔。找到并游离出奇静脉,两端分别用丝线双道结扎后剪断,打开脊柱右侧胸膜找到远端食管,找到食管气管瘘管,用1号丝线双道结扎并缝扎切断食管气管瘘管,嘱麻醉师膨肺,观察右肺复张良好并且无漏气。找到并游离食管近侧盲端直至与远端靠近,去顶剪断食管盲端,用5-0可吸收线间断外翻吻合,食管后壁吻合结束后置入胃管,通过顺畅,最后吻合食管前壁。
1.3.3 术后随访 出院后前3个月,每月随访1次;随后每3个月随访1次至1岁;1岁以后每年随访1~2次。每个随访时间段内需至少进行1次食管吞钡造影以了解术后吞咽功能、是否有吻合口狭窄与漏、是否存在胃食管反流。了解主气管的形态改变以及呼吸功能。配合进行胃镜检查、24 h食管pH值测定、气管CT扫描;其中吻合口狭窄定义为存在临床症状(吞咽困难,吸入或异物梗阻引起的呼吸障碍)并通过内镜或食管造影能够发现狭窄(狭窄指数>0.5,狭窄指数=1-狭窄段直径/远端正常食管直径)。
1.4 观察指标
对比两组的基线资料、手术时间、术中出血量、术后机械通气时间、术后胸腔引流时间、经胃管开始喂养时间、经口开始喂养时间、术后住院时间以及术后的并发症情况和术后3年随访的并发症情况。
1.5 统计方法
采用SPSS 21.0统计学软件进行数据分析。计量资料采用Shapiro-WilkW检验对其进行正态性检验,符合正态分布的计量资料采用(±s)表示,不符合正态分布的计量资料采用中位数(25%位数,75%位数)表示;计数资料用[n(%)]表示,进行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患儿手术情况及术后治疗情况对比
两组患儿均成功完成手术,无中转开胸手术。低体质量组在出生体质量、手术体质量方面明显低于正常体质量组,差异有统计学意义(P<0.05)。两组孕周、手术日龄、手术时间、术中出血量、术后机械通气时间、术后胸腔引流时间、术后经胃管开始鼻饲时间、术后经口开始喂养时间、术后住院时间比较,差异无统计学意义(P>0.05)。见表2。
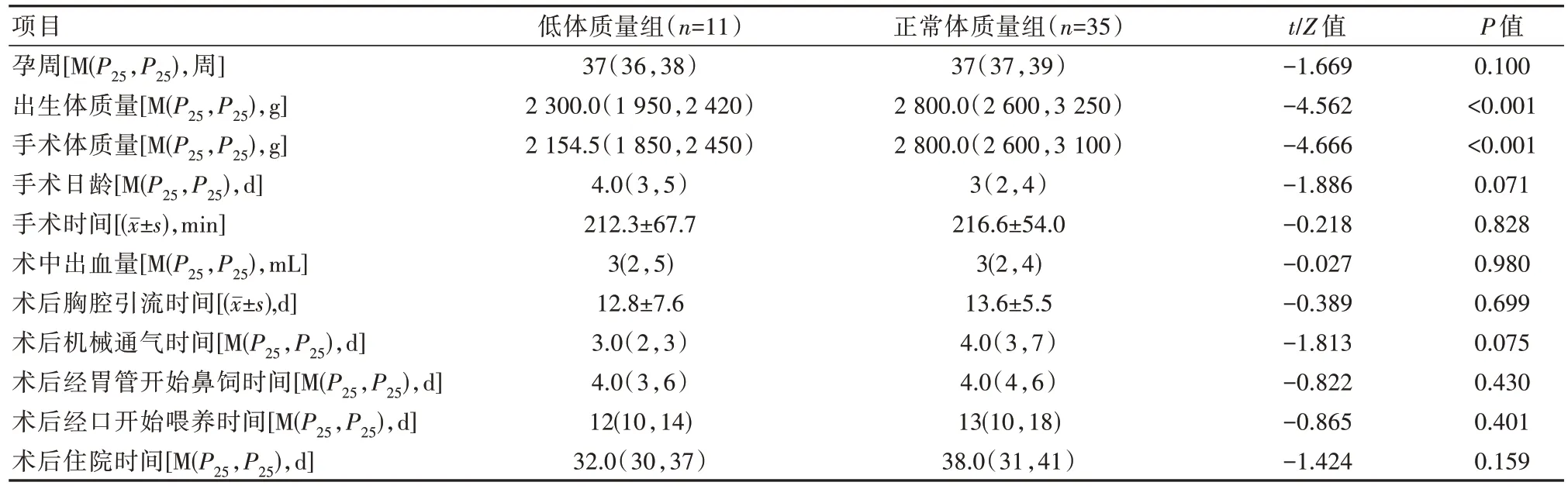
表2 两组患儿手术情况及术后治疗情况对比Table 2 Comparison of operation and postoperative canditions between the two groups children
2.2 两组患儿术后并发症情况对比
低体质量组食管吻合口瘘发生率18%,正常体质量组发生率为8%,低体质量组吻合口狭窄发生率为54%,正常体质量组发生率为48%,差异无统计学意义(P>0.05)。见表3。低体质量组3例患儿因术后并发症办理自动出院,正常体质量组2例患儿因术后并发症办理自动出院。术后3年随访低体质量组失访3例,正常体质量组失访5例。低体质量组气管软化发生率为38%,高于正常体质量组发生率7%,但差异无统计学意义(χ2=2.903,P=0.088),两组胃食管反流、有症状性食管狭窄发生率对比,差异无统计学意义(P>0.05)。见表4。

表3 两组患儿术后并发症情况对比 [n(%)]Table 3 Comparison of postoperative complications between the two groups of children [n(%)]

表4 两组患儿术后3年随访并发症情况对比 [n(%)]Table 4 Comparison of postoperative complications between the two groups of children at 3 years follow-up [n(%)]
3 讨论
胸腔镜辅助下治疗先天性食管闭锁已有20年的历史,但国内起步较晚,目前仍然被很多小儿外科医生认为是极具挑战性的手术[2-3]。虽然胸腔镜手术存在明显的学习周期,但却具有潜在优势,包括手术切口小、手术胸廓畸形发生率低。一项48篇文章荟萃分析发现:胸腔镜手术修复食管闭锁并食管气管瘘是安全的。与开胸手术相比,胸腔镜组的病死率并没有增加。尽管胸腔镜手术的时间更长,但吻合口漏发生率、术后食管狭窄和胃食管反流的发生率均与开胸手术相当[4]。
目前国际及国内众多专家提出了胸腔镜手术治疗的禁忌证,包括长间隙的食管闭锁、低体质量患儿及合并严重先天性心脏病及重症肺炎[5-6]。低体质量儿指术前体质量不足2 500 g的新生儿,斯坦福大学医学院一项单中心研究发现,通过腔镜手术治疗8例体质量低于3 kg食道闭锁患儿,相比较开放手术同样可以取得相近的治疗效果[7]。因此本文单独针对低体质量患儿行胸腔镜治疗的可行性进行分析,同时也对其术后长期临床预后及生存质量进行评估。
本院收治的11例低体质量食道闭锁患儿,其出生体质量为2 300.0(1 950.0,2 420.0)g,其中6例合并有不同程度畸形,发生率为54%,其中心脏畸形发生比例最高,略低于Son J等[8]文献中提到的7例中有6例患有心血管异常,发生率为86%。因为伴有心肺发育不成熟、生理机能不健全,低体质量儿手术具有极大的麻醉风险。同时低体质量患患儿多数存在体格发育瘦小,胸腔操作空间不足等问题,提高了胸腔镜手术的难度。随着术中麻醉观念的革新及术中腔镜操作的成熟,低体质量新生儿接受胸腔镜手术治疗的机会增多,存活率日渐增高,更多医生也在尝试让低体质量患儿行胸腔镜手术治疗。本院术前低体质量组需要呼吸机支持的比例约为27%,高于正常体质量组的10%,但差异无统计学意义(P>0.05),本研究认为这可能与低体质量患儿多为低孕周,常合并肺部发育不全有关,因此术前需呼吸机支持避免误吸引起呼吸衰竭。但术后通过合理气道管理,可以尽早撤机,因此两组术后机械通气时间方面比较,差异无统计学意义(P>0.05)。
高碳酸血症是新生儿胸腔镜手术中容易出现的病理状态之一,术前合并有严重肺炎的新生儿或肺发育不良的早产儿更容易出现[9-10]。相关学者指出,胸腔镜手术中的二氧化碳吹入可能导致血流动力学改变,例如低血压,心动过速等。另外,胸腔镜气胸的建立可能导致血氧饱和度降低[7,11]。胸腔镜手术时使用允许性高碳酸血症的通气策略,将CO2人工气胸压力控制在4~6 mmHg,减轻肺萎陷的发生,减小对新生儿生命体征的影响,同时也保证一定胸腔操作空间。van Hoorn CE等[12]分析101例术前食道闭锁患儿的管理,提出术前注意肺炎情况,明确有无气管软化,术中注意肺部管理,选取合适的手术体位,均有助于改善患儿的麻醉耐受力。因此通过先进的麻醉管理,可以在保证手术视野不被干扰的同时,使得患儿血氧波动维持在90%左右,保证手术顺利进行。
借助胸腔镜可以使术者获得更清晰的手术视野,放大的手术视野可以使术者在游离食管时更彻底,缝合食管时更精细[13]。新生儿本身胸腔容积较小,同时有肺叶遮挡,因此可操作空间不大,呼吸运动更是会干扰手术操作,因此要求术者具备娴熟的胸腔镜操作经验和丰富的解剖知识[14]。正常体质量组的手术时间为(216.6±54.0)min,而低体质量组的手术时间为(212.3±67.7)min,虽然低体质量组的手术难度较大,但是两组手术时间比较,差异无统计学意义(P>0.05),这可能是因为低体质量组多为近年开展的手术患儿,手术过程存在一个重要学习曲线,可能影响手术结果。此外,其余术后结果两组之间比较,差异无统计学意义(P>0.05),可见两组手术效果相近。
食管闭锁术后并发症一直困扰着小儿外科医师,影响患儿的生存质量。常见的并发症有食管吻合口瘘、吻合口狭窄、胃食管反流、食管吻合口瘘复发、呼吸道疾病等[15-16]。两组术后食管吻合口瘘及术后食管狭窄发生率对比,差异无统计学意义(P>0.05)。食管闭锁术后食管狭窄的发生率较高,低体质量组为6例(54%),正常体质量组为17例(48%),主要影响因素是食管盲端距离、吻合口漏及术后胃食管反流。同时因术前吻合口近端食管扩张明显,食管闭锁术后早期食管造影有一定程度的吻合口狭窄,有研究提出早期术后改变引起的狭窄(或称无症状狭窄),并不预示远期狭窄形成,无需预防性扩张[17-18]。因此针对无症状狭窄,不提倡术后预防性扩张,这有可能增加患儿的痛苦。
术后3年随访发现两组胃食管反流、有症状性食管狭窄等并发症发生率比较,差异无统计学意义(P>0.05)。Dai DL等[19]报道食道闭锁患儿中有43例(46.7%)在长达10年的随访中因胃食管反流需要进行抗酸治疗,这与手术组发生胃食管反流比例(50.0%)相当。胃食管反流均通过使用抑制胃酸的药物、进食稠厚食物、体位治疗来治疗,均无需再次手术。低体质量组4例及正常体质量组12例食管狭窄的患儿均接受3~9次胃镜下食道扩张。在气管软化方面低体质量发生率高于正常体质量组,但差异无统计学意义(P>0.05),考虑到低体质量患儿因孕周未足月导致肺部及气道发育不良,后期出现气管软化发生率较高,但是还需要更多的病例数支持。低体质量组3例及正常体质量组2例患儿术后均需长期进行药物雾化治疗,未进行手术治疗。
研究也存在一定局限性,研究为回顾性研究,研究例数较少,收集的多数低体质量患儿的术前体质量在2 100 g左右,缺乏更低体质量患儿接受手术治疗的随访,随着目前低胎龄及低出生体质量儿的增加,针对极低手术体质量患儿是否能顺利进行胸腔镜食管闭锁手术是进一步研究方向。结合治疗经验,考虑到低体质量对手术的影响,对于病情较复杂及体质量极低的患儿,可以考虑通过空肠造瘘行肠内营养增加术前体质量,尽量达到适合胸腔镜治疗条件行分期手术治疗。希望此发现有助于扩展腔镜治疗患者标准的选择,使更多低体质量患儿能顺利接受微创手术治疗。为此可能需要收集更多病例进行分析。
综上所述,针对于低体质量新生儿,只要术前未合并严重心脏畸形及肺部感染,能耐受术中麻醉,行胸腔镜治疗食道闭锁的术中和术后结果与正常体质量患儿相当。低体质量不再是限制食道闭锁患儿行胸腔镜手术的条件,当手术者拥有丰富的胸腔镜操作经验情况时是可行的选择。胸腔镜治疗食道闭锁患儿的术后中期并发症主要是食管狭窄、胃食管反流及气管软化。其中食管狭窄需要接受术后胃镜引导下食管扩张。
