白茶多酚对D-半乳糖致小鼠肾损伤模型的改善作用
2022-02-25李冲杨悦骞宇赵欣
李冲,杨悦,骞宇,赵欣*
1(重庆第二师范学院重庆市功能性食品协同创新中心,重庆,400067)2(重庆第二师范学院重庆市功能性食品工程技术 研究中心,重庆,400067)3(重庆第二师范学院功能性食品研发重庆市工程实验室,重庆,400067) 4(重庆第二师范学院 生物与化学工程学院,重庆,400067)
氧化损伤是机体在生长过程中限制其正常生长的一个主要因素,机体损伤是指通过不同的机制引起细胞炎性因子的增加,氧化水平越高其机体损伤程度越重[1]。反映机体内氧化应激水平的标志物有谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)、总抗氧化能力(total antioxidant capacity,T-AOC)、过氧化氢酶(catalase,CAT)和一氧化氮(nitric oxide,NO),GSH-Px作为机体内广泛存在的一种重要的催化过氧化氢分解的酶,可以起到保护细胞膜结构和功能完整的作用[2-3]。细胞因子IL-6、IL-10、TNF-α、IFN-β和IFN-γ在调节免疫反应中发挥关键作用,而机体及其器官损伤以慢性低级别炎症为特征,因此可以通过测量炎症水平来评价白茶多酚对D-半乳糖诱导的小鼠肾损伤的改善作用。
D-半乳糖是目前用来建立亚急性衰老模型的工具药,并被广泛地应用于药物抗衰老的研究之中[4]。它能够在机体内参与葡萄糖代谢,但是如果摄入过量或在体内积聚过多会导致葡萄糖代谢紊乱从而引起血糖水平升高、加重机体的氧化损伤程度和通过分泌IL-6、TNF-α、IFN-γ等炎症细胞因子引起炎症[5-6]。D-半乳糖也可直接引起肾脏组织复制性衰老,如肾脏结构被破坏,坏死细胞增多,炎性细胞浸润,进而可导致肾功能减退[7]。D-半乳糖可在半乳糖氧化酶的作用下,转化为过氧化氢和醛糖,从而产生大量的超氧阴离子自由基,导致机体内的生物大分子氧化损伤,损害机体健康[8-9]。
白茶原产于福建福鼎地区,属微发酵茶,是中国茶农创制的传统名茶,中国六大茶类之一。茶多酚是其中的一种活性成分,具有高效的抗氧化、抗炎、抗肿瘤、防止动脉粥样硬化和老年痴呆、降低血脂血糖体重等作用[10]。茶多酚是茶叶中一类多羟基类化合物,由30多种含酚基的物质组成,其中儿茶素含量最高[11]。研究表明茶多酚是一种强抗氧化剂,可有效地改善D-半乳糖诱导的小鼠肾损伤的程度。
因此,本研究考察了白茶多酚的作用机制,并以D-半乳糖作为诱导剂,建立小鼠肾损伤模型,考察不同浓度白茶多酚对小鼠肾损伤模型的改善作用,同时对其中的活性成分进行了测定并作分析,为白茶多酚改善小鼠肾损伤导致的相关疾病提供一定的参考数据。
1 材料与方法
1.1 材料与试剂
雄性小鼠(24±5) g,重庆医科大学实验动物中心,本研究经重庆市功能性食品协同创新中心伦理委员会批准实施(20200625B)。
白茶(规格:100 g),福鼎仙居林生态茶业有限公司。
D-半乳糖,上海国药化学试剂有限公司;DPPH,东京化成工业株式会社;MDA、CAT、GSH-px、NO、T-AOC试剂盒,南京建成生物工程研究所;白细胞介素(IL-6、IL-10)、干扰素(TNF-α、IFN-β、IFN-γ),北京诚林生物科技有限公司;FL-3大孔树脂,天津欧瑞生物科技有限公司;ABTS、无水乙醇、PBS(0.01 mol/L)、七水合硫酸亚铁、二甲苯、甲醛、二甲基亚砜、过硫酸钾,上海源叶生物科技有限公司。
1.2 仪器与设备
BioMate 3S UV-Visible光度计、UltiMate3000 HPLC、QuantStudioTM6 Flex聚合酶式反应(polymerase chain reaction,PCR)仪,美国Thermo Fisher Scientific公司;EYELA N-1001S旋转蒸发仪,日本东京理化器械株式会社;KQ-250ES超声波清洗器,昆山市超声仪器;Centrifuge 5418R冷冻离心机,德国Eppendorf公司;ELx808酶标仪,美国Bio-TeK公司;FLUOstar OPTIMA荧光酶标仪,德国BMG公司;BY-R16离心机,北京白洋医用离心机有限责任公司;SCSJ-Ⅱ-40L纯水机,山东博科生物产业有限公司;水浴锅,无锡玛瑞特科技有限公司;WK-10B粉碎机,青州市迈德森制药机械厂;XY-GZL烘箱,上海昕仪仪器仪表有限公司;SHB-ⅢS型台式循环水式多用真空泵,郑州长城科工贸有限公司;PR224ZHE分析天平,奥豪斯仪器(上海)有限公司。
1.3 实验方法
1.3.1 白茶提取物的制备
提取方法采用乙醇水浴浸提:将白茶样品烘干,粉碎、研磨后过筛(100目),然后用万分之一天平精密称取一定量白茶粉末于烧杯中,加入20倍体积的80%(体积分数)乙醇,60 ℃水浴2.5 h,重复3次,抽滤,收集液体备用,并使其过FL-3大孔树脂(80%乙醇洗脱至无色)。将过树脂后的液体通过旋转蒸发仪(60 ℃)除去水分和乙醇(蒸至烧杯无液体流动为止),于60 ℃恒温干燥48 h。将烘干样品取出,研磨、称重后封存于干净的EP管中,放置于4 ℃环境中,备用[12]。
1.3.2 体外抗氧化实验
1.3.2.1 DPPH自由基清除实验
将0.5 mL不同质量浓度(0.06、0.08、0.10 mg/mL)的白茶多酚添加到2 mL的DPPH乙醇溶液(0.335 mmol/mL,通过预实验得到),混合后在室温条件下黑暗中静置30 min,在517 nm处测定溶液的吸光度[13]。每组3个平行,DPPH自由基清除率计算如公式(1)所示:
(1)
式中:Ai,DPPH工作液+白茶多酚OD值;Aj,空白校正,白茶多酚+乙醇OD值;Ao,空白对照,DPPH工作液+乙醇OD值。
1.3.2.2 ABTS阳离子自由基清除实验
ABTS阳离子自由基工作液配制:A液:将3 mg的ABTS加入0.8 mL双蒸水中,充分混匀、溶解;B液:将1 mg的过硫酸钾加入1.5 mL双蒸水中,充分混匀、溶解;各取A、B液0.2 mL混合后,黑暗中放置氧化12 h,用无水乙醇稀释至在734 nm处测的OD为0.7±0.02[14]。结果表明,20倍稀释时可达到实验要求。
ABTS阳离子自由基清除实验:向2.5 mL的EP管中加入1 mL的ABTS阳离子自由基工作液,加入0.4 mL不同质量浓度(0.008、0.010、0.030 mg/mL)的白茶多酚,在黑暗中放置30 min,于734 nm处测定OD值。每组3个平行,ABTS阳离子自由基清除率计算如公式(2)所示:
(2)
式中:Ae,ABTS工作液+白茶多酚样液OD值;Af,空白校正,白茶多酚样液+无水乙醇OD值;Ag,空白对照,ABTS工作液+无水乙醇OD值。
1.3.3 动物
昆明雄性小鼠40只(6周龄),将其饲养在恒温[(25±2) ℃]和相对湿度[(50±5)%]的受控设施中,给予12/12 h的明暗周期,让其自由食用标准鼠粮和水。
1.3.4 小鼠肾损伤模型的诱导
让新购入的小鼠适应环境1周后,随机分为4组(正常组、模型组、低剂量组、高剂量组),每组10只。所有组均正常饮食和水,为期6周,正常组小鼠腹腔注射生理盐水,另外 3组小鼠腹腔注射D-半乳糖120 mg/(kg·d)(0.1 mL/10g小鼠体重)[15],时间为6周。低剂量组小鼠灌胃250 mg/(kg·d)白茶多酚溶液,高剂量组小鼠灌胃500 mg/(kg·d)白茶多酚溶液,注射或口服剂量为0.2 mL,每日1次,所有组小鼠均正常饮食。通过参考文献以及预实验证明白茶多酚浓度选择对小鼠无明显致死作用[16]。该动物试验方案经重庆第二师范学院重庆市功能食品协同创新中心动物伦理委员会批准。
1.3.5 收集样本
按照D-半乳糖诱导模型方法喂养6周后,最后1次灌胃后将其禁食24 h处死。采取摘眼球取血,等小鼠完全死后迅速进行解剖,得到肾组织,切除肾器官周围脂肪和结缔组织,并用生理盐水清洗残余血液及其他杂质,准确称取肾器官重量并记录数据。切除小部分肾脏组织固定于10%(体积分数)甲醛溶液中保存用于后续制作切片。其余保存在-80 ℃为后续实验备用。
1.3.6 组织学观察
通过苏木精-伊红染色法进行。肾脏组织用10%甲醛溶液固定后,用不同浓度梯度的乙醇溶液进行梯度脱水,脱水后的组织用二甲苯和酒精混合液处理再进行透蜡,最后进行包埋、切片与染色,然后显微观察。
1.3.7 肾组织中生化指标的测定
1.3.7.1 肾组织匀浆
取出-80 ℃下放置的小鼠肾脏组织,待其解冻后,用冰冷的生理盐水漂洗,除去血液,滤纸拭干,然后精密称取0.1 g,置于匀浆管中,加入1 mL的生理盐水上匀浆机混匀制成10%的肾组织匀浆,再用普通的离心机离心取上清液待测。多余的放入-80 ℃备用。
1.3.7.2 测定方法
采用试剂盒检测肾脏组织中生化指标GSH-Px、CAT、T-AOC、NO、MDA。具体操作方法参照各试剂盒说明书。
1.3.8 肾脏组织中细胞因子的测定
取用1.3.7.1中备用的肾脏组织匀浆,使用酶联免疫吸附试剂盒(ABCAM,美国)测定细胞因子IL-6、IL-10、IFN-α、IFN-β、IFN-γ的水平。具体操作方法参照各试剂盒说明书。
1.3.9 化学标准
隐绿原酸、表儿茶素、山柰苷、对香豆酸,北京普天同创生物科技有限公司;没食子儿茶素没食子酸酯,上海金穗生物科技有限公司;芦丁,广州分析测试中心科力技术开发公司。
1.3.10 高效液相色谱分析
1.3.10.1 样液制备和色谱条件
精密称取0.1 g的白茶粉末于10 mL容量瓶再加入二甲基亚枫(dimethyl sulfoxide,DMSO)溶液定容至刻度线混匀30 s,得到质量浓度为10 mg/mL的溶液,再用50%(体积分数)甲醇稀释至2.0 mg/mL。样液过0.22 μm滤膜过滤至棕色液相小瓶中,上机测试。色谱柱:Accucore C18柱(5 μm,4.6 mm×250 mm)。流动相A:0.5%(体积分数)的乙酸水,流动相B:乙腈,流速1.2 mL/min,柱温25 ℃,检测波长285 nm,进样体积10 μL。梯度洗脱条件为:平衡阶段10% B为10 min(等梯度);10%~90% B为0~30 min(线性梯度),90% B为30~35 min(等梯度);90%~10% B为35~40 min(线性梯度)。
1.3.10.2 标准曲线的测定
精密吸取50 μL各标准溶液隐绿原酸(0.4 mg/mL)、没食子儿茶素没食子酸酯(1 mg/mL)、表儿茶素(2.2 mg/mL)、芦丁(1.5 mg/mL)、山柰苷(1 mg/mL)、对香豆酸(1.15 mg/mL)于EP管中制成300 μL的原标溶液,再加入50%甲醇溶液700 μL混匀,于1.3.10.1中色谱条件下分别进样10、8、6、4、2 μL,测定其峰面积,以各标准品实际进样量(μg)为横坐标,峰面积为纵坐标,做标准曲线。
1.3.10.3 重现性实验
精密称取白茶,按照1.3.10.1中方法配制成2 mg/mL样品溶液,过滤,用移液枪吸取1 mL过0.22 μm滤膜后置棕色色谱瓶中,重复进样6次,每次进样10 μL,在相同色谱条件下进行测定,计算6次峰面积的相对标准偏差(relative standard deviation,RSD)。
1.3.10.4 回收率试验
精密称取白茶试样,按照1.3.10.1中方法配成2 mg/mL的样品溶液,并各取900 μL样品溶液于6个EP管中,再分别取隐绿原酸(0.4 mg/mL)、没食子儿茶素没食子酸酯(1 mg/mL)、表儿茶素(2.2 mg/mL)、芦丁(1.5 mg/mL)、山柰苷(1 mg/mL)、对香豆酸(1.15 mg/mL)标准溶液各100 μL混匀,过0.22 μm滤膜,转置于色谱瓶中在相同色谱条件下进行测定,从而计算其回收率。
1.4 数据统计分析
实验数据采用SPSS 20.0统计软件进行计算,结果采用Duncan多重比较和单因素方差分析,P<0.05认为有统计学意义。所有的实验均重复3次,数据以平均数±标准偏差来表示。
2 结果与分析
2.1 白茶多酚的抗氧化活性
DPPH是一种极稳定的自由基,能够接受电子或氢自由基的单电子并成为稳定的抗磁电子,它也能使乙醇溶液从深紫色变成黄色,且变色程度与其接受电子数量呈定量关系[17]。如图1所示,清除实验表明0.10 mg/mL的白茶提取物对DPPH自由基有68%(P<0.05)的清除能力,高于0.08 mg/mL组的47%(P<0.05)和0.06 mg/mL组的34%(P<0.05)。
正解:焰色反应呈黄色说明该物质中一定含钠元素,既可能是金属钠,也可能是钠的化合物;钠的黄光对观察钾的焰色有干扰,必须透过蓝色的钴玻璃滤去黄光后才能观察有无钾元素。
ABTS是一种过氧化氢酶的底物,ABTS/ABTS阳离子自由基的氧化还原电位为0.68 V,容易发生电子转移,生成稳定的绿色ABTS阳离子阳离子自由基,可以通过检测样品对ABTS阳离子自由基的清除能力了解其抗氧化性强弱[18]。如图1所示,0.030 mg/mL的白茶多酚对ABTS阳离子自由基有58.0%(P<0.05)的清除能力,高于0.010 mg/mL组的42.9%(P<0.05)和0.008 mg/mL组的38.9%(P<0.05)。
综上,白茶多酚质量浓度越高其清除自由基能力越强(P<0.05),表明白茶多酚对2种自由基的清除能力具有剂量依赖关系,其浓度与清除能力大小呈正相关,且存在显著性差异(P<0.05)。
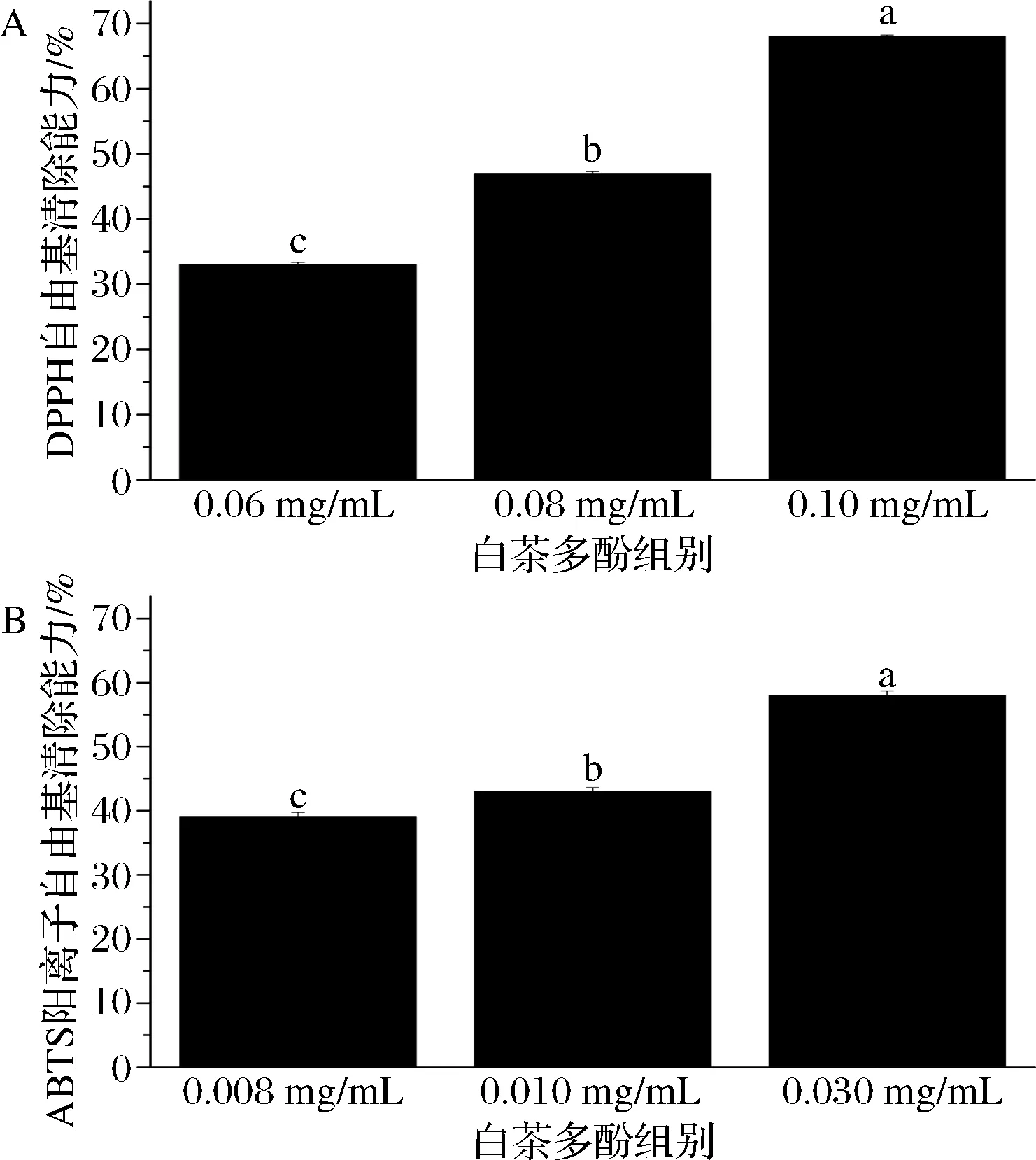
A-DPPH自由基清除能力;B-ABTS阳离子自由基清除能力图1 白茶多酚对DPPH自由基、ABTS阳离子自由基清除能力Fig.1 The scavenging ability of white tea polyphenols on DPPH radical,ABTS cationic radical 注:不同小写字母表示显著性差异(P<0.05)(下同)
2.2 小鼠肾脏器官系数的观察
器官系数是毒理学实验中常用的重要指标,器官系数减小,表明器脏萎缩及其他退行性改变等,而器官系数增大则表明器脏水肿、充血或增生肥大等[19]。因此观察小鼠器官指数的变化对判断小鼠衰老具有重要参考价值。如表1所示,与正常组相比,模型组的小鼠肾脏系数明显下降,而经由白茶多酚[250、500 mg/(kg·d)]处理后,其肾脏系数有所升高,其中高剂量组[500 mg/(kg·d)]效果最好。与正常组相比,模型组、低剂量和高剂量组P值均小于0.01,说明测定结果的差异有统计学意义。
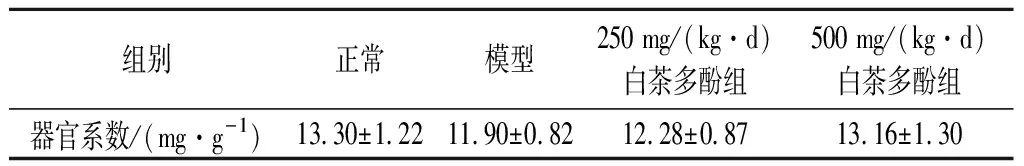
表1 白茶多酚对D-半乳糖诱导的小鼠肾脏系数的影响Table 1 Effects of white tea polyphenols on renal organ coefficients induced by D-galactose in mice
2.3 组织学分析
肾脏是人体重要的排泄器官,它可以通过生成尿液来清除体内水溶性代谢产物及某些废物、毒物,也对电解质、水,与酸碱平衡调节和各种生物活性物质分泌有着重要的作用,如果肾功能衰竭会对人体产生很严重的危害[20-21]。经过实验发现由D-半乳糖诱导的小鼠发生了严重的肾损伤,通过对肾脏组织切片的观察发现肾脏组织的形态发生了较大的变化。如图2所示,正常组肾脏组织细胞内肾小球大多呈球形或椭圆形,形态比较规则,肾小管的结构也比较完整清晰,细胞染色均匀,炎症较轻。而模型组细胞肾小球,形态不规则,肾小囊腔面积增大,细胞排列杂乱没有规则,且细胞染色不均匀,有严重炎症。经白茶多酚[250、500 mg/(kg·d)]处理后,小鼠肾脏细胞较模型组排列有序,且形态略变规则,肾小球,肾小囊腔面积均减小,炎症情况有所改善,其中[500 mg/(kg·d)]白茶多酚处理的小鼠肾脏较[250 mg/(kg·d)]效果更好。并且与模型组相比,白茶多酚处理的小鼠肾脏细胞髓袢更为规则,其形态结构及排列规则与正常组更相近。
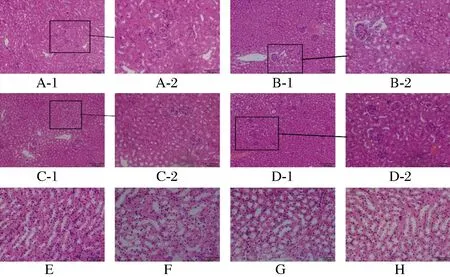
图2 不同剂量白茶多酚处理对小鼠肾损伤细胞的影响Fig.2 Effects of different concentrations of white tea polyphenols on rat damaged renal cells 注: A-1:正常组(×40倍数);A-2:正常组(×200倍数);B-1模型组 (×40倍数);B-2:模型组(×200倍数);C-1:250 mg/(kg·d) 白茶多酚组(×40倍数);C-2:250 mg/(kg·d)白茶多酚组(×200倍数); D-1:500 mg/(kg·d)白茶多酚组(×40倍数);D-2:500 mg/(kg·d) 白茶多酚组(×200倍数);E: 正常组髓袢;F: 模型组髓袢;G: 250 mg/(kg·d) 白茶多酚组髓袢;H: 500 mg/(kg·d)白茶多酚组髓袢
2.4 白茶多酚处理后小鼠肾损伤细胞中MDA、NO、CAT、GSH-Px、T-AOC含量变化
MDA是机体内脂质过氧化反应的代谢产物,其含量高低能反应机体过氧化程度,会引起蛋白质、核酸等生命大分子的交联聚合,且具有细胞毒性,在体外会影响线粒体呼吸链复合物及线粒体内关键酶活性[22]。如图3所示,与正常组相比,模型组肾脏组织中MDA、NO含量明显升高,差异有统计学意义(P<0.05)。与模型组相比,经白茶多酚[250、500 mg/(kg·d)]处理组肾脏组织MDA和NO含量均有所下降,500 mg/(kg·d)剂量组含量最低,差异有统计学意义(P<0.05)。正常情况下,机体的氧化和抗氧化处于动态平衡状态,然而当这种平衡被打破时,外界的刺激很容易导致机体产生氧化应激损伤,进而产生大量的过氧化物危害身体健康[23]。NO是一种化学性质活泼的自由基,半衰期短,能够传递生物信息,维持体内微循环内环境恒定和保护机体非特异性免疫功能,其异常会引起相关疾病的发生,且浓度会随年龄的增长而增加[24]。
CAT是生物体内重要的抗氧化酶,可以清除机体内的H2O2,保护细胞免受过氧化物的侵害,根据其蛋白结构和氨基酸序列的异同可以分为单功能CAT、双功能CAT、锰CAT,大量研究结果表明单功能CAT在机体抗氧化、生长发育、抵御疾病的氧平衡方面起着重要作用[25]。GSH-Px是一种过氧化物分解酶,能将体内的H2O2和脂质过氧化物代谢为水和相应的惰性醇,并且能够催化GSH变为GSSG,使有毒的过氧化物还原成无毒的羟基化合物,从而保护细胞和组织过氧化损[26]。T-AOC 能够反映机体防御系统的总抗氧化能力。与正常组比较,模型组小鼠肾脏组织中T-AOC、GSH-Px、CAT活力均有显著的降低(P<0.05)。与模型组相比,在不同质量浓度(250、500 mg/mL)的白茶多酚处理后,小鼠肾脏组织中T-AOC、GSH-Px、CAT含量均有所提高(P<0.05),并且高剂量的白茶多酚处理效果更好。
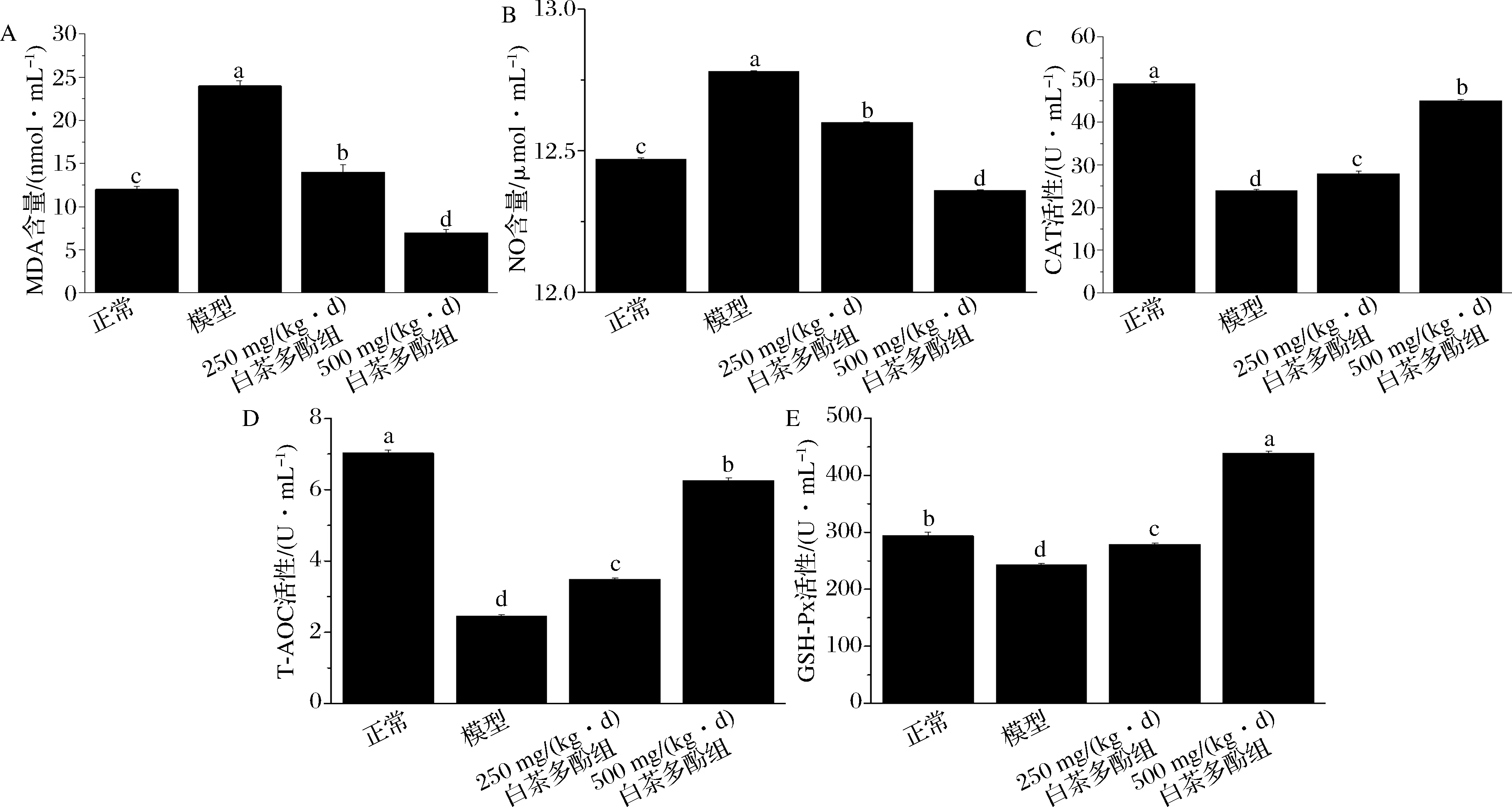
A-MDA;B-NO;C-CAT;D-T-AOC;E-GSH-Px图3 白茶多酚对肾损伤细胞内MDA、NO、GSH-Px、CAT、T-AOC含量的影响Fig.3 Effects of white tea polyphenols on the contents of MDA, NO, GSH-PX, CAT and T-AOC in renal damaged cells
2.5 白茶多酚处理后小鼠肾损伤细胞中IL-6、IL-10、TNF-α、IFN-β、IFN-γ水平变化
如图4所示,与正常组相比,模型组小鼠肾组织中IL-6、TNF-α、IFN-γ均有所升高(P<0.05),经过不同剂量[250、500 mg/(kg·d)]的白茶多酚处理后,其水平均有所降低(P<0.05),并且高浓度组水平最低。其中肿瘤坏死因子TFN-α可能通过刺激肾小球系膜细胞产生多种缩血管介导因子,如血小板活化因子、前列腺素等,引起血管收缩,加重肾功能障碍,也可以促进细胞产生各种炎症因子,进而促进炎症反应的发生[27-28]。IL-6会导致炎症部位急性蛋白和T细胞的积累[29]。抗炎症因子IL-10能够减轻体内炎症程度,使机体维持在正常水平。
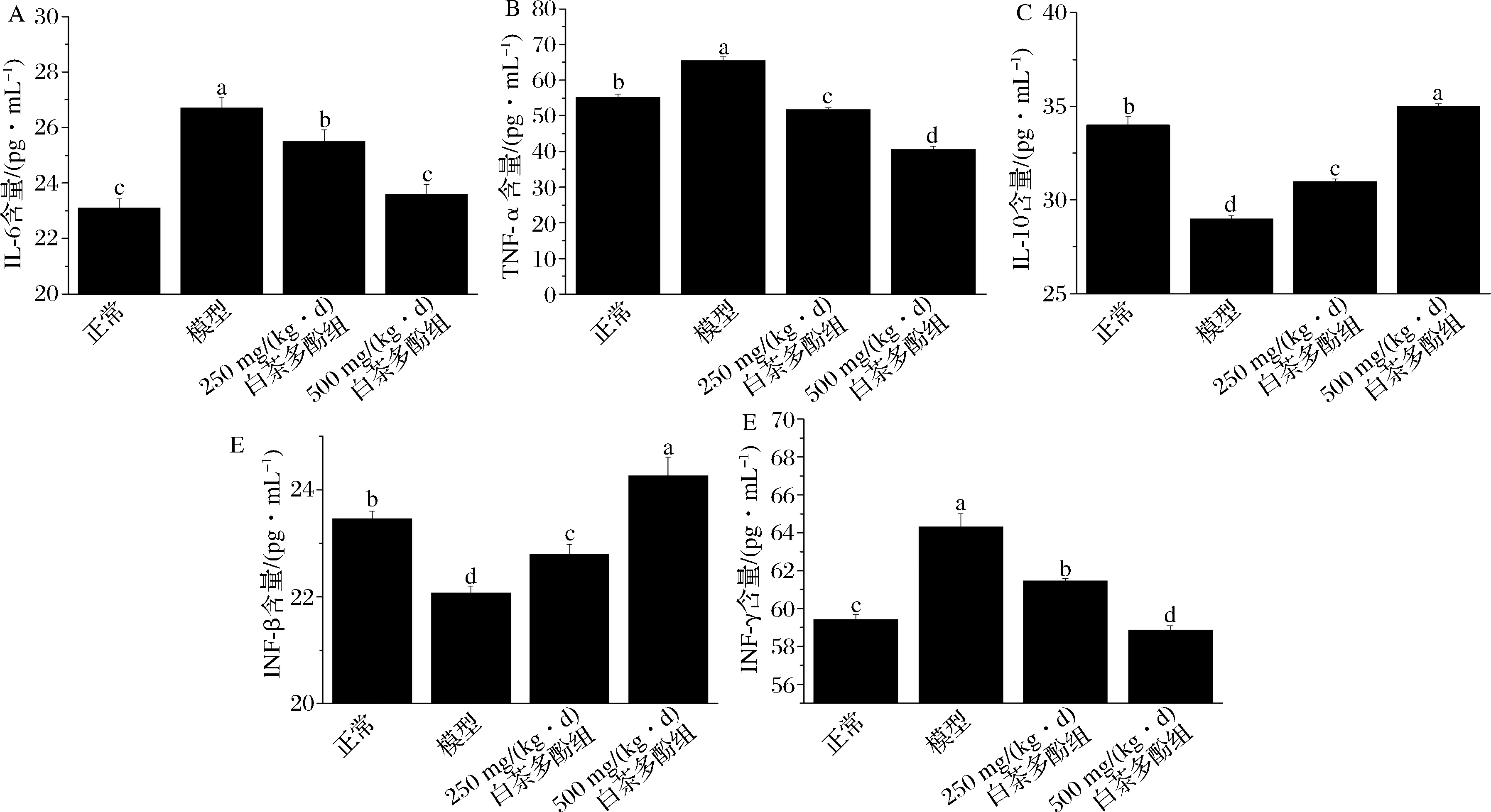
A-IL-6;B-TNF-α;C-IL-10;D-IFN-β;E-IFN-γ图4 白茶多酚对肾损伤细胞内IL-6、TNF-α、IL-10、IFN-β、IFN-γ的影响Fig.4 Effects of white tea polyphenols on IL-6, TNF-α, IL-10, IFN-β and IFN-γ levels in renal damaged cells
2.6 白茶多酚的化学成分分析
2.6.1 白茶多酚的种类及含量分析
通过高效液相色谱对比相关文献分析,共检测到6种化合物:隐绿原酸(7.220 min)、没食子儿茶素没食子酸酯(8.703 min)、表儿茶素(8.997 min)、芦丁(9.453 min)、山柰苷(9.667 min)、对香豆酸(10.563 min)。6种化合物在255 nm处分离效果较好,且色谱峰面积比较大,响应效果好,峰形也较好。根据图5、图6与表2可知,其含量分别为1.096 00、5.545 00、0.472 50、0.051 35、0.075 50、0.210 60 mg/g,其中没食子儿茶素没食子酸酯含量最高,其次是隐绿原酸,芦丁含量最少。
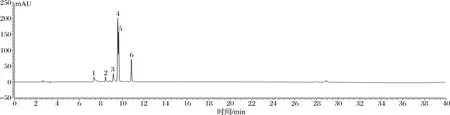
1-隐绿原酸;2-没食子儿茶素没食子酸酯3-表儿茶素;4-芦丁;5-山柰苷;6-对香豆酸(下同)图5 混合标准品液相色谱图Fig.5 Liquid chromatogram of mixed standard substance
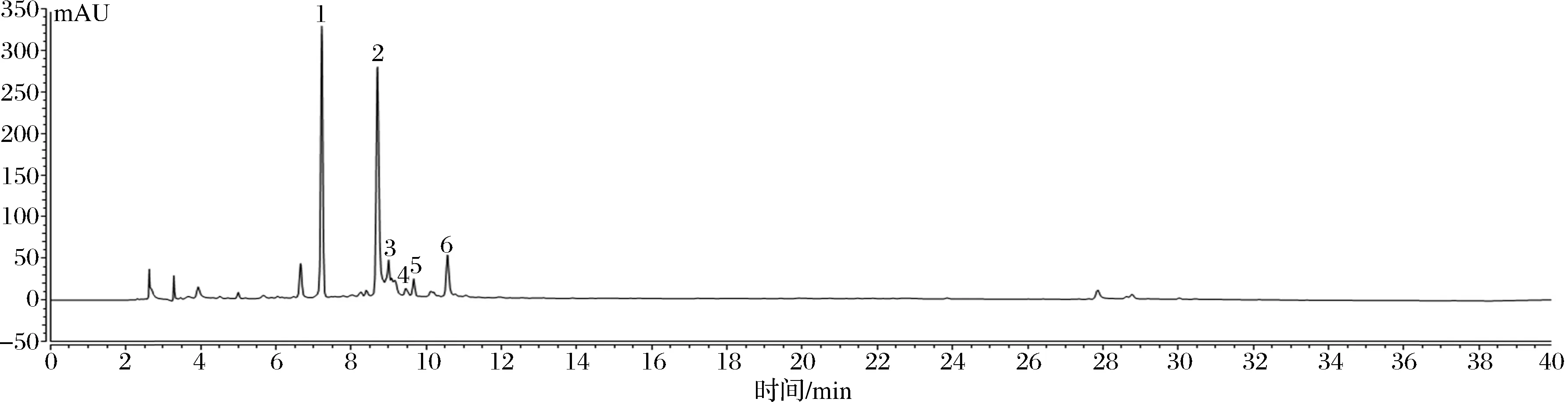
图6 白茶多酚液相色谱图Fig.6 Liquid chromatography of white tea polyphenols
2.6.2 标准曲线试验
通过试验可知隐绿原酸、没食子儿茶素没食子酸酯、表儿茶素、芦丁、山柰苷、对香豆酸混合标准品溶液线性方程如表2所示,以各标准品实际进样量(μg)为横坐标,色谱峰面积为纵坐标,制作标准曲线。

表2 线性关系试验结果Table 2 Linear relationship test results
结果表明,隐绿原酸、没食子儿茶素没食子酸酯、表儿茶素、芦丁、山柰苷、对香豆酸的拟合度R2分别为0.974 6、0.987 3、0.996 7、0.981 8、0.978 0、0.999 6,线性方程表现了良好的线性关系。
2.6.3 重现性
隐绿原酸、没食子儿茶素没食子酸酯、表儿茶素、芦丁、山柰苷、对香豆酸的峰面积RSD值分别为0.64%、3.75%、1.56%、4.87%、4.22%、1.43%,表明此方法重现性良好。
2.6.4 加标回收率
由表3可知,隐绿原酸、没食子儿茶素没食子酸酯、表儿茶素、芦丁、山柰苷、对香豆酸的回收率分别为97.43%、91.96%、101.5%、93.73%、85.25%、97.91%,说明高效液相色谱法对白茶多酚类化合物的质量控制准确性较好。
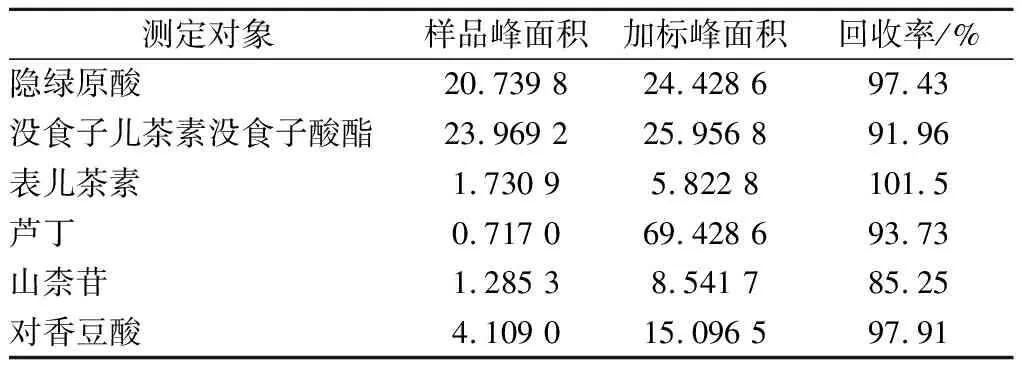
表3 回收率试验结果Table 3 Recovery test results
3 讨论
茶既是饮料,又可用来防病、治病,健身,两种功效兼备[31]。而茶内含的多酚类物质是一种具有预防恶性肿瘤作用的化学物质,具有很强的清除和降低自由基活性能力。白茶多酚已被证明可以降低血糖、血脂水平,具有抗氧化、抗炎和抗肿瘤特性,同时还可以延缓衰老和解毒[32]。
采用高效液相色谱法检测白茶多酚样品,发现其含有隐绿原酸、没食子儿茶素没食子酸酯、表儿茶素、芦丁、山柰苷、对香豆酸6种生物活性成分,其中没食子儿茶素没食子酸酯可以显著减少细胞内脂滴和主要脂生转录因子的表达,如PPAR γ, SREBP-1c and C/EBP α,也能够剂量依赖性地降低细胞内活性氧水平和IL-6诱导的产生[33]。芦丁的结构中含有丰富的官能团,能与金属离子螯合成稳定的结构,发挥稳定的生物活性作用,具有抗自由基、抗炎、抗病毒和保护心脑血管、胃肠道黏膜等作用[34]。山柰苷可以抑制细胞的增殖,诱导凋亡,在人类风湿性关节炎成纤维细胞样共体细胞中减轻炎症,并且可以降低IL-6和TNF-α的表达水平[35]。对香豆酸可以清除体内的自由基,抑制脂质过氧化和DNA氧化损伤,抗炎和抗肿瘤的作用,有效预防血小板凝集,并对细菌有一定的抑制作用[36]。综上所述,这些活性化学物质在白茶多酚中的存在可能是其各种药理作用的主要原因。
白茶多酚[250、500 mg/(kg·d)]对D-半乳糖诱导的小鼠肾损伤模型的改善作用包括:调节小鼠肾脏器官的重量;改善肾脏细胞形态结构、水肿和炎症;提升机体内CAT、GSH-Px、T-AOC的含量和降低MDA和NO的含量;下调炎症因子IL-6、TNF-α、IFN-γ的浓度和上调抗炎症因子IL-10、IFN-β的浓度;此外,高效液相色谱检测的6种化合物已被证实具有抗氧化、抗炎症和抗肿瘤等多种生物活性。但是,本研究仅对白茶多酚的体外抗氧化活性及肾损伤的改善作用作了初步研究,对于抗氧化作用的保护机制,还需进一步深入研究。
