羟自由基氧化对花生球蛋白结构和功能性质的影响
2022-02-25尹可宏杨茜赵秀飞杨曦李云嵌张雪春
尹可宏,杨茜,赵秀飞,杨曦,李云嵌,张雪春*
1(西南林业大学 生命科学学院,云南 昆明,650224)2(寻甸回族彝族自治县卫生健康综合监督执法局,云南 昆明,655200)
花生(ArachishypogaeaL.)隶属于豆科一年生草本植物,是我国种植产量最丰富、食用最广泛的坚果之一,其作为世界四大油料作物之一,富含蛋白质、脂肪和碳水化合物,具有很高的营养价值[1]。花生仁中含有24%~36%的蛋白质,大部分为盐溶性蛋白[2]。其中,花生球蛋白约占总蛋白的63%,分子质量为350 kDa[3],其具有较好的乳化性、起泡性、吸水性和凝胶性等功能特性,可作为一种优良的食品原料广泛应用于食品领域。
研究发现,食品体系中的蛋白质易受到自由基作用发生氧化,导致食品中蛋白质营养损失、风味恶化以及功能性质下降,进而影响食品品质。如不饱和脂肪酸氧化酸败可使核桃蛋白发生氧化,使其食品色泽、风味及品质发生改变,营养价值降低[4];崔旭海等[5]发现氧化可导致乳蛋白物理、化学性质发生改变,进而改变其凝胶能力、保水能力和乳化能力;李艳青等[6]发现不受控制的激烈氧化环境会导致大豆蛋白功能性质下降。但这些研究主要是针对核桃、大豆、米等植物蛋白进行研究,对于花生蛋白组分的功能性质评估相对较少,而关于羟自由基氧化对花生球蛋白结构、功能性质的影响方面的研究鲜有报道。因此,本研究选取花生球蛋白为研究对象,利用铁/过氧化氢/抗坏血酸(Fe/H2O2/Asc)建立羟自由基氧化体系(hydroxyl radical oxidation system,HROS),对花生球蛋白进行不同程度的氧化处理,考察羟自由基氧化对其结构和功能性质的影响,从而为花生的进一步开发和利用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与试剂
花生仁(云南红壳小花生)购于昆明;牛血清白蛋白、福林酚试剂,上海源叶生物科技有限公司;过氧化氢、三氯乙酸、乙酸乙酯、三氯化铁、抗坏血酸、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),天津市风船化学试剂科技有限公司;三羟基甲基氨基甲烷-甘氨酸(trihydroxymethylaminomethane-glycine,Tris-Gly)缓冲溶液、2,4-二硝基苯肼(2, 4-dinitrophenyl hydrazine,DNPH)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、8-苯胺-1-萘磺酸(8-anilino-1-naphthalene sulfonic acid,ANS),天津市致远化学试剂有限公司。以上药品、试剂均为分析纯。
1.1.2 仪器与设备
5804R型多功能台式高速冷冻离心机,德国Eppendorf公司;艾卡IKA RV10基本型立式旋转蒸发仪,南京荣华科学器材有限公司;Infinite F50型酶标仪,瑞士Tecan公司;F-7000型日立荧光分光光度仪,日本日立公司;Jasco J-715圆二色谱仪,佰泰科技有限公司;UV-2600紫外可见分光光度计,日本岛津公司。
1.2 实验方法
1.2.1 花生球蛋白的提取
花生仁经粉碎后置于烧杯中,加入5倍体积的石油醚,室温条件下进行搅拌脱脂3 h(重复3次),风干后过40目筛,即为脱脂花生粉。按照料液比1∶15(g∶mL)向脱脂花生粉中加入0.05 mol/L pH 7.9的Tris-HCl缓冲液,于30 ℃的环境下搅拌提取1 h,然后在4 ℃的环境中,以4 000 r/min离心30 min,保留上清液。在上清液中加入NaHSO3,使得上清液含NaHSO3浓度为0.01 mol/L,调节pH至6.4,同样于30 ℃的环境下搅拌提取1 h。再次离心,沉淀用去离子水洗3次,冻干后即为花生球蛋白。
1.2.2 羟自由基氧化花生球蛋白的制备
参照PARK等[7]的方法并略加修改,通过铁/过氧化氢/抗坏血酸(Fe/H2O2/Asc)体系产生羟自由基,主要是由FeCl3和H2O2通过氧化还原反应而产生。在氧化体系中分别加入花生球蛋白,使其最终质量浓度为10 mg/mL,添加H2O2使其终浓度分别为0、0.1、0.5、1、5、10、15 mmol/L,同时固定FeCl3和抗坏血酸在体系中终浓度为0.1 mmol/L,并置于摇床中37 ℃恒温孵育氧化24 h后,添加EDTA终止氧化反应,然后于去离子水中透析72 h,冻干后即为氧化花生球蛋白。以花生球蛋白添加等体积0.01 mmol/L pH 7.9的Tris-HCl缓冲液代替Fe/H2O2/Asc体系作为对照组。
1.2.3 羰基含量的测定
参照HUANG等[8]的方法并略加改动。用0.01 mmol/L Tris-HCl缓冲液(含0.6 mol/L NaCl、pH 7.9)将氧化后的花生球蛋白粉配制成质量浓度为10 mg/mL的蛋白液。取4.5 mL 10 mg/mL的蛋白液于50 mL离心管中,加入3 mL 10 mmol/L的DNPH溶液,混匀后于室温避光静置1 h,并每隔10 min振荡1次,然后加入3 mL 200 mg/mL的三氯乙酸溶液终止反应。在8 000 r/min下离心15 min,保留沉淀物,用3 mL等体积比的乙酸乙酯-乙醇溶液进行洗涤3次(去除未反应试剂)。加入12 mL 6 mol/L的尿素溶液,在37 ℃水浴下溶解沉淀20 min,最后在10 000 r/min下离心15 min,取1 mL上清液于370 nm处测定吸光值。以3 mL 2 mol/L的HCl溶液代替DNPH溶液作为空白对照。
1.2.4 游离巯基与总巯基含量的测定
参照HUANG等[8]的方法并略加修改。取45 mg花生球蛋白分散在15 mL测试液中,于25 ℃保温1 h后,在25 ℃ 10 000 r/min离心15 min。取5 mL上清液,并添加50 μL 4 mg/mL的DTNB溶液,混匀静置15 min后取1 mL上清液于412 nm处测吸光值。以5 mL的Tris-Gly缓冲液、5 mL含8 mol/L尿素的Tris-Gly缓冲液代替上清液分别作为测量游离巯基和总巯基含量的试剂空白。其中,Tris-Gly缓冲液(pH 8.0)用作游离巯基含量的测试液,pH 8.0含8 mol/L尿素的Tris-Gly缓冲液用作总巯基含量的测试液。
1.2.5 紫外扫描光谱测定
参照BACHRI等[9]的方法并略加修改。以pH 7.90.01 mmol/L的Tris-HCl缓冲溶液为空白,在室温下测定质量浓度为1 mg/mL氧化后花生球蛋白的紫外吸收图谱。
1.2.6 差示热量扫描仪(differential scanning calorimetry,DSC)测定
参照PUGLIESE等[10]的方法并略加修改。采用DSC分析样品的热力学性质,称取5~10 mg样品至铝坩埚中,然后密封压片,置于差示扫描热分析仪分析。设置初始温度为20 ℃,然后以10 ℃/min的速率升温至120 ℃。
1.2.7 圆二色谱测定
参照LEE等[11]的方法并略加修改。将未氧化和氧化的花生球蛋白分别用去离子水配制成质量浓度为50 μg/mL的蛋白溶液,之后用圆二色谱仪在25 ℃下测定其在190~250 nm的远紫外图谱。以去离子水作为空白对照。在扫描速率、间隔时间、宽度以及最小间隔度分别为100 nm/min、0.25 s、1.0 nm和0.2 nm条件下进行测定。通过线性拟合出花生球蛋白中α-螺旋、β-折叠、β-转角和无规卷曲结构的含量。
1.2.8 花生球蛋白溶解度的测定
参照WANG等[12]的方法并略加修改。花生球蛋白以50 mmol/L pH 7的磷酸盐缓冲液配制成1 mg/mL溶液,搅拌1 h后,于8 000 r/min离心15 min,用福林酚法测定上清液中蛋白质含量,并用凯氏定氮法测定样品中总蛋白质含量。按公式(1)计算花生球蛋白的溶解性:

(1)
1.2.9 花生球蛋白浊度的测定
参考JIANG等[13]的方法并略加修改。吸取5 mL 1 mg/mL经不同羟自由基氧化体系氧化的花生球蛋白溶液于试管中,在40 ℃的水浴锅中水浴30 min后取出,冷却后在600 nm处测定吸光值,用吸光度代表浊度。以不加花生球蛋白的溶液为空白。
1.2.10 花生球蛋白起泡性及起泡稳定性的测定
参照CANO-MEDINA等[14]的方法并略为修改。花生球蛋白以50 mmol/L pH 7的磷酸钠缓冲液配制成质量浓度为1 mg/mL的溶液,搅拌1 h后取40 mL蛋白液于10 000 r/min均质分散2 min,分别测定 0 min 和60 min的蛋白液的总体积。花生球蛋白的起泡性与起泡稳定性分别按公式(2)和公式(3)计算:

(2)

(3)
式中:V,初始体积,mL;V1,分散后0 min的体积,mL;V2,静置60 min的体积,mL。
1.2.11 花生球蛋白乳化性及乳化稳定性的测定

(4)

(5)
式中:A0,0 min的吸光值;A10,静置10 min的吸光值;N,稀释因子,500;ρ,蛋白质量浓度,g/mL;φ,乳状液油相体积分数,25%;L,比色光径,1 cm;t,时间间隔,10 min。
1.2.12 花生球蛋白表面疏水性的测定
1.2.13 数据处理与分析
所有实验均重复3次以上,实验数据以平均值±标准偏差表示。采用Origin 8.6软件分析和作图,SPSS 22.0软件进行显著性分析,P<0.05认为样品间具有显著性差异。
2 结果与分析
2.1 羟自由基氧化对花生球蛋白羰基含量的影响
蛋白质中侧链上带有—NH或—NH2的氨基酸容易受羟自由基氧化而产生羰基,羰基含量可以反映出蛋白质氧化程度[16]。HROS对花生球蛋白羰基含量的影响如图1所示。随着H2O2浓度的增加,羰基含量整体以浓度依赖性呈现明显上升趋势。当H2O2浓度为0~5 mmol/L时,其羰基含量缓慢上升;当H2O2浓度为10 mmol/L时,其羰基含量迅速增加,并在H2O2浓度为15 mmol/L时含量达到最高值,为(29.69±0.14) nmol/mg,是对照组[(16.05±0.13) nmol/mg]的1.85倍(P<0.05)。该结果表明花生球蛋白的氧化程度随H2O2浓度的增加而逐渐增强,这与ZHANG等[17]研究结果相一致。可能是因为随着H2O2浓度的增加,越来越多的羟自由基会进攻氨基酸分子中的自由氨基或亚氨基,使部分氨基酸残基和多肽链发生氧化,进而氧化生成羰基衍生物和NH3,故随着氧化剂用量的增大,氧化体系产生的羰基含量也逐渐增加。

图1 羟自由基氧化后花生球蛋白羰基含量变化情况Fig.1 Changes of carbonyl content of arachin after hydroxyl radical oxidation 注:不同字母表示同组间不同氧化程度的花生球蛋白样品之间 差异显著(P<0.05)(下同)
2.2 羟自由基氧化对花生球蛋白游离巯基和总巯基含量的影响
蛋白被氧化之后,其总巯基和游离巯基含量会发生下降,可用于表征氧化程度。HROS对花生球蛋白的游离巯基和总巯基含量的影响如图2所示,在一定范围内随着H2O2浓度的增加,花生球蛋白游离巯基和总巯基含量均逐渐减少。当H2O2的浓度为15 mmol/L时,游离巯基和总巯基含量分别减少至(9.49±0.12)、(10.00±0.21) μmol/g,分别是对照组[(14.35±0.41)、(15.88±0.35) μmol/g]的66%和0.63%(P<0.05),表明花生球蛋白的氧化程度逐渐增强,这与本课题组前期的结果相一致[2]。这可能是在H2O2的作用下,花生球蛋白中的巯基被氧化生成二硫键或进一步氧化生成磺酸类等产物,从而导致蛋白质表面的游离巯基和总巯基含量下降。

图2 羟自由基氧化后花生球蛋白游离巯基和总巯基含量 变化情况Fig.2 Changes of free sulfhydryl groups and total sulfhydryl groups in arachin after hydroxyl radical oxidation 注:游离巯基含量用不同小写字母表示显著性差异(P<0.05), 总巯基含量用不同大写字母表明显著性差异(P<0.05)
2.3 羟自由基氧化对花生球蛋白紫外扫描光谱的影响
蛋白质中的酪氨酸、苯丙氨酸和色氨酸等氨基酸能吸收一定的波长范围的紫外光,因此蛋白质的紫外光谱能直观地反映出其结构的变化情况[18]。HROS对可溶性花生球蛋白紫外扫描光谱的影响如图3所示,未氧化的花生球蛋白最大吸收峰在287 nm处,随着H2O2浓度的增加,吸收峰强度明显减弱,当H2O2的浓度达到15 mmol/L时,峰强度最低,说明上清液中花生球蛋白的含量随氧化程度加深而逐渐降低。花生球蛋白的λmax发生轻微蓝移,表明分子表面可吸收紫外光的残基减少,即花生球蛋白中部分可吸收紫外光的氨基酸基团因氧化程度增大而引起结构变化[19]。在280~287 nm处,氧化处理后花生蛋白的吸收峰强度出现了明显的上升,这可能是因为氧化引起了蛋白质聚集,导致蛋白质的构象发生了变化,从而使其紫外吸收光谱发生了改变[20]。
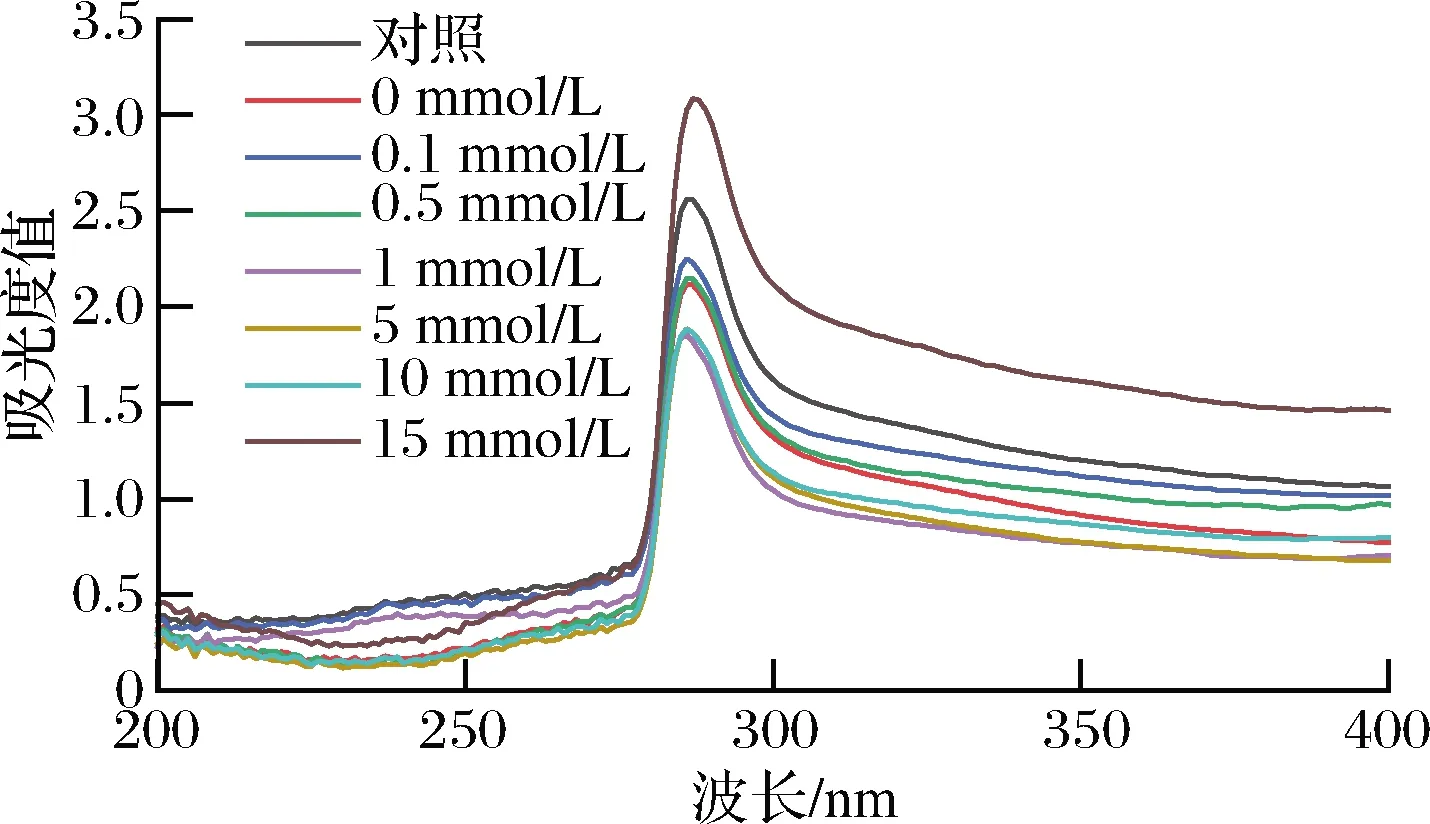
图3 羟自由基氧化后花生球蛋白的紫外扫描图谱Fig.3 Ultraviolet scanning atlases of arachin oxidized by hydroxyl radical
2.4 羟自由基氧化对花生球蛋白DSC曲线的影响
当物质所处的温度环境发生变化时,会导致物质能量也随之发生改变,其表现方式为吸热或放热,因此可通过观测蛋白质的热能差异来反映蛋白质结构的变化[21]。HROS修饰后的花生球蛋白的DSC扫描曲线如图4所示,在不同H2O2浓度下花生球蛋白的放热幅度有所差异,但其变化曲线规律基本一致。随着H2O2浓度的提高,花生球蛋白放热峰的温度依次为74、72、70、75、70、72、73 ℃,与对照组(72 ℃)相比无明显变化,表明羟自由基氧化对花生球蛋白的热稳定性影响较小,这和YAMAGUCHI等[22]报道的结果相一致。
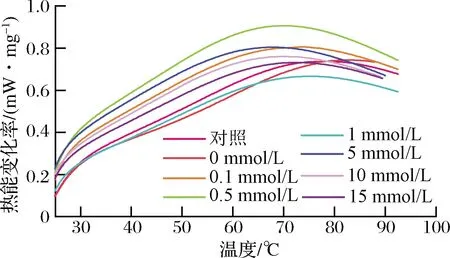
图4 羟自由基氧化后花生球蛋白的DSC曲线Fig.4 DSC curve of arachin after hydroxyl radical oxidation
2.5 羟自由基氧化对花生球蛋白圆二色谱的影响
在蛋白质分子中,肽链的不同部分可分别形成α-螺旋、β-折叠、β-转角等特定的立体结构,这些立体结构都是不对称的,且蛋白质的肽键在紫外185~240 nm处有光吸收,使其在这一波长范围内有圆二色性[23]。因此,利用圆二色谱可以灵敏地检测出蛋白质二级结构(α-螺旋、β-折叠、β-转角和无规则卷曲)的变化,其结果如表1所示。随着H2O2浓度的增加,可溶性花生球蛋白二级结构中的α-螺旋结构明显减少,无规则卷曲结构明显增加(P<0.05),而β-折叠、β-转角变化不明显(P>0.05)。结果表明经羟自由基氧化处理后,可溶性花生球蛋白的二级结构中α-螺旋减少、无规则卷曲增加,其他结构变化不明显,这与DEL等[24]的研究结果相类似。同未氧化的花生球蛋白相比,当H2O2浓度为15 mmol/L时,花生球蛋白α-螺旋减少6.25%、无规则卷曲增加10.25%,这也同样说明在H2O2氧化的过程中,可溶性花生球蛋白的二级结构会发生一定改变,其变化规律则与氧化的条件和程度有关。

表1 羟自由基氧化后花生球蛋白二级结构变化情况Table 1 Changes of secondary structure of arachin after hydroxyl radical oxidation
2.6 羟自由基氧化对花生球蛋白溶解度的影响
蛋白溶解度是蛋白质之间、蛋白质与溶剂之间相互作用的结果,与其粒径大小有一定的关系,可用于表征蛋白质交联及聚集的程度,同时也是蛋白质具有其他功能性质的必要条件[25]。HROS对花生球蛋白溶解度的影响如图5所示,随着H2O2浓度的增加,花生球蛋白溶解度呈下降趋势,当H2O2浓度为15 mmol/L时其溶解度减小至(50.98±0.14)%,显著低于对照组的(68.50±0.36)%(P<0.05)。这可能是由于羟自由基破坏了花生球蛋白的构象,并随着羟自由基浓度的增大,花生球蛋白疏水基团逐渐暴露,蛋白质发生共价交联,使可溶性聚集体进一步聚集形成不可溶性聚集体,导致蛋白质水化作用逐渐减弱,溶解度下降,这与WANG等[12]结果相一致。
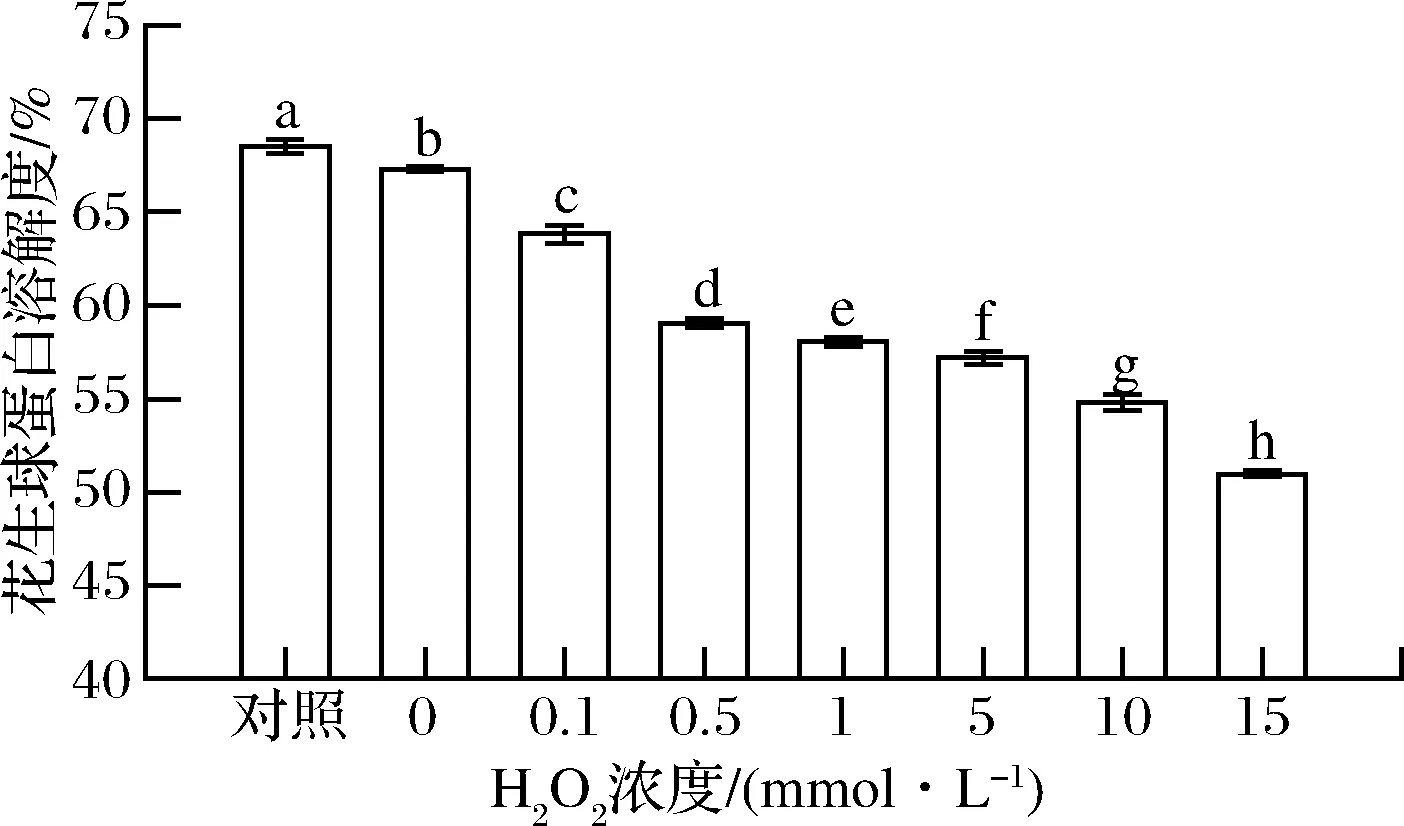
图5 羟自由基氧化对花生球蛋白溶解度的影响Fig.5 Effect of hydroxyl radical oxidation on the solubility of arachin
2.7 羟自由基氧化对花生球蛋白浊度的影响
浊度是指当光线通过溶液时所产生的阻碍程度,可以反映出其溶解度的大小。本实验采用样品在600 nm下的吸光值表示其浊度,结果如图6所示。经氧化后花生球蛋白的浊度均高于对照组,且随着H2O2浓度的增大而递增(P<0.05)。当H2O2浓度为15 mmol/L时,花生球蛋白的吸光度达到0.20±0.001,其浊度是对照组(0.07±0.001)的2.86倍。该结果与JIANG等[13]结果相一致,原因是氧化使蛋白质分子之间发生交联反应而聚集,导致其溶解度下降,浊度上升。本论文中,浊度的实验结果与溶解度的现象相一致,进一步说明氧化会使蛋白质分子发生聚集,从而导致其溶解度降低。
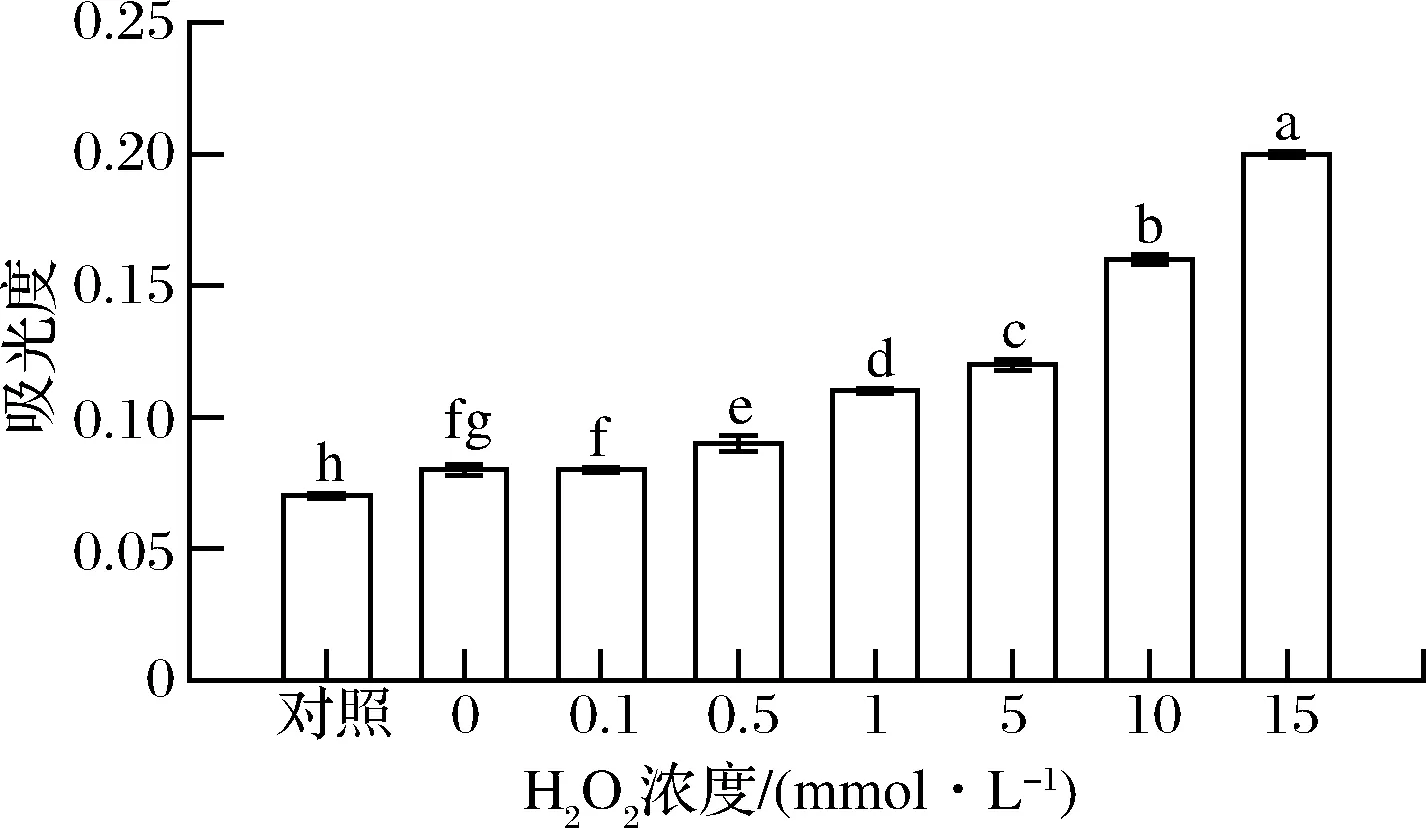
图6 羟自由基氧化对花生球蛋白浊度的影响Fig.6 Effect of hydroxyl radical oxidation on the turbidity of arachin
2.8 羟自由基氧化对花生球蛋白起泡性和起泡稳定性的影响
蛋白质的起泡性可以赋予食品疏松的结构,使其具有良好的口感,其与蛋白中可溶性蛋白含量及其在溶液中的稳定性相关[26]。HROS对花生球蛋白的起泡性和起泡稳定性的影响如图7所示,随着H2O2浓度的增加,花生球蛋白起泡性呈先增加后下降的趋势,起泡稳定性呈逐渐上升的趋势。原因是经过羟自由基氧化后,蛋白分子部分展开,其内部疏水残基暴露在蛋白表面,使蛋白质分子能迅速吸附至气-水界面,进而增强起泡性;随着氧化程度的加深,巯基逐渐氧化形成二硫键而发生更大交联,形成蛋白聚合物等不可溶的聚集体,使界面张力增加。同时溶解度的降低使其用来发泡的有效蛋白质含量降低,故而起泡性减小[27]。起泡稳定性随H2O2浓度增加而逐渐上升,且当H2O2浓度为15 mmol/L时(P<0.05),起泡稳定性最好[(27.44±0.11)%],这可能是部分暴露的疏水性基团发生相互吸引,使得泡沫稳定性增强[14]。

图7 羟自由基氧化对花生球蛋白起泡性和起泡稳定性 的影响Fig.7 Effects of hydroxyl radical oxidation on the foaming and foaming stability of arachin 注:起泡性用不同小写字母表示显著性差异(P<0.05), 起泡稳定性用不同大写字母表明显著性差异(P<0.05)
2.9 羟自由基氧化对花生球蛋白乳化性和乳化稳定性的影响
乳化性质是指蛋白质与食品体系中的油和水形成乳状液的能力,其是蛋白质的一项重要的功能性质,一般通过乳化性和乳化稳定性来评价蛋白质的乳化能力[28]。HROS对花生球蛋白的乳化性和乳化稳定性的影响如图8所示,随H2O2浓度增大,花生球蛋白乳化性及乳化稳定性均呈先增加后下降的趋势。当H2O2浓度为1 mmol/L时,乳化性最高为(79.2±0.62) m2/g;当H2O2浓度为0.5 mmol/L时,乳化稳定性最好为38 min(P<0.05)。这是因为蛋白质的乳化性能受其溶解度、粒径、分子柔韧性等影响,当低浓度的H2O2作用于花生球蛋白时,维持花生球蛋白空间结构的非共价键(疏水相互作用、静电相互作用)被破坏,蛋白分子内部疏水基团暴露,分子柔韧性提高,更多的蛋白分子结合到油-水界面,使花生球蛋白的乳化性和乳化稳定性增加[29]。继续增大H2O2浓度,巯基逐渐被氧化形成二硫键,蛋白质发生交联形成不可溶性聚集体,使其溶解度下降、分子柔韧性降低、蛋白表面积缩小,导致花生球蛋白的乳化性及乳化稳定性下降。

图8 羟自由基氧化对花生球蛋白乳化性和乳化稳定性的影响Fig.8 Effects of hydroxyl radical oxidation on the emulsification and emulsification stability of arachin 注:乳化性用不同小写字母表示显著性差异(P<0.05), 乳化稳定性用不同大写字母表明显著性差异(P<0.05)
2.10 羟自由基氧化对花生球蛋白表面疏水性的影响
蛋白质的表面疏水性是维持蛋白质三级结构的主要作用力,可用于蛋白表面疏水性来衡量蛋白质的变性程度,对蛋白质结构和功能性质的稳定具有重要意义。HROS对可溶性花生球蛋白表面疏水性的影响如图9所示,随着H2O2浓度的增加,花生球蛋白的表面疏水性逐渐下降,且当H2O2浓度为15 mmol/L时,疏水性最低为10±1,与对照组(112±3)相比减少了102(P<0.05),这与RAMREZ等[15]的研究结果相似。在蛋白质氧化过程中,HROS诱导蛋白质内部氨基酸残基发生氧化,使蛋白质去折叠而外露出疏水基团,进而通过疏水作用形成聚集体,随着H2O2浓度的增大,其表面疏水性逐渐减小,这可能是由于花生球蛋白形成聚集体所致[30]。

图9 羟自由基氧化对花生球蛋白表面疏水性的影响Fig.9 The effect of hydroxyl radical oxidation on surface hydrophobicity of arachin
3 结论
本研究以羟自由基氧化体系建立氧化模型,对花生球蛋白进行不同程度的氧化处理,并考察羟自由基氧化体系对花生球蛋白结构及功能性质变化的影响。结果表明,羟自由基氧化对花生球蛋白结构和功能性质都会产生一定的影响,在一定范围内随着H2O2浓度的增加,花生球蛋白的羰基含量、浊度、起泡稳定性呈上升的趋势;游离巯基、总巯基、溶解度、紫外吸收峰强度和表面疏水性呈现降低的趋势;乳化性、乳化稳定性和起泡性呈先上升后下降的趋势;而HROS对可溶性花生球蛋白二级结构中α-螺旋、无规则卷曲也造成一定的影响。结果说明氧化使花生球蛋白的结构及功能性质发生了一定的变化。因此,可在贮藏加工过程中采取有效措施来控制花生的氧化程度,减少过度氧化引起的花生品质的劣变,也可以通过适度氧化以改善其加工性质。本研究可以为花生资源的进一步开发和利用提供一定科学依据。
