棉纤维固定化酵母发酵产乙醇研究
2022-02-25邓衍宏刘庆国汪虎应汉杰陈勇李义
邓衍宏,刘庆国,汪虎,应汉杰,陈勇*,李义
1(宿州中粮生物化学有限公司,安徽 宿州,234000)2(南京高新工大生物技术研究院有限公司,江苏 南京,210032) 3(吉林中粮生化有限公司,吉林 长春,130033)
传统的大宗生化品发酵模式依然采用大接种量的单批次发酵,如燃料酒精、氨基酸、有机酸和酶制剂等,发酵工艺优化改进空间有限,而生产成本最高的部分——料问题短期内也无法得到有效缓解,所以生产企业在未来竞争中生存的根本是发酵技术的创新[1-2]。传统发酵工艺主要存在2个方面的缺陷:一是生物催化剂耐受性差,易失活。细胞是由蛋白质、磷脂等物质组成的一种柔性结构。工业环境中有机酸、高浓度盐类、H+等化学物质的侵入容易使其失去生命功能。由于细胞耐受性差,生物反应体系的最终产物浓度和生产过程效率均低于化学催化体系。二是生物催化剂易老化。微生物细胞随着时间的推移细胞增殖和分化的能力逐渐衰退,自溶现象严重,导致发酵过程的合成能力下降和催化剂浪费的现象,从而表现为底物转化效率低[3]。
解决上述问题的最佳途径是固定化发酵技术。常规固定化载体包括海藻酸钙、卡拉胶、聚乙烯醇凝胶等[4-5]。然而,高搅拌环境严重影响了固定化技术的可行性。表面固定化技术作为一种新型表面固定化方法以多方面优势而越来越受到世人关注。短短20年期间,发展非常迅速,应用越来越广泛。利用棉纤维作为表面固定化材料具有成本低、比表面积大、吸附效果好以及表面基团易于修饰改性等优点。目前已经在有机酸、酶制剂以及工业污水处理等应用中实现了实验室或小试规模的成功验证[6-9];尤其在燃料乙醇方面,陈勇研究团队已经完成了320 t发酵罐规模的示范试验研究[5]。
本研究基于前期研究的基础上,采用化学修饰的方式对纤维载体进行基团修饰,以提高菌体吸附能力,进行定量化的固定化发酵产乙醇的研究,为工业化应用提供更为精准的参考。
1 材料与方法
1.1 实验材料
1.1.1 菌种
安琪耐高温活性酵母粉。
1.1.2 固定化载体
固定化载体为棉纤维,采用化学修饰剂为(F6)进行化学改性,用量是毛巾质量的10%(-1)、25%(-2)和50%(-3)。在95%乙醇中浸泡毛巾,42 ℃下摇床(转速200 r/min)中振荡反应48 h。反应结束后,用纯水清洗10次,并进行冻干处理备用。
1.1.3 培养基
活化培养基:麦芽汁固体培养基(麦芽250 g/L磨碎过滤加琼脂20 g/L,121 ℃灭菌20 min,备用)。种子培养基(g/L):酵母膏10、蛋白胨20、葡萄糖20、磷酸二氢钾1.5、硫酸铵4、硫酸镁0.5。发酵培养基(g/L):酵母膏5、蛋白胨5、葡萄糖230、磷酸二氢钾3、硫酸铵4、硫酸镁 0.5、七水合硫酸亚铁0.05、七水合硫酸锌0.05。
1.1.4 仪器与设备
1260高效液相色谱,安捷伦;752 N分光光度计,上海仪电;SBA-40E生物传感分析仪,山东省科学院生物研究所;JSM-6010扫描电镜,JEOL;XSP10显微镜,万衡仪器。
1.2 实验材料
1.2.1 种子培养
挑取1环经麦芽汁活化的斜面种子于200 mL灭菌过的种子培养基中,并置于温度30 ℃、转速150 r/min的摇床培养18 h。
1.2.2 菌种扩大培养及固定
将装有4 g呈正方形棉纤维(2.5 cm×2.5 cm×2 mm)的500 mL的锥形瓶加入200 mL新鲜种子培养基,115 ℃灭菌15 min。冷却至室温后,量取10%(体积分数)的种子液加到锥形瓶中。再置于30 ℃摇床上固定16 h。
1.2.3 固定化细胞发酵
将固定结束后的废液倒出,加入新鲜发酵培养基,于温度33 ℃,转速100 r/min的摇床上培养若干时间(以不产气泡及糖降至3 g/L以下为准,下同)。该实验为破坏性实验,每批次设3个平行摇瓶,每批次样培养结束倒出发酵液测溶液OD600值,用血球计数板统计细胞数、出芽率和死亡率。瓶中载体加入200 mL纯水振荡,并整体倒入1 L的烧杯中,超声振荡解离出酵母细胞,将载体取出,烧杯中的液体检测OD600值,用血球计数板统计细胞数、出芽率和死亡率,并取10 mL离心测量菌体体积。测完后排出液体,将载体放回烧杯,重新倒入200 mL纯水解离细胞,清液检测OD600值,再重新加水洗,然后再重复2次,即加水4次。
1.2.4 游离细胞发酵
500 mL的锥形瓶加入200 mL新鲜发酵培养基,设3个平行样。115 ℃灭菌15 min。冷却至室温后,量取10%(体积分数)的种子液加到锥形瓶中。再置于温度33 ℃、转速100 r/min的摇床培养,培养若干时间。结束倒出发酵液测溶液OD600值,用血球计数板统计细胞数、出芽率和死亡率。
1.2.5 分析方法
OD值测定:游离酵母:稀释一定倍数,通过可见分光光度计,在波长为600 nm的条件下检测。固定化酵母:通过振荡从棉纤维上解离下来,然后用上述方法测得OD值。
细胞数测定:血球计数法,取2.5 mL混匀样品放入100 mL容量瓶中,加1 mL次亚甲基蓝;定容、静置1 min,置于血球计数板上,用显微镜计量细胞个数,其中,死亡率计算如公式(1)所示:

(1)
葡萄糖测定:生物传感分析仪SBA。
乙醇测定:气相色谱:初始柱温70 ℃,升温速率20 ℃/min,终止温度为190 ℃;前进样口温度180 ℃;前检测器温度220 ℃;氢气流速30 mL/L,空气流速200 mL/L,氮气流速30 mL/L。相关计算如公式(2)~公式(4)所示:
(2)

(3)

(4)
扫描电镜:参照文献[10]。
2 结果与分析
2.1 不同转速对菌体吸附的影响
如图1所示,转速越高,游离酵母数越高,说明菌体吸附量越低,故转速过大不利于菌体吸附。棉纤维对菌体的吸附作用是利用载体和细胞表面所带电荷的静电引力,使细胞吸附于载体上。载体对微生物的吸附主要是细胞表面与载体表面间的范德华力和离子型氢键的静电相互作用的结果,这种作用力相对较弱[11-12]。而当转速过低,如转速40 r/min时,游离酵母数几乎为0,这是由于菌体大量沉淀,并非由于吸附的作用,此转速下,菌体由于自身重力较大,下沉作用远远大于横向吸附的作用,故转速过低,也不利于菌体吸附。当转速为80 r/min时,无菌体沉淀现象,游离酵母数较低,说明菌体已经几乎被完全吸附。考虑后面不同修饰作用对载体吸附能力评估实验,故将转速定为100 r/min相对较佳,此时菌体吸附比例为71.2% (初始OD值为12.10)。
2.2 固定化载体修饰对菌体吸附的影响
如图2所示,经过F6处理后的载体吸附效果有不同程度提升。F6-1与未修饰的载体对酵母吸附能力差异不显著(P>0.05)。F6-2、F6-2与未修饰的载体对酵母吸附能力差异显著(P<0.05),其中F6-2处理效果更佳。F6-2对酵母吸附量达到83.1%(初始OD值为11.03),比未处理的固定化载体提高了15.9%。
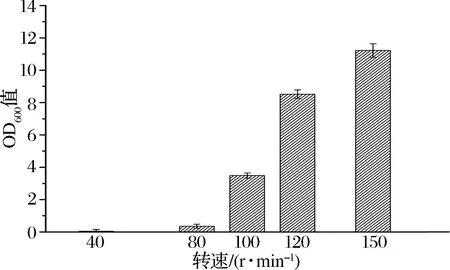
图1 不同转速对载体吸附能力的影响Fig.1 Effect of different rotational speeds on carrier adsorption capacity
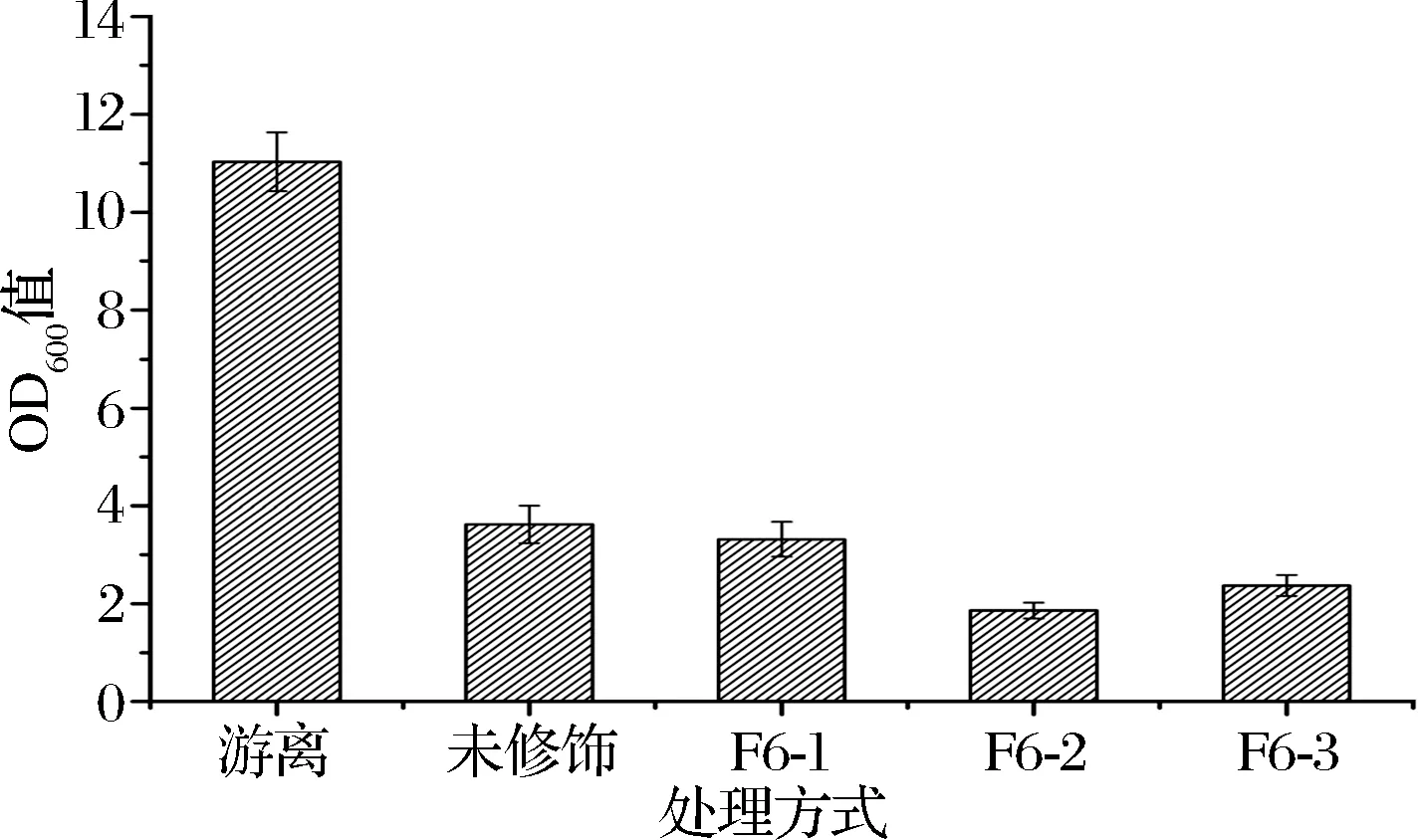
图2 不同处理方法对载体吸附能力的影响Fig.2 Influence of different treatment methods on carrier adsorption capacity
从电镜照片上看(图3),处理过的载体表面(图3-b)相比未处理的(图3-a)更为粗糙。由图3-c可明显发现,菌体易于在粗糙的表面聚集生长。另一方面研究表明,酵母在酸性环境下表面携带正电荷[13]。当棉纤维表面羟基与硅氧烷发生耦联反应,使得棉纤维引入丙烯酸基团而呈负电荷特性。故修饰后的载体与酵母的结合能力进一步提高。结果表明,F6-2对载体的修饰是有效的,且修饰后的载体对菌体吸附效果也是显著的。

a-未处理载体表面;b-化学处理载体表面; c-修饰载体表面吸附的酵母图3 载体表面电镜照片Fig.3 Electron microscopy of carrier surface
2.3 游离发酵与反复批次发酵对比
发酵终点以不产气泡及残还原糖降至3 g/L以下为准。从表1看,固定化发酵周期呈现下降趋势,相应的产率有显著提高。发酵至6批时发酵周期缩短至18 h,产率达到6.33 g/(L·h)。乙醇浓度和转化率值较为稳定。发酵6批的平均转化率和产率分别为96.77%和5.22 g/(L·h),相比游离发酵,分别提高3%和51.7%。相关研究表明,固定化载体可促进菌体形成明显的生物膜,降低细胞毒害作用。同时由于显著的菌群优势使得反应速率大幅提高[14-16],本文研究结果与文献报道的结果相一致。
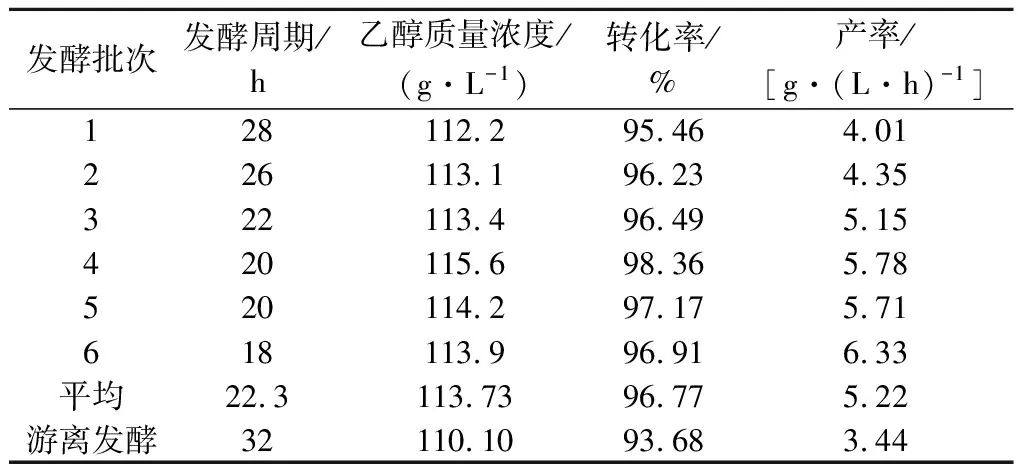
表1 各批次发酵指标Table 1 Fermentation indexes of each batch
2.4 细胞集群效应分析
从表2中可发现,游离发酵体系中,3个平行样结果差距不明显,说明平行效果较好。游离发酵总细胞数近2.5×108个/mL,发酵终点死亡率较高、出芽率较低。
从图4-a可明显发现,游离细胞部分呈现不饱满形态。这主要由于高酒度低营养环境中游离酵母在搅拌的剪切作用下更易发生衰退现象[16]。

a-游离酵母;b-固定化酵母图4 载体表面电镜照片Fig.4 Electron microscopy of carrier surface
在固定化发酵体系中,如表3所示,游离酵母细胞为0.9×108个/mL左右,浓度较为恒定。而载体上吸附菌量随着批次增加呈现上升趋势。另外,载体上的菌体出芽率较低,且相比游离细胞,形态更为完整(图4-b),说明细胞生长周期显著延长。而载体上细胞死亡率相对较高,这可能是由于内部菌体受传质影响引起的死亡现象[17]。总体细胞数呈现上升趋势可能由于每批次的游离细胞部分吸附于载体表面所致。6批培养后菌体吸附量为200×108个/g,(其折算到固定化发酵体系里为4.03×108个/mL),固定化发酵体系总酵母数为4.86×108个/mL,是游离发酵体系的2倍。这与上述2种模式发酵速率之间的差别结果较为一致。祝英等[18]对比了海藻酸钙凝胶法、琼脂凝胶法、明胶-戊二醛交联法和聚乙烯醇(polyvinyl alcohol,PVA)对酵母固定化发酵影响,发现8%的PVA发酵效果更佳,载体吸附量为8×108个/g,发酵48 h酒度为10%~11%,即对应的反应速率近2 g/(L·h),是游离发酵速率的2~3倍。相关研究表明,细胞吸附于载体后大量增殖,形成密集的菌群,进而显示出集群效应[19]。集群效应使群体成员之间实现生理协同作用,提高整个种群的代谢活力和生存能力[14]。吸附固定化方法克服了传统包埋、交联和共价结合法的缺陷,既能使细胞聚集发挥作用,又不会对细胞本身的活性产生显著影响[20]。集群效应提高了菌群优势,从而表现为较强的催化效率。
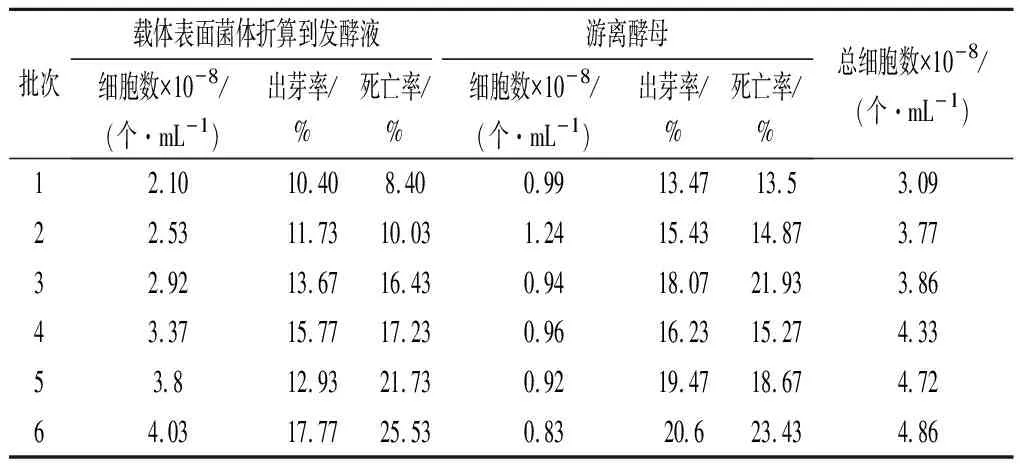
表3 固定化细胞发酵体系酵母生长情况Table 3 Yeast growth of immobilized cell fermentation system
3 结论与讨论
(1)载体对菌体的吸附与转速有显著相关性,较高与较低均不利于酵母细胞吸附,转速为100 r/min时效果最佳,菌体吸附比例达71.2%。
(2)经过F6-2处理后的载体吸附效果有明显提升,其吸附比例达到83.1%,比未处理的固定化载体提高了15.9%。处理过的载体表面相比未处理的更为粗糙,菌体易于在粗糙的表面聚集生长。
(3)固定化发酵稳定性较好,发酵6批的平均转化率和产率分别为96.77%和5.22 g/(L·h),相比游离发酵,分别提高3%和51.7%。
(4)固定化发酵6批后菌体吸附量为4.03×108个/mL,总酵母数为4.86×108个/mL,是游离发酵体系的2倍,这可以定量地解释2种模式发酵速率之间的差异性。
