细叶韭花醇提物体外抗氧化及对α-葡萄糖苷酶抑制作用的研究
2022-02-25李美萍侯健刘燕尉立刚郭彩霞
李美萍,侯健,刘燕,尉立刚,郭彩霞
(山西大学 生命科学学院,太原 030006)
细叶韭花作为北方地区传统的调味品,经油炸后呈现浓郁香味,且有多种含硫化合物[1-2],有抗菌、预防动脉硬化和心血管疾病、抗过敏等功效[3]。细叶韭花中含有多种营养物质,如蛋白质、氨基酸等[4]。随着餐饮业的发展以及人们崇尚“自然”、讲求天然的想法,目前,细叶韭花在中国北方餐饮业家喻户晓,尤其独特的风味赢得了消费者的青睐。到目前为止,国内对其物候学、生物学特性以及栽培技术的文献报道相对较多,而对其风味成分、提取物化学成分以及抑菌、抗氧化能力的研究则相对较少[5-9]。近年来,天然的抗氧化剂及降血糖药物愈发受到人们的关注[10-13]。细叶韭花作为新型的药食同源调味品,其醇提物的抗氧化及降血糖作用研究并未见报道。在前期研究工作的基础上,本实验继以乙醇为溶剂,用不同浓度的乙醇提取细叶韭花中有效成分,并对其抗氧化及降血糖实验进行了研究,以期找到细叶韭花醇提物的最佳浓度,为利用细叶韭花天然的抗氧化性开发新产品、风味复合调味品建立独特的地方产品特色提供了数据上的支持与理论上的指导。
1 材料与仪器
1.1 材料与试剂
细叶韭花:采自山西省朔州市;α-葡萄糖苷酶、PNPG:美国Sigma公司;阿卡波糖:上海源叶生物科技有限公司。
1.2 仪器
UV-Probe 2550双光束紫外光谱仪 日本岛津公司;Infinite M200 Pro多功能酶标仪 Tecan公司。
2 实验方法
2.1 细叶韭花醇提物的制备
参考文献[9],称取一定量细叶韭花粉末,按1∶15的料液比加入不同浓度乙醇提取剂,置于250 mL具塞锥形瓶中,在40 ℃下恒温浸提30 min,减压抽滤得上清液,滤渣再次提取,合并所得滤液,蒸发浓缩得浸膏。用30%乙醇溶解上述浸膏即为本实验所用的细叶韭花醇提液。
2.2 细叶韭花醇提物体外抗氧化作用
2.2.1 清除DPPH自由基能力
测定方法参照文献[14-17],稍作修改。准确称取0.0015 g DPPH配制成0.1 mmol/L的标准试液,避光保存。分别移取上述不同乙醇浓度提取液2 mL于10 mL试管中,再加入2 mL DPPH溶液,避光放置30 min,于517 nm波长处测吸光度(Ai)。用Vc做阳性对照,每样重复3次,取平均值。清除率按照公式(1)进行计算。
(1)
式中:Ai为提取液+DPPH的吸光度;Aj为乙醇+提取液的吸光度;A0为乙醇+DPPH的吸光度。
2.2.2 细叶韭花醇提物对ABTS自由基清除能力的测定
对ABTS自由基清除能力的测定参照文献[14-18],并适当修改。准确称取0.0200 g ABTS于10 mL样品瓶中,加入2.4 mmol/L的过硫酸钾5.2 mL溶解,得到ABTS母液,避光12 h。准确移取ABTS母液1.6 mL,用无水乙醇定容至100 mL容量瓶中,保存待用。分别在10 mL具塞试管中依次加入上述不同乙醇浓度提取液、ABTS溶液各2 mL,并用蒸馏水定容至刻度,避光保存30 min,在734 nm波长处测吸光度值。用Vc做阳性对照,每样重复3次,取平均值。清除率按照公式(2)进行计算。
(2)
式中:Ai为提取液+ABTS的吸光度;A0为蒸馏水+ABTS的吸光度。
2.2.3 细叶韭花醇提物总还原力能力的测定
对总还原力能力的测定参照文献[16]和文献[19],并稍作修改。取1 mL提取液于10 mL试管中,加入pH 6.6的磷酸盐缓冲液2 mL、1%的铁氰化钾2 mL,混匀,于50 ℃恒温水浴20 min,冷却后加入10%的三氯乙酸2 mL,4000 r/min离心10 min。取离心后的上清液2 mL,加入2 mL蒸馏水、0.1%的三氯化铁0.4 mL,混匀,静置10 min,在700 nm下测其吸光度值。用Vc做阳性对照,每样重复 3 次,取平均值。
2.3 细叶韭花醇提物对α-葡萄糖苷酶抑制作用的研究
2.3.1 α-葡萄糖苷酶抑制率的测定
对α-葡萄糖苷酶抑制率的测定参照文献[17-20],并适当修改。用0.1 mol/L pH 6.8磷酸钠缓冲液配制1.0 U/mL α-葡萄糖苷酶溶液和1.0 mmol/L PNPG溶液。将600 μL 1.0 U/mL α-葡萄糖苷酶、200 μL磷酸钠缓冲液,以及各200 μL不同浓度样品提取液(50,60,70 mg/mL)混匀,在37 ℃ 恒温水浴10 min,再加入200 μL 1.0 mmol/L PNPG,恒温反应30 min,最后加入2 mL 0.5 mol/L的Na2CO3使反应终止,于400 nm波长处测定吸光度。用阿卡波糖做阳性对照。抑制率按照公式(3)进行计算。
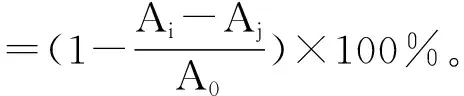
(3)
式中:A0为用磷酸缓冲溶液代替样品的吸光度;Ai为加细叶韭花提取物的吸光度;Aj为用磷酸缓冲溶液代替α-葡萄糖苷酶溶液的吸光度。
2.3.2 酶动力学的测定
对α-葡萄糖苷酶抑制作用的动力学实验参照文献[17-20]的方法,稍作修改。酶浓度不变(1.0 U/mL),设置6个底物PNPG浓度。样品设置0,3 mg/mL两个浓度,按上述2.3.1中的方法进行,在400 nm处测定吸光度,每隔5 min测一次。以底物浓度的倒数(1/S)为横坐标,以反应速度的倒数(1/V)为纵坐标,绘制Lineweaver-Burk双倒数曲线,确定样品对α-葡萄糖苷酶的抑制类型。
3 结果与讨论
3.1 细叶韭花醇提物抗氧化
3.1.1 细叶韭花醇提物对DPPH自由基的清除作用
实验考察了0.05,0.1,0.2,0.4 mg/mL的浓度梯度下乙醇提取物对DPPH自由基的清除能力,并比较了不同浓度Vc与60%醇提物清除DPPH自由基能力,其清除率测定结果见图1和图2。

图1 细叶韭花醇提物对DPPH自由基清除率的测定Fig.1 Determination of DPPH free radical scavenging rates by ethanol extracts from Allium tenuissimum L. flowers
由图1可知,不同的细叶韭花醇提取物在0.05~0.4 mg/mL浓度范围内,对DPPH自由基的清除能力随着提取物浓度的增大而增强。在测试浓度范围内,细叶韭花60%醇提物的抑制效果最好,0.4 mg/mL时,对DPPH自由基的清除率达到83%。

图2 Vc与60%醇提物对DPPH自由基清除率的测定Fig.2 Determination of DPPH free radical scavenging rates by Vc and 60% ethanol extract
由图2可知,Vc对DPPH自由基的清除率优于60%醇提物。当60%醇提物浓度增大到0.8 mg/mL时,对DPPH自由基的清除率与0.1 mg/mL的Vc相当。
3.1.2 细叶韭花醇提物对ABTS自由基的清除作用
实验考察了0.05,0.1,0.2,0.4 mg/mL的浓度梯度下乙醇提取物对ABTS自由基的清除能力及不同浓度的Vc与60%醇提物对ABTS自由基清除能力的比较,其结果见图3和图4。
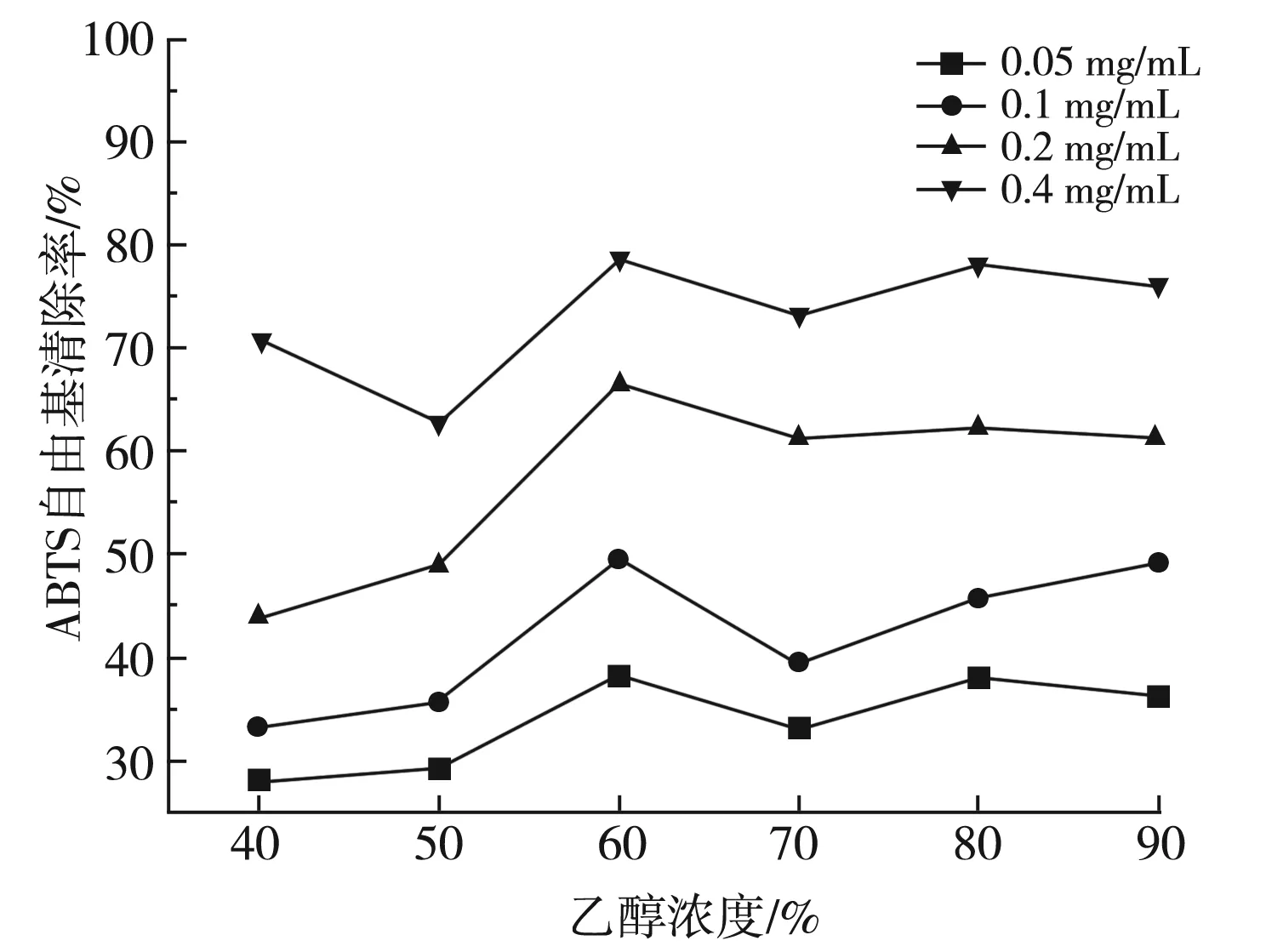
图3 不同提取物对ABTS自由基清除率的测定Fig.3 Determination of ABTS free radical scavenging rates by different extracts
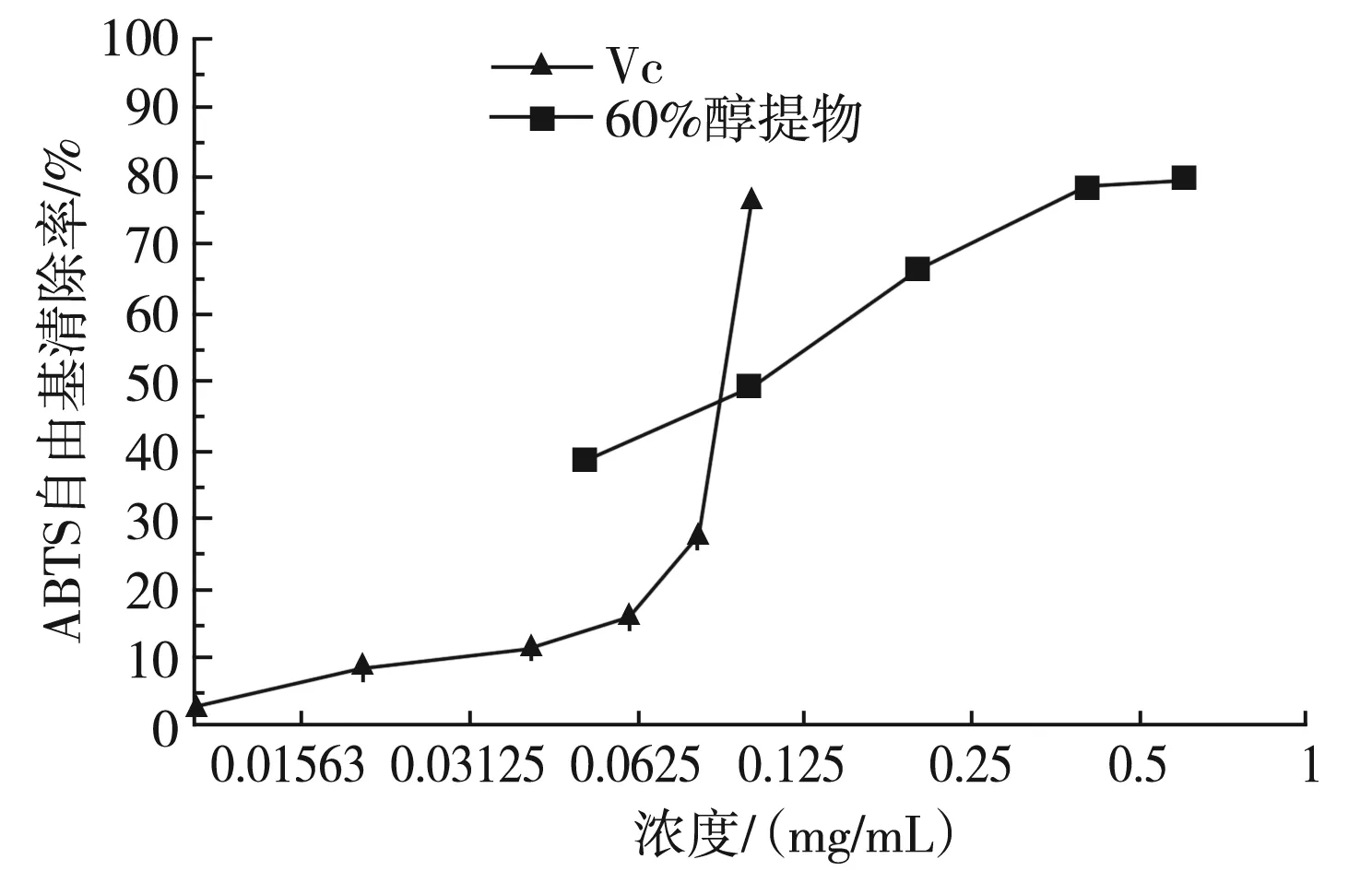
图4 Vc与60%醇提物对ABTS自由基清除率的测定Fig.4 Determination of ABTS free radical scavenging rates by Vc and 60% ethanol extract
由图3可知,细叶韭花醇提物对ABTS自由基具有良好的清除能力,且随着提取物浓度的增大其对ABTS自由基的清除能力越强,其中60%的细叶韭花醇提物对ABTS自由基的清除能力最强,在0.05~0.4 mg/mL浓度范围内,清除率分别达到38.34%、49.55%、66.69%、78.57%。
由图4可知,0.8 mg/mL 60%醇提液对ABTS自由基的清除能力与0.1 mg/mL的Vc能力相当。
3.1.3 细叶韭花醇提物总还原能力的测定
实验考察了1,2,3,4 mg/mL的浓度梯度下乙醇提取物总还原力的测定及不同浓度的Vc与60%醇提物总还原力的比较,其结果见图5和图6。

图5 不同提取物对总还原力的测定Fig.5 Determination of total reducing ability of different extracts
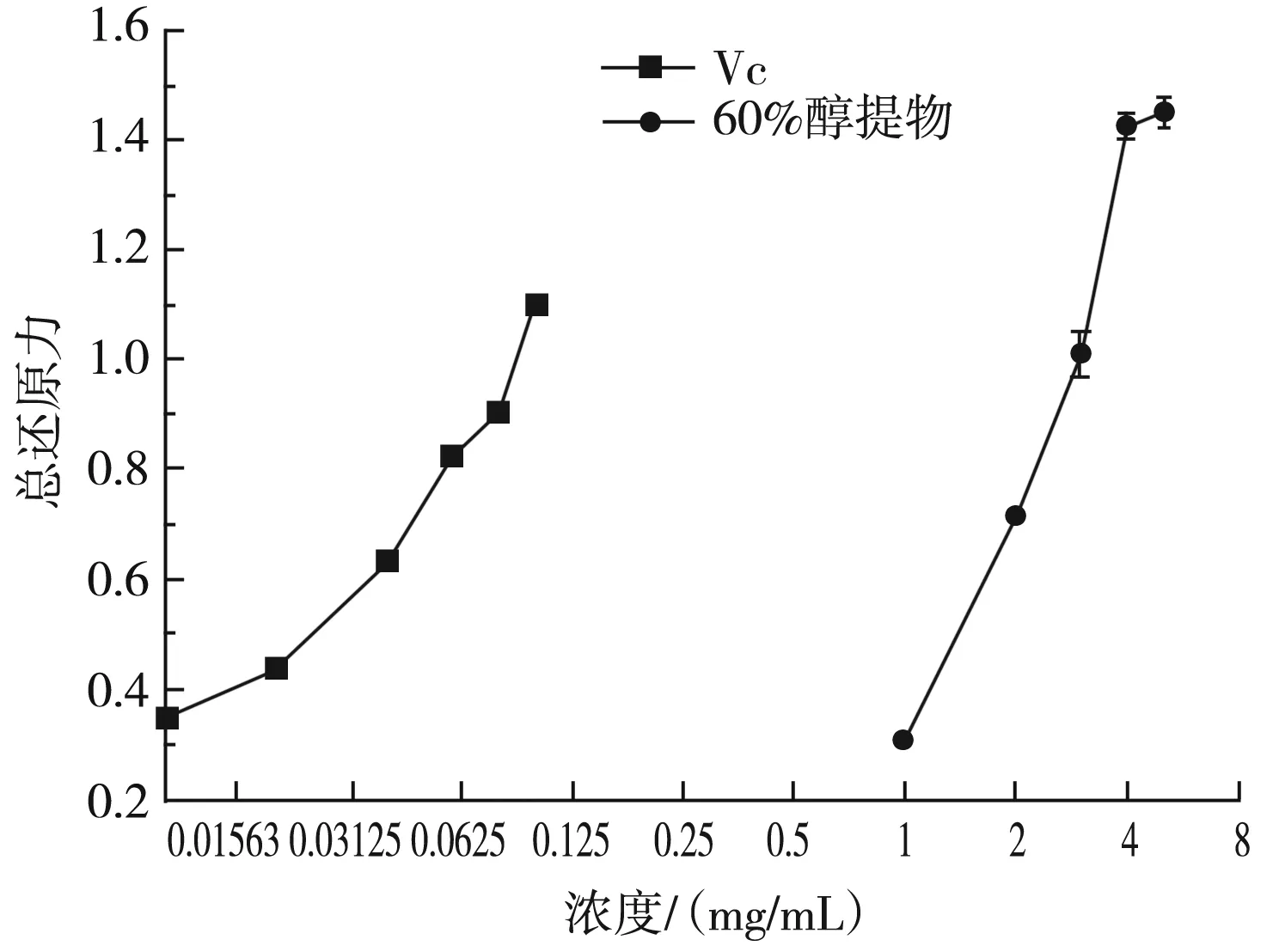
图6 Vc与60%醇提物对总还原力的测定Fig.6 Determination of total reducing ability of Vc and 60% ethanol extract
在2.2.3的条件下测定了不同提取物在不同浓度下的总还原能力,结果用吸光度值表示,吸光度值越大,其总还原能力越强。由图5可知,随着醇提物浓度的增加,其还原能力越强,且60%醇提物的还原能力最强。
由图6可知,VC对总还原力的作用强于60%的醇提物,且它们均随着浓度的升高对总还原力的作用增强。
3.2 细叶韭花醇提物对α-葡萄糖苷酶的抑制作用
3.2.1 细叶韭花醇提物对α-葡萄糖苷酶抑制率的测定
实验考察了50,60,70 mg/mL浓度梯度下乙醇提取物对α-葡萄糖苷酶的抑制作用及不同浓度的阿卡波糖与60%醇提物对α-葡萄糖苷酶的抑制作用的比较,其结果见图7和图8。
由图7可知,当样品质量浓度为50~70 mg/mL时,细叶韭花醇提物对α-葡萄糖苷酶的抑制作用明显。当细叶韭花醇提物浓度为50 mg/mL时,最高抑制率可达55%。当细叶韭花醇提物浓度为70 mg/mL时,最高抑制率可达83%。
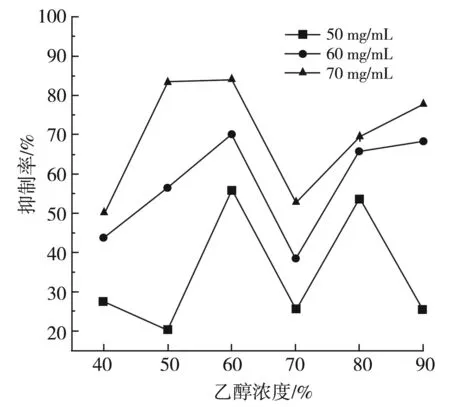
图7 不同提取物对α-葡萄糖苷酶抑制率的测定Fig.7 Determination of different extracts on the inhibition rates of α-glucosidase
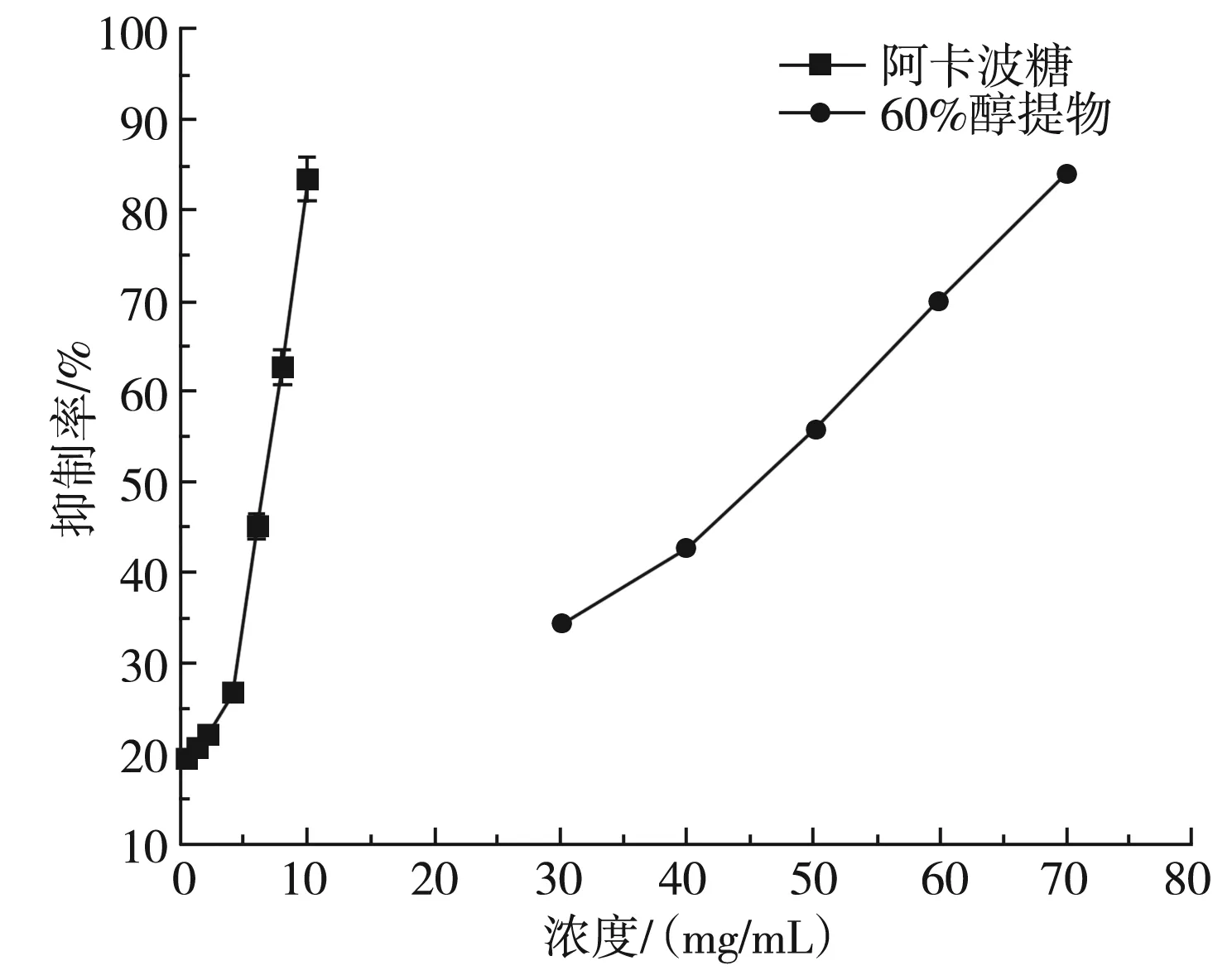
图8 阿卡波糖与60%醇提物对α-葡萄糖苷酶抑制率的测定
由图8可知,阿卡波糖和60%的细叶韭花醇提物对α-葡萄糖苷酶均具有抑制效果且具有浓度依赖性,当醇提物浓度达40 mg/mL时,与6 mg/mL阿卡波糖对α-葡萄糖苷酶的抑制效果相当,其半抑制率(IC50)分别为6.67 mg/mL(阿卡波糖),45.95 mg/mL(60%醇提物);IC50值表明,阿卡波糖对α-葡萄糖苷酶的抑制效果强于细叶韭花60%的醇提物。这可能是由于细叶韭花醇提物中主要的化学成分是紫云英苷,属于黄酮类化合物,有研究表明黄酮类化合物的降血糖机制能促进胰岛素的分泌;并且黄酮类化合物只有与其他活性组分协同作用,才能抑制α-葡萄糖苷酶的活性。因此,细叶韭花醇提取物对α-葡萄糖苷酶的抑制效果较阿卡波糖低,可能与提取物中其他活性成分的含量不同有关。
3.2.2 细叶韭花醇提物对α-葡萄糖苷酶的抑制类型
加入不同浓度的60%细叶韭花醇提物后,按照2.3.2方法绘制Lineweaver-Burk双倒数曲线,结果见图9。
由图9可知,在未加入细叶韭花醇提物(0 mg/mL)的反应中,所得曲线方程为y=139.89x+20.25,R2=0.995,同时计算得Vm=0.049,Km=0.069;在加入3 mg/mL细叶韭花醇提物的反应中,得拟合曲线方程y=363.85x+147.17,R2=0.971,计算得Vm′=0.0068,Km′= 2.474。由此可见,加入低浓度细叶韭花醇提物抑制反应后,Vm减小,α-葡萄糖苷酶的米氏常数Km增大,即低浓度细叶韭花醇提物对α-葡萄糖苷酶为反竞争性和非竞争性混合的抑制类型。另外,以抑制类型图中的斜率对抑制剂浓度二次作图,求得细叶韭花醇提物对α-葡萄糖苷酶的抑制常数 Ki=1.92。
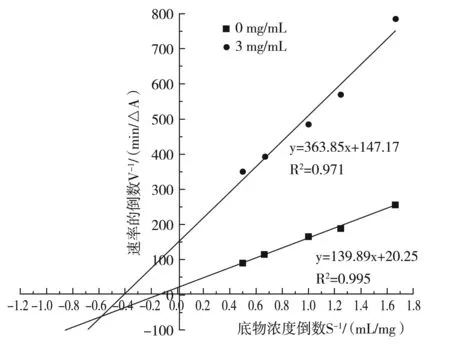
图9 不同浓度样品与α-葡萄糖苷酶反应的Lineweaver-Burk双倒数曲线Fig.9 Lineweaver-Burk double reciprocal curves of α-glucosidase reaction with different concentration of samples
4 结论
本实验对细叶韭花醇提取物体外抗氧化活性及对α-葡萄糖苷酶的抑制效果进行了研究。结果表明,细叶韭花醇提物能够有效地清除DPPH和ABTS自由基,且有很强的总还原能力,并能很好地抑制α-葡萄糖苷酶,其中尤以60%乙醇提取物的效果最佳。同时,细叶韭花醇提物的抗氧化性与α-葡萄糖苷酶的抑制作用均呈浓度依赖性。前期实验表明,60%乙醇提取物中主要成分为紫云英苷,其化学名为山奈酚-3-葡萄糖苷,具有黄酮类化合物的抗炎、抗氧化、抗菌等作用。所以,深入研究细叶韭花醇提取物的抗氧化活性及对α-葡萄糖苷酶的抑制效果对延缓衰老、预防糖尿病等方面具有重要意义。随着未来食品技术、工艺的不断提高,为地方企业开发复方调味品以满足消费者日渐提升的烹饪需求提供一定的理论基础,同时,细叶韭花提取物具有潜在的天然抗氧化性和抑菌作用,为其进一步应用到菜肴保鲜和肉制品品质延长均有一定的实验依据,既可以实现地方独特的产品特色,又可以实现产品由现在的单一向多元化转变,对地方经济增长具有促进作用。
