海巴戟果实发育过程中果糖、果糖激酶及其基因的变化
2022-02-25王青芬宫树森白艳刘念王培源吴田
王青芬, 宫树森, 白艳, 刘念, 王培源, 吴田
海巴戟果实发育过程中果糖、果糖激酶及其基因的变化
王青芬, 宫树森, 白艳, 刘念, 王培源, 吴田*
(西南林业大学园林园艺学院,国家林业和草原局西南风景园林工程技术研究中心,云南省功能性花卉资源及产业化技术工程研究中心,昆明 650224)
为揭示海巴戟果实风味形成机制,对果实发育过程的果糖激酶(FRK)活性及其基因的表达模式进行了研究。结果表明,海巴戟果实中的果糖、蔗糖、葡萄糖含量随发育不断积累,均在果实完全成熟时达到最高值,而果糖激酶活性随果实发育不断下降。从果实中克隆了果糖激酶基因,命名为,GenBank登录号为MW380742, 其ORF全长为984 bp,编码327个氨基酸,与咖啡()的FRK2氨基酸序列相似性为98%。qRT-PCR表明,的表达量在果实发育过程中呈下降趋势,当果实成熟时表达的趋于平稳,与果糖激酶活性变化趋势一致。因此,可能通过调控果实果糖激酶活性而参与糖代谢,对调控果实风味的形成具有重要作用。
海巴戟;果糖激酶基因;果糖;表达
海巴戟(),亦称诺丽,为茜草科(Rubiaceae)巴戟天属植物,果实中含有多种营养成分,如维生素、矿物质、氨基酸、塞洛宁原、多糖、香豆素等重要成分。2004年全球诺丽产业已实现40亿美元的销售,且呈逐年增加的态势,主要用于增强免疫力的保健食品[1]。海巴戟果实属于典型的呼吸跃变型,在果实后熟过程中积累有益于人体健康的营养成分并形成其特有的风味,对果实成熟品质特性和品质形成进行研究具有重要意义。而果实风味形成的重要决定因素是糖类物质代谢,如葡萄糖、果糖、蔗糖等,蔗糖是大多数植物光合作用的同化产物[2],在转化酶的作用下分解为果糖和葡萄糖,果糖的进一步利用需要被果糖激酶(fruc- tokinase, FRK, EC 2.7.1.4)或者己糖激酶(hexokinase, HK, EC 2.7.1.1)磷酸化,但果糖激酶与果糖的亲和力更高,植物中的果糖可能主要被果糖激酶磷酸化[3-5]。同时FRK调节植物的代谢和生长发育[6], 因此,研究海巴戟FRK及其在果实发育过程中的表达情况,有利于了解果糖代谢,为改善果实风味提供理论基础。
目前,已从多种高等植物中克隆了基因,木薯()中有6个基因(),其在叶、茎、花和果实中表达模式不同[7]。柑橘()有2个基因(和),在幼叶或幼果等幼嫩组织中表达,而在成熟的果实中表达,FRK活性随果实发育呈下降趋势,与果实中果糖的积累有关, 推测FRK活性在柑橘果实果糖积累中起重要作用[8]。Qin等[9]从枇杷()中克隆了1个基因,的表达量和FRK活性在果实发育早期高于成熟时期,与果糖含量变化趋势相反,表明高FRK活性可能抑制果糖的积累。因此,FRK在植物不同的发育时期的表达具有特异性。
目前对海巴戟的研究主要集中在化学成分、生理特征、药用价值、种质资源、繁殖和加工技术等方面,对海巴戟果实成熟调控机理的研究鲜有报道。本研究以不同发育时期海巴戟果实为材料,因为果实中糖含量和FRK活性具有一定的关系,基于前期RNA-seq研究结果,进一步克隆了果糖激酶基因,分析了在海巴戟果实不同发育时期中的表达模式,为后续深入研究相应基因功能和调控海巴戟果实品质提供理论和技术基础。
1 材料和方法
1.1 材料
海巴戟()种植于云南省玉溪市元江县海巴戟种植基地。元江是典型的干热河谷气候,年平均为23.7 ℃,年均降水量约800 mm,适合海巴戟的生长发育[10]。海巴戟果实发育分为花脱落期(4成熟)、幼果形成期(5成熟)、膨大期(6成熟)、绿熟期(8成熟)和白熟期(全熟)。采集不同发育时期的果实切碎,迅速用液氮速冻,放于-80 ℃冰箱中备用。
1.2 果实糖含量
海巴戟果实糖含量参照帅良等[11]的方法测定,用高效液相色谱仪(Agilent1260,德国)测定,每个发育时期3个重复。所用标准品为果糖、葡萄糖和蔗糖,均为分析纯样品,通过比较样品和标准品的峰保留时间和峰面积,分析糖的种类并计算含量。
1.3 果实的果糖激酶活性测定
参照帅良等[11]的方法提取果糖激酶(FRK),用紫外分光光度计(UV-5100, 上海)测定FRK活性, 所有操作都在冰上完成,重复3次。
1.4 McFRK2的表达分析
基于海巴戟RNA-seq研究,筛选出4个基因片段,其中基因在采摘后0和48 h表达量差异显著,设计荧光定量引物qFRK2 (表1),以为内参基因[12]进行qPCR扩增。反应体系为20L,包括2×SYBR Green master mix 10L,正、反向引物qFRK2各0.6L,果实cDNA模板2L,ddH2O 6.8L。qPCR反应程序为先95 ℃ 10 min; 然后95 ℃ 15 s, 60 ℃ 30 s, 72 ℃ 30 s, 共40个循环。3个重复,用2-∆∆CT计算相对表达量, 并用SPSS进行方差分析,以<0.05表示显著差异,<0.01表示极显著差异,用Origin 2019作图。
1.5 McFRK基因的克隆
采用Trigol试剂盒(鼎国生物科技有限公司,北京)提取海巴戟总RNA,用1.0%琼脂糖凝胶电泳和核酸检测仪检测RNA的质量。按照TransScript One- Step gDNA Removal and cDNA Syntjesis SuperMix试剂盒(全式金生物技术有限公司,北京)说明书操作,合成第一链cDNA。根据RNA-seq筛选的果实基因片段,使用Primer 5.0软件设计特异性引物FRK2 (表1),以反转录合成的cDNA为模板,扩增基因的全长序列。PCR反应体系为 20L,包括ddH2O 13.2L, 10×EasyBuffer 2.5L, dNTPs(2.5 mmol/L) 2L,正、反向引物FRK2各0.5L,cDNA模板1L,DNA polymeRABe 0.3L。PCR反应程序为:先95 ℃ 3 min; 然后95 ℃ 45 s, 58 ℃ 45 s, 72 ℃ 90 s, 共35个循环; 最后72 ℃7 min。于4 ℃下保存,PCR产物经电泳检测后,切胶回收,连接到pMD18-T克隆载体上,转入大肠杆菌,挑取阳性单菌送至上海生工生物科技有限公司进行测序。
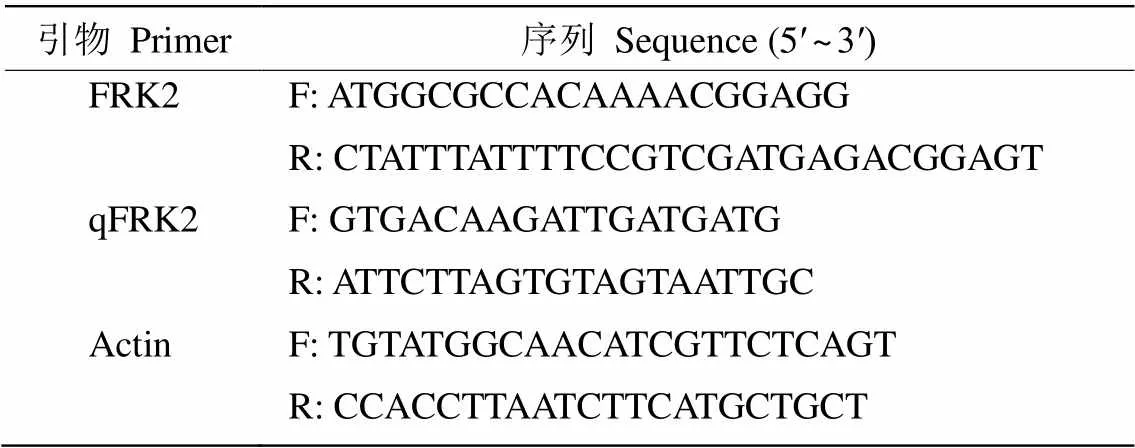
表1 引物序列及PCR程序
1.6 生物信息学分析
用NCBI-blastx进行序列比对,筛选出相似性较高的氨基酸序列,运用MEGA6软件构建系统进化树。采用ORF (https://www.ncbi.nlm.nih.gov/orffinder/)进行开放阅读框比对并推导氨基酸序列,用NCBI- CD-Search进行保守结构域分析。用Cell-PLoc 2.0[13](http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)进行亚细胞定位。用TMHMM Server v.2.0[14](http://www.cbs.dtu.dk/services/TMHMM/)进行蛋白跨膜结构域预测。
2 结果和分析
2.1 果实的FRK活性和糖含量变化
从图1可见,FRK活性随果实的发育而不断下降,果实完全成熟时最低。果实不同发育期的果糖、蔗糖和葡萄糖含量变化趋势相似,即3种糖含量都随果实的发育不断升高,均在果实完全成熟时最高,分别为20.02、8.76和10.01 mg/g。果实在成熟过程中,果糖含量显著高于葡萄糖和蔗糖含量,并且与葡萄糖和蔗糖的总量大致相等。以膨大期果实为分界,从花脱落期到膨大期FRK活性下降速率高于从膨大期到白熟期,果糖、蔗糖、葡萄糖含量从花脱落期到膨大期的上升速率高于从膨大期到白熟期。FRK活性与糖含量呈负相关关系,说明高水平的FRK活性可能会抑制果实中糖的积累。
2.2 基于海巴戟转录组测序的FRK基因克隆
RNA-seq测序可以得到植物特定组织或器官在特定时期的基因表达信息,有助于挖掘次生代谢产物合成调控关键酶基因[15]。经RNA-seq[16](PRJNA 503490)分析,FRK参与了果糖和甘露糖代谢(ko- 00051)、淀粉和蔗糖代谢(ko00500)、氨基糖和核苷糖代谢(ko00520)途径。在ko00051和ko00500途径中,果糖(d-fructose)在FRK和HK作用下转化为-d-果糖-6P (-d-fructose-6P),然后进入糖酵解或糖异生途径。在ko00520途径中,果糖(fructose)在FRK和HK作用下磷酸化为果糖-6P (fructose-6P),然后进入糖酵解和糖异生阶段。在这3个途径中,我们挖掘到差异表达的(和)和(和)基因,其中在果实采摘后0和48 h的表达差异大(图2),FC值达190.57和35.81,可见该基因为海巴戟果实果糖磷酸化的关键候选基因, 故选择该基因进行后续的全长克隆及表达分析。
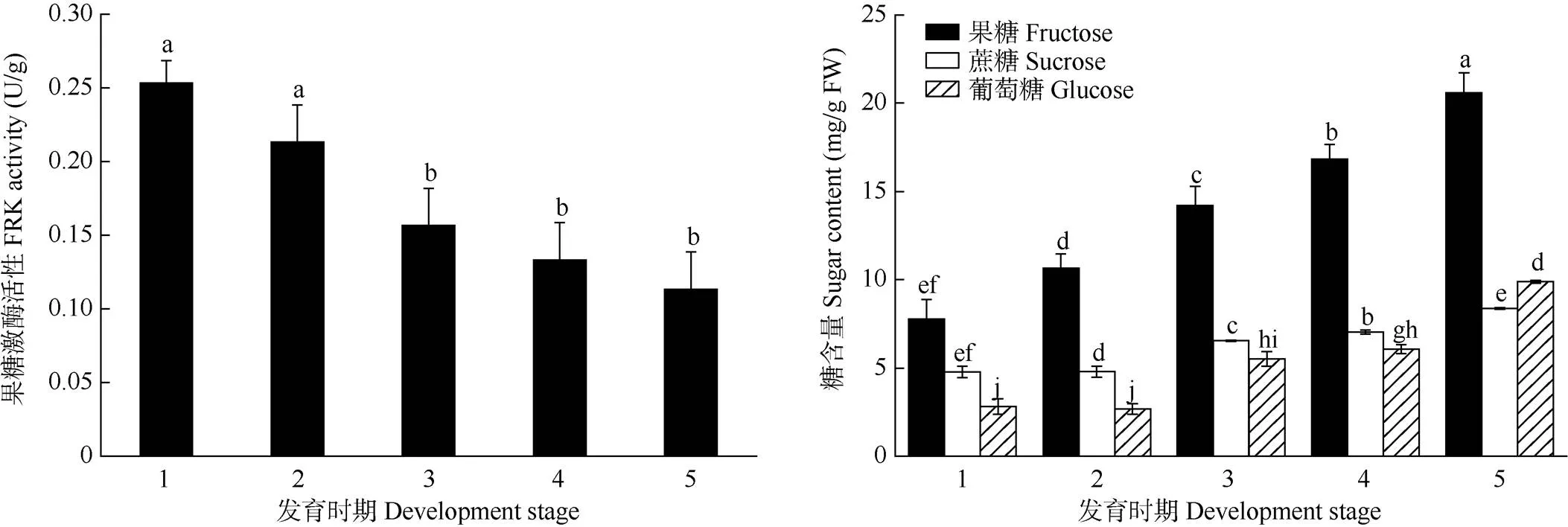
图1 海巴戟果实不同发育时期的糖含量和FRK活性。1: 花脱落期; 2: 幼果形成期; 3: 膨大期; 4: 绿熟期; 5: 白熟期。
2.3 McFRK克隆及McFRK生物信息学分析
克隆的基因的ORF全长为984 bp,编码327个氨基酸。利用NCBI-blastx进行相似性比对,结果该蛋白与咖啡()的FRK2氨基酸序列相似性为98%。系统进化树表明(图3),海巴戟的FRK与茜草科咖啡属咖啡的FRK2亲缘关系最近。这进一步表明海巴戟是基因家族成员,故将该基因命名为, GenBank登录号为MW380742。
用NCBI中的CD-Search进行保守结构域分析,表明McFRK2具有PfkB家族的高度保守特性,包含3个底物结合区域、6个ATP结合位点和3个保守结构域PLN02323、bac_FRK和RbsK, 推测Mc- FRK2蛋白可能具有保守结构域的功能,属于果糖激酶,对果糖具有高度特异性(图4)。
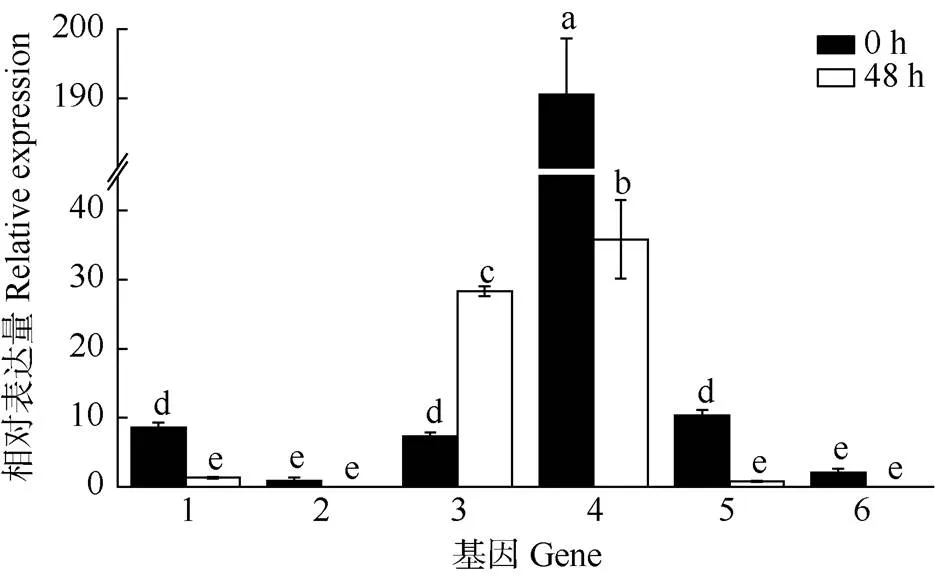
图2 RNA-seq筛选的6个差异表达基因的表达。1: TRINITY_DN17136_ c0_g1; 2: TRINITY_DN4665_c0_g1; 3: TRINITY_DN18580_c0_g1; 4: TRINITY_DN17192_c0_g1; 5: TRINITY_DN17601_c0_g1; 6: TRINITY_ DN10207_c0_g1。
利用Cell-PLoc 2.0进行亚细胞定位预测,结果表明McFRK2蛋白主要位于细胞质中。TMHMM Server v.2.0的跨膜结构预测表明,该蛋白没有跨膜结构域,暗示McFRK2蛋白主要在细胞质合成并行使功能,属于非分泌蛋白。
2.4 McFRK2的表达分析
随果实的发育,表达量逐渐下降,但在果实接近完全成熟时表达量趋于稳定(图5)。从花脱落期到果实膨大期,的表达虽逐渐下降,但维持在相对较高的水平。白熟期果实的表达量最低。
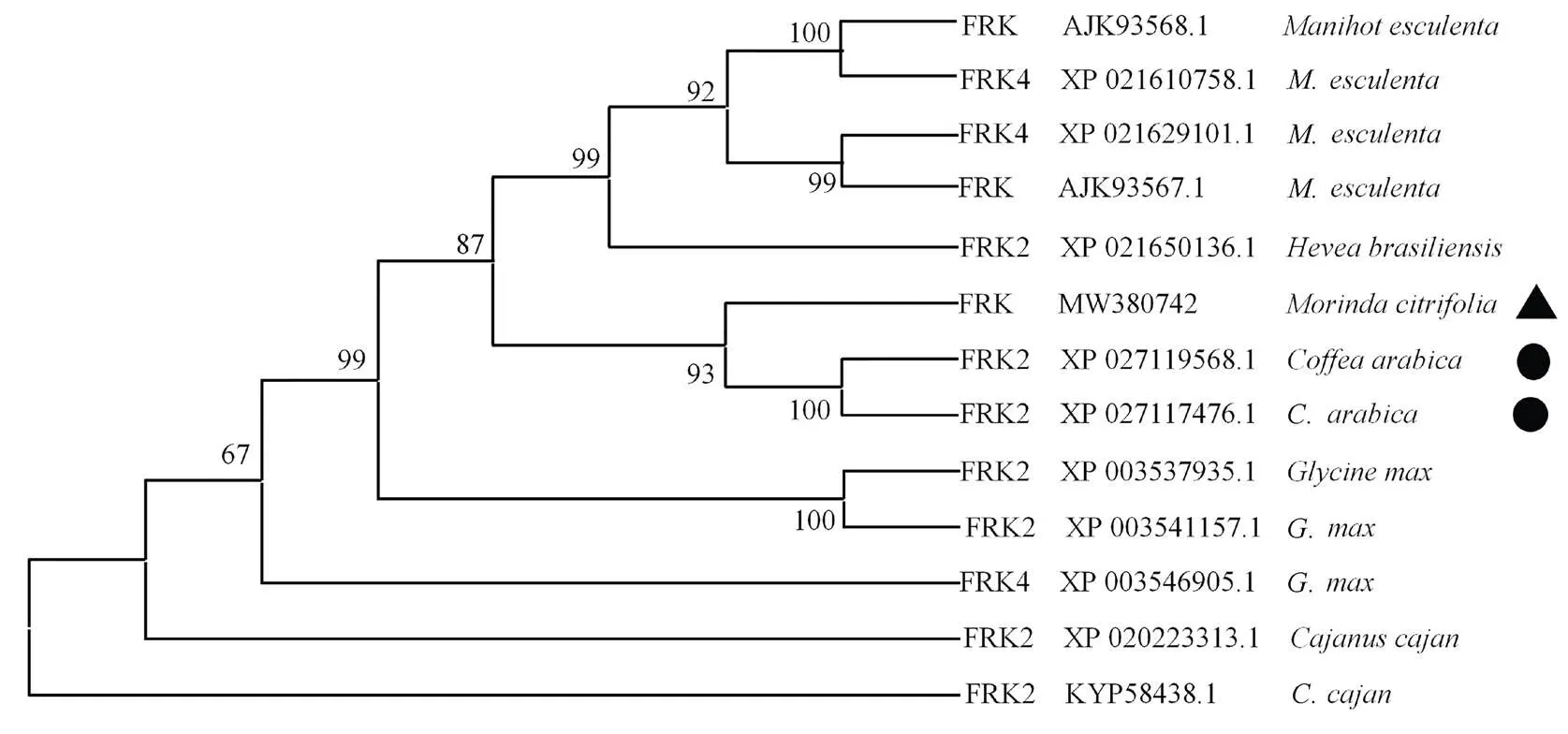
图3 不同物种间FRK蛋白的系统进化树

图4 海巴戟McFRK2蛋白保守结构域分析
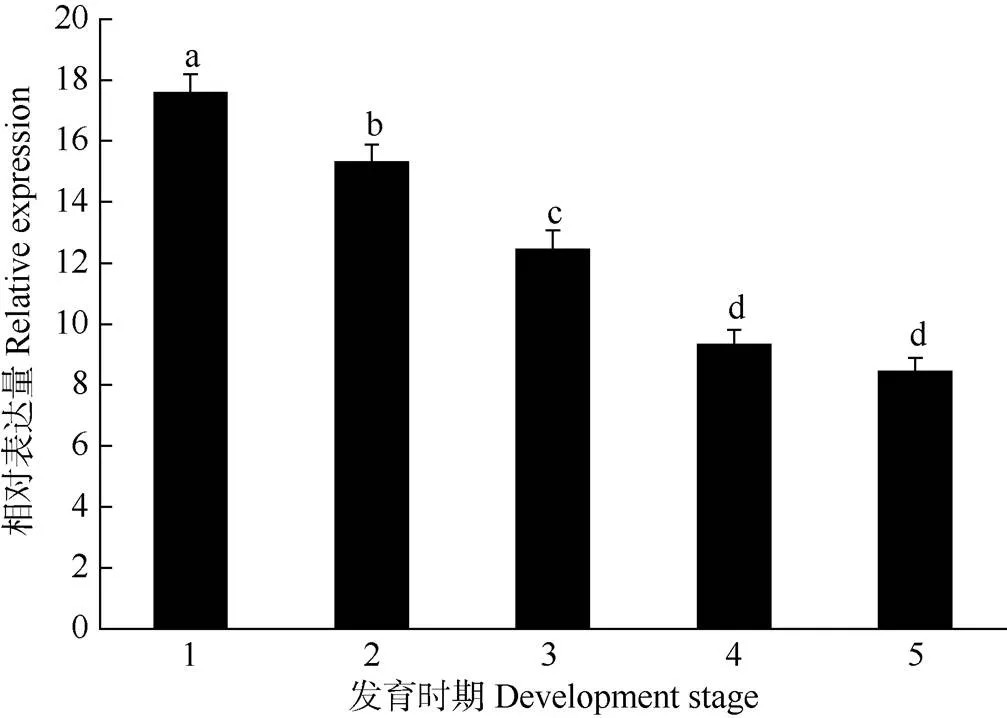
图5 海巴戟果实McFRK2基因的表达。1: 花脱落期; 2: 幼果形成期; 3: 膨大期; 4: 绿熟期; 5: 白熟期。
3 结论和讨论
果实的风味包括甜味、酸味、香味等,甜味主要与果实中的可溶性糖有关,果实中的可溶性糖主要是果糖、葡萄糖和蔗糖,以果糖最甜,其次是蔗糖、葡萄糖。因此,提高果实的总糖含量或果糖的累积均可改良果实风味[17]。基因可调节果实生长发育和可溶性糖含量。果糖是植物细胞中的主要糖分之一,是蔗糖水解的产物,必须磷酸化后才能进入下一步代谢,果糖的磷酸化主要是在FRK的催化作用下进行。在海巴戟中成功克隆出1个果糖激酶基因,经过系统进化树分析,与茜草科的咖啡聚在同一支,表明海巴戟基因与同科植物的基因相似度高,进化关系较近。本研究以海巴戟RNA-seq为基础,分析基因在糖代谢途径中的作用,有助于我们研究该基因的功能[18],改善果实的风味。
海巴戟果实中果糖、蔗糖、葡萄糖含量及FRK活性在果实发育初期含量最低,随着果实发育,积累量增加,果实成熟达到最大值。这可能是因为果实发育早期需要分解大量蔗糖用于生长,因此早期果实内没有积累大量果糖[19];果实发育后期,蔗糖大量分解,果糖随之大量积累[20],果实中的果糖含量达到最高,是蔗糖和葡萄糖含量的总和。基因随着海巴戟果实的成熟逐渐下降,这与‘红颜’草莓(‘Hongyan’)中的基因[21]、枸杞()中的基因[22]和杨梅()中的基因[23]的表达模式一致。基因属于糖调节基因[24],海巴戟基因的表达量随果实的发育而下降,推测可能与果实中含糖量的变化有关。在海巴戟果实发育的后期,糖含量达最大,但是基因的表达量最低,因此推测基因的表达也可能受糖含量的调控。海巴戟果实发育过程中,基因的表达量与果糖、蔗糖、葡萄糖含量呈负相关。对柑橘()[8]、枇杷()[9]、苹果()[25]果实的研究结果表明,、和基因在果实中的表达与果糖的积累呈负相关。因此,说明当与糖类物质分解相关基因的表达和活性下降时,有利于果实中糖类物质的积累,在苹果中过表达基因,果糖浓度下降,且同源基因在不同植物中的功能是类似的[25],进一步表明在海巴戟果糖降解过程中发挥作用。
在柑橘果实中,糖含量与果实的口感直接相关,并且是果实品质和风味[26]的重要影响因素。果糖对果实的品质具有重要的作用,也是枇杷成熟果实中主要的糖类之一[9]。进一步表明糖代谢机制的研究对改善果实风味具有重要意义。后续我们将通过构建该基因超量表达载体,利用课题组前期建立的高效遗传转化体系[27-28]进行转基因研究,以明确该基因在果糖代谢过程中及风味形成过程中的功能。
[1] LIU J L, ZHANG R, LIU Y B, et al.Literature research and discussion of Chinese medicinal properties of[J].China J Chin Mat Med, 2020, 45(5): 984-990.doi: 10.19540/j.cnki.cjcmm.20191230.403.
刘金莲, 张睿, 刘晔斌, 等.诺丽的文献研究及中药药性理论探讨 [J].中国中药杂志, 2020, 45(5): 984-990.doi: 10.19540/j.cnki.cjcmm.20191230.403.
[2] RUAN Y L.Signaling role of sucrose metabolism in development [J].Mol Plant, 2012, 5(4): 763-765.doi: 10.1093/mp/sss046.
[3] GRANOT D, DAVID-SCHWARTZ R, KELLY G.Hexose kinases and their role in sugar-sensing and plant development [J].Front Plant Sci, 2013, 4: 44.doi: 10.3389/fpls.2013.00044.
[4] GRANOT D, KELLY G, STEIN O, et al.Substantial roles of hexo- kinase and fructokinase in the effects of sugars on plant physiology and development [J].J Exp Bot, 2014, 65(3): 809-819.doi: 10.1093/jxb/ ert400.
[5] RIGGS J W, CAVALES P C, CHAPIRO S M, et al.Identification and biochemical characterization of the fructokinase gene family in[J].BMC Plant Biol, 2017, 17(1): 83.doi: 10.1186/s 12870-017-1031-5.
[6] ROLLAND F, BAENA-GONZALEZ E, SHEEN J.Sugar sensing and signaling in plants: conserved and novel mechanisms [J].Annu Rev Plant Biol, 2006, 57(1): 675-709.doi: 10.1146/annurev.arplant.57.032 905.105441.
[7] YAO Y, GENG M T, WU X H, et al.Identification, expression, and functional analysis of the fructokinase gene family in cassava [J].Int J Mol Sci, 2017, 18(11): 2398.doi: 10.3390/ijms18112398.
[8] QIN Q P, ZHANG S L, CHEN J W, et al.Isolation and expression analysis of fructokinase genes from[J].Acta Bot Sin, 2004, 46 (12): 1408-1415.
[9] QIN Q P, CUI Y Y, ZHANG L L, et al.Isolation and induced expre- ssion of a fructokinase gene from loquat [J].Russ J Plant Physl, 2014, 61(3): 289-297.doi: 10.1134/S1021443714030121.
[10] YANG F C, MAO X Y, LIU J X, et al.Variation of major environ- mental factors (temperature and precipitation) in Yuanjiang Dry-hot Valley and the response of pteridophytes [J].J Trop Subtrop Bot, 2020, 28(6): 537-546.doi: 10.11926/jtsb.4198.
杨逢春, 毛晓叶, 刘景欣, 等.元江干热河谷主要环境因子(气温和降水)变化规律及蕨类植物的分布响应 [J].热带亚热带植物学报, 2020, 28(6): 537-546.doi: 10.11926/jtsb.4198.
[11] SHUAI L, XUE X Q, NIU J J, et al.Analyses of the fructokinase activity and its gene expression during the development of longan fruits [J].J S China Agric Univ, 2015, 36(5): 99-104.doi: 10.7671/j.issn.1001-411X.2015.05.017.
帅良, 薛晓清, 牛佳佳, 等.龙眼果实发育过程中果糖激酶活性及其基因表达分析 [J].华南农业大学学报, 2015, 36(5): 99-104.doi: 10.7671/j.issn.1001-411X.2015.05.017.
[12] WU T, LAN Z Q, WANG H F.Cloning and development of real-time fluorescence quantitative PCR assay ofgene fragment from Noni [J].J CS Univ For Technol, 2018, 38(2): 16-22.doi: 10.14067/j.cnki.1673-923x.2018.02.003.
吴田, 蓝增全, 王华芳.诺丽基因片段克隆及实时荧光定量PCR方法的建立 [J].中南林业科技大学学报, 2018, 38(2): 16-22.doi: 10.14067/j.cnki.1673-923x.2018.02.003.
[13] CHOU K C, SHEN H B.Cell-PLoc: A package of Web servers for predicting subcellular localization of proteins in various organisms [J].Nat Protoc, 2008, 3(2): 153-162.doi: 10.1038/nprot.2007.494.
[14] KROGH A, LARSSON B, VON HEIJNE G, et al.Predicting trans- membrane protein topology with a hidden Markov model: Application to complete genomes [J].J Mol Biol, 2001, 305(3): 567-580.doi: 10.1006/jmbi.2000.4315.
[15] LIN J B, WANG W Y, ZOU H, et al.Analysis of related genes in phytosterol biosynthesis inbased on trans- criptome sequencing technology [J].J Trop Subtrop Bot, 2019, 27(6): 693-701.doi: 10.11926/jtsb.4025.
林江波, 王伟英, 邹晖, 等.基于转录组测序的铁皮石斛植物甾醇生物合成相关基因分析 [J].热带亚热带植物学报, 2019, 27(6): 693-701.doi: 10.11926/jtsb.4025.
[16] HU D Y, ZHANG Z X, LIU J, et al.Expression analysis of ethylene regulates related genes infruit based on transcri- ptome sequencing [J].J Sichuan Agric Univ, 2020, 38(5): 528-537.doi: 10.16036/j.issn.1000-2650.2020.05.004.
胡丹焱, 张正雪, 刘娟, 等.基于转录组测序的海巴戟果实中乙烯调控相关基因表达分析 [J].四川农业大学学报, 2020, 38(5): 528- 537.doi: 10.16036/j.issn.1000-2650.2020.05.004.
[17] WANG T L, YE H X, ZHENG J R, et al.Research progress of main flavor compounds in tomato fruits [J].Acta Agric Zhejiang, 2020, 32 (8): 1513-1522.doi: 10.3969/j.issn.1004-1524.2020.08.22.
王同林, 叶红霞, 郑积荣, 等.番茄果实中主要风味物质研究进展 [J].浙江农业学报, 2020, 32(8): 1513-1522.doi: 10.3969/j.issn.1004- 1524.2020.08.22.
[18] HUA W P, ZHANG Y, SONG J, et al.transcriptome sequencing into identify genes involved in the biosynthesis of active ingredients [J].Genomics, 2011, 98(4): 272-279.doi: 10.1016/j.ygeno.2011.03.012.
[19] QI H Y, LI T L, LIU H T, et al.Studies on carbohydrate content and sucrose-metabolizing enzymes activities in different parts of tomato [J].Acta Hort Sin, 2005, 32(2): 239-243.doi: 10.3321/j.issn:0513-353X.2005.02.010.
齐红岩, 李天来, 刘海涛, 等.番茄不同部位中糖含量和相关酶活性的研究 [J].园艺学报, 2005, 32(2): 239-243.doi: 10.3321/j.issn: 0513-353X.2005.02.010.
[20] QIN Q P, ZHANG S L, XIE M, et al.Progress on the research of the molecular regulation of sugar content and composition in fruit [J].J Fruit Sci, 2005, 22(5): 519-525.doi: 10.3969/j.issn.1009-9980.2005.05.019.
秦巧平, 张上隆, 谢鸣, 等.果实糖含量及成分调控的分子生物学研究进展 [J].果树学报, 2005, 22(5): 519-525.doi: 10.3969/j.issn.1009-9980.2005.05.019.
[21] LÜ W Y, ZHANG L Q, GAO Q H, et al.Cloning and expression analysis of fructokinase genefrom ‘Benihoppe’ strawberry [J].Acta Agric Shanghai, 2020, 36(6): 1-5.doi: 10.15955/j.issn1000-3924.2020.06.01.
吕文远, 张丽勍, 高清华, 等.‘红颜’草莓中果糖激酶基因的克隆与表达分析 [J].上海农业学报, 2020, 36(6): 1-5.doi: 10.15955/j.issn1000-3924.2020.06.01.
[22] ZHAO J H, YIN Y, LI H X, et al.Cloning and expression analysis of fructokinase gene () from wolfberry (Linn.) [J].Acta Bot Boreali-Occid Sin, 2018, 38(5): 816-822.doi: 10.7606/j.issn.1000-4025.2018.05.0816.
赵建华, 尹跃, 李浩霞, 等.枸杞果糖激酶基因的克隆及表达分析 [J].西北植物学报, 2018, 38(5): 816-822.doi: 10.7606/j.issn.1000-4025.2018.05.0816.
[23] CHEN X, SHI L Y, SHAO J R, et al.Molecular cloning and expression analysis ofin Chinese bayberry during fruit ripening [J].Acta Hort Sin, 2016, 43(8): 1585-1592.doi: 10.16420/j.issn.0513-353x.2016- 0219.
陈馨, 施丽愉, 邵佳蓉, 等.杨梅果糖激酶基因的克隆及在成熟期果实中的表达分析 [J].园艺学报, 2016, 43(8): 1585-1592.doi: 10.16420/j.issn.0513-353x.2016-0219.
[24] WANG W P, CUI N, YU Z H, et al.Cloning and expression analysis of fructokinase gene () from tomato fruit [J].Acta Agric Boreali-Sin, 2011, 26(3): 11-15.
王卫平, 崔娜, 于志海, 等.番茄果实果糖激酶基因的克隆及其表达分析 [J].华北农学报, 2011, 26(3): 11-15.
[25] LI M J, FENG F J, CHENG L L.Expression patterns of genes involved in sugar metabolism and accumulation during apple fruit development [J].PLoS One, 2012, 7(3): e33055.doi: 10.1371/journal.pone.003 3055.
[26] ZHAO Z Z, ZHANG S L, CHEN J W, et al.The physiological mecha- nism on the difference of sugar accumulation in citrus varieties [J].Sci Agric Sin, 2002, 35(5): 541-545.
赵智中, 张上隆, 陈俊伟, 等.柑橘品种间糖积累差异的生理基础 [J].中国农业科学, 2002, 35(5): 541-545.
[27] LIU J, LAN Z Q, WU T, et al.Transformation of non-seeded gene into noni root segment by[J].Biotechnology, 2018, 28(5): 473-477.doi: 10.16519/j.cnki.1004-311x.2018.05.0082.
刘娟, 蓝增全, 吴田, 等.农杆菌介导的无籽基因转化诺丽根段 [J].生物技术, 2018, 28(5): 473-477.doi: 10.16519/j.cnki.1004-311x.2018.05.0082.
[28] JIA D D, LAN Z Q, WU T.Studies on genetic transformation of seed- lessness gene to noni () with its stem segments as the explants [J].J SW Univ (Nat Sci), 2018, 40(9): 7-12.doi: 10.13718/j.cnki.xdzk.2018.09.002.
贾丹丹, 蓝增全, 吴田.以诺丽茎段为外植体的无籽基因转化研究 [J].西南大学学报(自然科学版), 2018, 40(9): 7-12.doi: 10.13718/j.cnki.xdzk.2018.09.002.
Changes in Fructose, Fructokinase and Its Gene induring Fruit Development
WANG Qingfen, GONG Shusen, BAI Yan, LIU Nian, WANG Peiyuan, WU Tian*
(Southwest Landscape Architecture Engineering Technology Research Center of National Forestryand Grassland Administration, Yunnan Functional Flower Resources and Industrialization Technology Engineering Research Center, College of Landscape Architecture and Horticulture Sciences, Southwest Forestry University,Kunming 650224, China)
Toreveal the formation mechanism of fruit flavor in, the activity and expression pattern of fructokinase (FRK) gene during fruit development were studied.The results showed that the contents of fructose, sucrose and glucose in fruit ofaccumulated with the development of fruit, and reached the highest when the fruit was fully mature, while the activity of fructokinase decreased with the development of the fruit.The fructokinase gene, named aswas cloned fromfruit, with 984 bp ORF, encoding 327 amino acids, and the GenBank accession number was MW380742.The amino acid sequence of McFRK2 was similar to that of FRK2 of coffee () at 98%.By using qRT-PCR, the expression ofdecreased gradually during fruit development.When the fruit was ripe, the expression oftended to be stable, which was consistent with the change trend of fructokinase activity.Therefore,might be involved in glucose metabolism by regulating fructokinase activity in fruits, which plays an important role in regulating fruit flavor formation.
; Fructokinase gene; Sugar; Expression
10.11926/jtsb.4405
2021-03-02
2021-05-18
国家林业和草原局项目([2019]27); 云南省科技厅重点研发计划项目(2019IB011)资助
This work was supported by the Projects of National Forestry and Grassland Administration (Grant No.[2019]27), and the Project for Key Research and Development in Yunnan (Grant No.2019IB011).
王青芬(1996~ ),女,硕士研究生,主要从事植物分子生物学研究。E-mail: wangqingfen@swfu.edu.cn
通信作者Corresponding author.E-mail:wutianpotato@swfu.edu.cn
