细胞学印片与冰冻切片联合应用在乳腺肿物术中诊断的价值
2022-02-25桑占发金笛喻鑫苏佳君高畅于适卜
桑占发 金笛 喻鑫 苏佳君 高畅 于适卜
摘要:目的:探讨印片细胞学与冰冻切片联合应用在乳腺肿物术中快速诊断的价值。方法:对221例乳腺活检组织术中印片与冰冻切片诊断进行检查、分析。结果:术中印片符合率95.93%,冰冻切片诊断符合率96.83%,二者联合确诊率为98.64%。结论:乳腺疾病术中印片诊断和冰冻切片诊断均有较高的准确率和可靠性,但术中印片和冰冻切片诊断均有一定局限性,若将印片与冰冻切片结合起来,即可以观察组织结构,又可以观察细胞形态学变化,二者综合考虑互相弥补不足,进一步提高术中病理诊断率。
关键词:乳腺肿块;细胞学印片;冰冻切片;石蜡切片。
【中图分类号】R4 【文献标识码】A 【文章编号】1673-9026(2022)02-01
乳腺活检组织术中印片与冰冻切片相比具有操作简单、节省时间、勿需冰冻切片机等特殊设备等特点,因此容易被广大病理工作者所接受。但是组织印片侧重观察细胞学形态,无法观察组织学形态的改变,因此诊断有一定局限性,组织印片不能完全替代冰冻切片。在术中若把两种方法结合起来,同时观察细胞学和组织学改变,可以起到互补作用,从而提高病理诊断的准确性和可信性。
1材料与方法
1.1 材料 221例标本均来自解放军第201医院2008年1月-2015年12月间手术切除的标本,术中送检标本均做细胞学印片和快速冰冻切片。患者年龄15~84岁,女性220例,男性1例。乳腺癌年龄最小28岁。
1.2 方法 将手术中送检未固定的新鲜标本做扇形剖开多个切面(忌水洗),用滤纸吸去血液或组织液,在不同切面用玻片垂直印片[1],用力均匀,不能拖拉,印片3-4张,吹干后立即置95%酒精中固定1-2分钟,水洗后,常规HE染色用于镜下观察,做出病理诊断。将组织标本同时进行冰冻切片制片,染色,进行冰冻切片诊断。细胞学诊断和冰冻切片诊断标准参考相关文献[2-4]余下标本及后送检的标本,用于常规石蜡病理检查。病理诊断医师阅片后进行综合分析,30分钟内发出病理诊断报告,最后结果以术后石蜡切片为金标准。
2 结果
2.1细胞学印片检查 组织印片镜下观察的重点是依据细胞的大小、形态特征等细胞分化特征区别良恶性病变。
2.1.1良性病变:在炎症性病变中,镜下可见淋巴细胞、浆细胞及少量中性白细胞,若为慢性化脓性炎症则可见大量中性白细胞,此外可见一定数量、体积较小的泡沫细胞及导管上皮细胞。在乳汁潴留囊肿时,可见大量的泡沫细胞,细胞体积一般较大。乳腺增生症时,除见少量导管上皮细胞,同时见数量不多的泡沫细胞。在纤维腺瘤中,可见数量不定的纤维母细胞,一般核大,核淡染,胞浆丰富,胞界不清,导管上皮细胞可有不同程度增生改变。在导管内乳头状瘤中,增生的上皮细胞常集合成团状、乳头状结构,有肌上皮混杂,细胞排列紧密,一般核稍增大。
2.1.2恶性肿瘤: 4例为肉瘤其余均为癌。瘤细胞可见成团或片状排列,细胞体积大小不等、偶见单核或多核巨细胞,有时见瘤细胞成腺样排列。细胞核大深染,核膜增厚,多数核仁清楚1-3个不等,核浆比例失调,可见数量不等的核分裂像。若为髓样癌,可见细胞呈片状分布,胞界不清,核大小不等,核膜清楚,可见空泡状核,胞浆丰富淡染,癌细胞团间可见有一定数量的淋巴細胞。在乳腺叶状囊肉瘤中,除了增生的导管上皮细胞外,还有增生的间质细胞,这些细胞多为梭形、卵圆形、或不整形,胞浆丰富、染色较淡,可见单核或多核瘤巨细胞,及数量不等的核分裂。
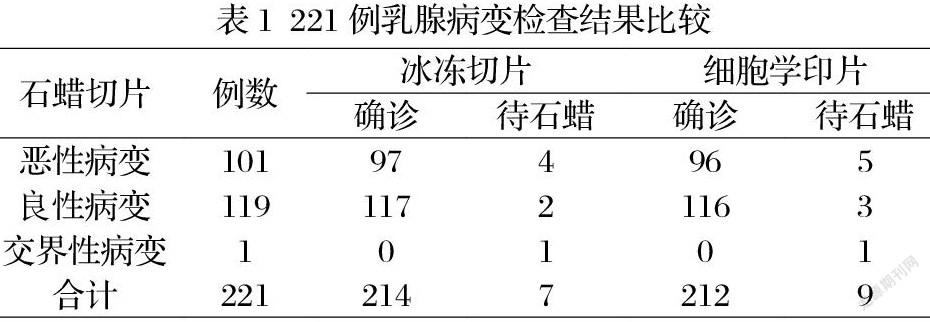
2.2细胞学印片和冰冻切片与石蜡切片诊断结果比较 本组221例乳腺病变,经石蜡切片病理诊断证实为恶性病变101例,其中乳腺癌100例,肉瘤1例。良性病变119例,交界性病变1例。术中细胞学印片、冰冻切片与石蜡切片病理诊断结果见表1
从表中可以看出,细胞学印片确诊212例,确诊率为95.93%,有9例待石蜡;冰冻切片确诊214例,确诊率为96.83%,有7例待石蜡。术中细胞学印片和冰冻切片结合分析确诊218例,确诊率为98.64%,仅3例待石蜡。
3 讨论
乳腺肿瘤发病机制未明,可能与遗传、病毒、饮食、乳腺发育、内分泌失调等因素有关。乳腺癌是女性发病率及癌症相关死亡率最高的恶性肿瘤[5],严重威胁女性健康。病理诊断包括石蜡切片诊断、术中病理诊断。术中诊断有三种,即快速石蜡切片、冰冻切片和印片细胞学。目前在国内外术中病理诊断中以冰冻切片应用最为广泛,有些医院同时开展了细胞学印片。笔者认为无论是冰冻切片还是细胞学印片都有其优势和作用,很多文献也证明了这点[6,7]。
术中快速病理诊断是指手术时迅速准确评估病变的良恶性,为临床医生的手术范围提供参考[8],常用措施包括快速石蜡、冰冻切片和术中细胞学印片诊断等[9]。术中冰冻是术中病理诊断的主要方法,通过快速冰冻病理样本,达到一定硬度时,进行切片、染色,给出病理诊断结果,能够为患者选择手术方式提供参考。术中冰冻具有突出的优势,能够完整观察病变组织结构进行快速诊断,同时也可以进行组织学分型,具有较高的可靠性,并能提供手术切缘情况,得到了临床的认可。然而术中冰冻也受多种因素的影响,如组织过小、肿瘤组织中脂肪太多、容易形成冰晶、有些细胞不能辨认、病理医生取材不到位等,造成无法明确诊断。术中细胞学印片能够最大程度保护细胞的形态特征,减少了人为影响,有时可以看到一定的组织结构,而且印片中细胞来源为多个切面,能够观察到病变中更大范围的细胞形态学特点,可在一定程度上弥补冰冻取材的局限性,当冰冻制片不佳或遇到一些少见肿瘤,良恶性难以确认时,细胞学可以协助诊断[10],提供冰冻切片技术不可代替的参考依据[11,12]。手术术中细胞学印片自1927年首次应用后,技术不断改进,积累了丰富经验,诊断准确率不断提高,有文献报告为95%[13],本文为95.93%,与文献报道结果相符。术中印片具有组织受检面广、操作简单、诊断快速、准确率高等优点[14],对大部分乳腺病变能够做出准确诊断。术中印片与冰冻切片同时进行,在技术员制作冰冻切片过程中病理医生先进行细胞学阅片,不影响冰冻报告时限。一些研究报道了细胞学印片在诊断病变中具有较高的诊断率,并且准确率与外科手术冰冻病理无明显差异[15,16],本文细胞学印片诊断确诊率为95.93%,与冰冻切片诊断确诊率96.83%亦明显差异,这说明细胞学印片在确定乳腺良恶性病变性质上同样有较大应用价值。但是我们应当看到组织细胞学印片和冰冻切片一样有一定局限性,印片仅依据细胞形态学特征,而不能观察组织结构,加之影响细胞形态改变的因素比较多,如组织变性、取材不当、染色效果不理想等,有时诊断医生经验不足等主观因素,都有可能造成误诊漏诊,同时对肿瘤的分型、来源和浸润情况的判断受到限制。若将印片与冰冻切片结合起来,综合考虑,则两者可以互补,对做出正确诊断帮助很大,从而提高诊断确诊率。本组印片细胞学确诊率为95.93%,冰冻切片确诊率为96.83%,二者联合确诊率为98.64%,后者高于前两者。
综上所述,对于术中乳腺肿块病理诊断同时开展细胞学印片和冰冻切片,前者看细胞,后者看组织结构,优势互补,相互保驾护航,有助于提高术中病理诊断的准确性。
参考文献:
[1]王旭波.印片细胞学在术中乳腺快速肿瘤病理诊断中的应用[C].中华医学会第九届全国细胞学学术会议论文集2011:371-374。
[2]马正中,阚秀,刘树范.诊断细胞病理学[M].郑州:河南科学技术出版社,2000:481.
[3]陈乐真.手术中病理诊断[M].北京:人民军医出版社,1993:20-34.
[4]曹跃华,杨敏,陈隆文,杨斌.细胞病理学诊断图谱及实验技术[M].北京:北京科学技术出版社,2012:246-266.
[5]郑荣寿,孙可欣,张思维,等.2015年中国恶性肿瘤流行情况分析[J].中华肿瘤杂志,2019,41(1):19-28.
[6]王延红,伊凯,李克剑.乳腺前哨淋巴结术中分子诊断的临床应用价值[J].蚌埠医学院学报,2017,42(8):1051.
[7]陈友权.印片细胞学和冰冻切片检查在甲状腺乳头状癌诊断中的应用分析[J].病理与临床,2012,50(16):111.
[8]郑吉春,任力,李德昌,等.印片细胞学与DNA倍体分析在诊断肺部肿块术中冷冻样本中的应用[J].诊断病理学杂志.2014,21(10):630-632.
[9]赵久飞,任力,李炜,等.术中组织印片细胞DNA倍体分析在乳腺疾病诊断中的意义[J]. 診断病理学杂志.2013,20(12):744-746.
[10]王玉兰,熊红梅,郑雪梅,等.印片与冰冻切片结合诊断乳腺肿块131例分析[J].诊断细胞学杂志,2004,16(2):172.
[11]胡良建.印片细胞学用于术中乳腺快速肿瘤病理诊断中的研究价值[J].现代诊断与治疗,2017,28(5):822.
[12]蓝松,彭娟,尤芳.142例甲状腺肿块术中印片细胞学与冷冻切片诊断分析[J].哈尔滨医药,2012,32(1):4.
[13]张丽莉,都吉雅.印片细胞学在术中病理诊断中的应用[J].内蒙古医学杂志,2013,45(10):240-241.
[14]朱淑玲,武彤彤,方勤,等.印片细胞学联合快速免疫组化检测在乳腺癌前哨淋巴结活检术中诊断的应用[J].中国临床医学,2016,23)(5):633-635.
[15]zony M, Klatte T, Wiener H, et al.Intraoperative imprint cytology for real-time assessment of surgical margins during partial nephrectomy:a comparison with frozen section[J]Urol Oncol, 2015;33(2):67.e25-9.
[16]Abe A, Sugiyama Y, Furuta R, et al.Usefulness of intraoperative imprint cytology in ovarian germ cell tumors[J].Acta Cytologica,2013;57(2):171-6
