马钱苷与黄连素联合用药对糖尿病小鼠骨代谢的影响
2022-02-24叶紫梦玮刘亚鸽陈贝贝朱如愿夏兵可王新祥王丽丽张东伟
戴 璇,叶紫梦玮,刘亚鸽 ,陈贝贝,朱如愿,夏兵可,张 浩,王新祥,王丽丽,张东伟
(北京中医药大学1.中医学院糖尿病研究中心,北京 100029,2.东方医院医学实验中心,北京 100078,3.中药学院中药药理系,北京 100029)
随着经济的发展和人类生活方式的转变,肥胖和超重人群逐渐增加,肥胖相关疾病已成为世界性的公共卫生问题。研究显示,肥胖会影响胰岛素敏感性,从而导致2型糖尿病等疾病,是全球慢性疾病的主要危险因素之一[1]。肥胖可能会诱发糖尿病,而严重的糖尿病会增加骨质疏松和脆性骨折的风险,其原因可能是机体血糖升高,引起抗氧化酶的糖基化,使机体抗氧化能力下降,活性氧(reactive oxygen species,ROS)生成增多,引起氧化应激水平的增加[2],进而导致骨质流失。
晚期糖基化终产物(advanced glycation end products,AGEs)及其受体(RAGE)/核转录因子-κB(nuclear factor-κB,NF-κB)信号通路是与氧化应激密切相关的经典通路之一。AGEs是葡萄糖对蛋白质的自发性非酶糖化和糖代谢的产物,过度积累会引起许多病理变化[3]。骨组织中,AGEs一方面可以通过与其受体RAGE结合,促进组织细胞生成ROS,激活NF-κB参与的炎症等反应,从而刺激骨吸收并抑制骨形成;另一方面,AGEs可影响骨材料构成诱发骨质量下降[4]。
研究发现,马钱苷主要来源于药材山茱萸,具有降血糖和调节骨代谢等多种药理作用[5-6],马钱苷通过抑制AGEs通路,可减轻氧化应激、炎症和凋亡引起的代谢异常[7]。含黄连素的主要药材黄连具有抗糖尿病和抗骨质疏松等作用。Xie等[8]提出黄连素可以促进骨形成,抑制骨吸收,恢复糖尿病大鼠的骨代谢稳态。本课题组前期研究表明,含有马钱苷和黄连素的降糖消渴颗粒能抑制KKAy小鼠的骨丢失[9]。但马钱苷和黄连素联合用药能否通过调控AGEs/RAGE/NF-κB信号通路抑制糖尿病诱发的骨丢失作用,目前还未知。因此,本研究以高脂饮食诱发的糖尿病小鼠模型为研究对象,探讨骨组织中AGEs/RAGE/NF-κB通路的变化及降糖消渴颗粒的主要成分马钱苷与黄连素对其的影响,以阐释其治疗糖尿病并发的骨质疏松的作用机制,为中药防治糖尿病性骨质疏松提供新的思路。
1 材料与方法
1.1 实验动物SPF级雄性ICR小鼠,(20±2)g,购自北京斯贝福动物科技有限公司,饲养于北京中医药大学科研实验中心清洁级动物实验室,合格证号SYXK(京)2016-0038,恒定室温(22±2)℃,相对湿度(50±5)%,12 h/12 h光暗周期。实验过程中所有小鼠可自由饮用水及食物,笼具、垫料、饮用水等定期更换、清洁。实验方案经北京中医药大学动物实验伦理委员会批准。
1.2 主要仪器拜安康血糖仪及配套血糖检测试纸(德国拜耳医药保健有限公司);EchoMRI-100H身体成分分析仪(美国EchoMRI国际医疗设备公司);RM 2255轮转式切片机(德国Leica Biosystems有限公司);Olympus BX53倒置荧光显微镜(日本Olympus有限公司);FLUO star Omega多功能酶标仪(德国BMG Labtech公司);Azure c500凝胶成像仪(美国Azure Biosystems股份有限公司);小动物活体micro-CT影像系统(美国PerkinElmer公司);CT3质构仪(美国brookfield公司);傅里叶变换红外光谱仪(德国Bruker公司)。
1.3 药物与试剂马钱苷(马钱素)、黄连素(盐酸小檗碱)(成都瑞芬思生物科技有限公司,MD10B、Y035);盐酸二甲双胍片(中美上海施贵宝制药有限公司,H20023370);总胆固醇(total cholesterol,TC,A111-1-1)、三酰甘油(triacylglycerol,TG,A110-1-1)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C,A112-1-1)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C,A113-1-1)、超氧化物歧化酶(superoxide dismutase,SOD,A001-3-2)、丙二醛(malondialdehyde,MDA,A003-1-2)、总抗氧化能力(total antioxidant capacity,T-AOC,A015-3-1)测定试剂盒(南京建成生物工程研究所);NF-κB-p65、p-NF-κB-p65(ser536)抗体(沈阳万类生物科技有限公司,WL01980、WL02169);AGEs、RAGE、Cathepsin K抗体(上海艾博抗贸易有限公司,ab23722、ab37647、ab19027);ECL超敏发光液(北京索莱宝生物科技有限公司,P0018FS);骨组织抗原修复液(上海舜百生物科技有限公司,SBT10013);高脂饲料,包括45%脂肪、20%蛋白质和35%碳水化合物(江苏美迪森生物医药有限公司,MD12032);普通饲料采用AIN-96G全价营养饲料(北京斯贝福生物技术有限公司)。
1.4 动物模型构建用高脂饲料连续喂养ICR小鼠12周[10],选取体质量增加≥20%、空腹血糖>7.8 mmol·L-1的小鼠用于后续实验。将符合条件的小鼠随机分为高脂饮食诱导糖尿病模型组(HFD,n=10)、二甲双胍阳药组(Met,n=10)和马钱苷与黄连素联合治疗组(L+B,n=10),3组小鼠均用高脂饲料继续喂养至实验结束。阳药组小鼠灌服二甲双胍(100 mg·kg-1),治疗组小鼠灌服马钱苷与黄连素(马钱苷20 mg·kg-1,黄连素50 mg·kg-1),模型组小鼠灌服等量的水,另外再取10只正常小鼠灌服等量水作为对照(正常饲料饲养),连续给药10周。
1.5 取材及样品制备摘眼球取血,收集血液样本用于血清学检测。同时,迅速剥离小鼠股骨和胫骨,部分骨组织用4%多聚甲醛固定做组织学分析,剩余在液氮中冷冻后置-80 ℃保存备用。
1.6 指标测定
1.6.1体质量及空腹血糖 实验期间每周记录一次小鼠体质量及空腹血糖,取材前用身体成分分析仪检测小鼠体脂并记录。
1.6.2口服葡萄糖耐量实验(oral glucose tolerance test,OGTT) 小鼠空腹12 h后进行糖耐量实验。每只小鼠灌胃给予葡萄糖溶液(2 g·kg-1),分别检测灌胃后0、30、60、90、120 min的血糖,绘制血糖变化折线图,并计算曲线下面积(area under the curve,AUC)。
1.6.3Micro-CT 将胫骨固定于micro-CT影像系统成像床上,设置电压为70 kV,电流为60 μA,成像视野36 mm × 36 mm,扫描模式为14 min高分辨率,使用相应X射线剂量进行扫描。成像结果使用Analyze 2.0软件进行分析。分别选取骨骺端生长板以下75层[11]以及骨干中段[12]作为特定兴趣区域,分析以下参数:(1)骨小梁:节段骨表面与节段骨体积之比(bone surface/bone volume,BS/BV)、骨小梁数目(trabecular number,Tb.N)、骨小梁分离度(trabecular separation,Tb.Sp);(2)皮质骨:皮质骨骨密度(bone mineral density,BMD)、骨膜包膜内的总横截面积(total cross-sectional area,Tt.Ar)和骨膜周长(periosteal perimeter,Ps.Pm)。
1.6.4三点弯曲实验 利用CT3质构仪测定胫骨的生物力学性能,将模具的间距设置为12 mm,固定好胫骨,保持胫骨中心、两支点中心和加载点在同一位置,然后以0.5 mm·s-1的下降速度设置加载负荷,得到最大载荷参数值。
1.6.5ATR傅里叶变换红外光谱检测 胫骨去骨髓后研磨成细粉并干燥。取微量细粉置于晶体表面,开始检测。对每个样品采集红外光谱,利用origin软件处理光谱,对以下参数进行分析:(1)胶原成熟度(collagen maturity/collagen cross-link ratio,XLR)反映成熟和不成熟类型交联的相对数量,即氨基化合物 Ⅰ 在1 660 cm-1和1 690 cm-1的峰高比值;(2)矿物 ∶基质(mineral ∶matrix ratio)表示胶原基质的矿化程度,即ν1-ν3PO4和酰胺Ⅰ的峰面积比;(3)碳酸盐 ∶磷酸盐(carbonate ∶phosphate ratio)表示碳酸盐取代矿物晶格的程度,即ν1-ν3PO4与ν2CO3的峰面积比;(4)矿物结晶度(mineral maturity/crystallinity,MMC)反映晶体大小和化学组成,即化合物在1 030 cm-1和1 020 cm-1的峰高比值[13]。
1.6.6血清学指标检测 TG、TC、HDL、LDL以及MDA、SOD、T-AOC的测定采用商品化试剂盒,并按照生产说明书操作。
1.6.7HE染色 取小鼠股骨制作石蜡切片,按照陈贝贝等[14]提供的方法进行HE染色,骨组织切片于60 ℃烘箱中烤3 h,然后按常规程序进行HE染色,封片后显微镜下观察骨小梁的病理特征并拍照记录。
1.6.8TRAP染色 取无水乙酸钠、酒石酸、冰醋酸配置成基础溶液,预热至37 ℃。骨组织石蜡切片,在含萘酚AS-BI磷酸盐溶液和基础溶液的染色缸中37 ℃孵育45 min。然后将亚硝酸钠与副品红配成的棕色染料倒入另一个含基础溶液的染色缸中并放入未清洗的切片,室温孵育6 min,苏木精复染,再用氨水返蓝,清洗后封片。
1.6.9免疫组化测定(IHC) 取股骨石蜡切片,按照王丽丽等[15]提供方法进行实验,简述如下:10%山羊血清封闭,分别孵育AGEs(1 ∶200)、RAGE(1 ∶100)、p-NF-κB-p65(1 ∶100)、NF-κB-p65(1 ∶100)、Cathepsin K(1 ∶50)抗体,4 ℃过夜。次日滴加辣根过氧化物酶标记的二抗,DAB溶液避光显色,苏木精复染,封片后置于显微镜下观察、拍照,利用Image-Pro Plus软件分析。

2 结果
2.1 马钱苷与黄连素联合用药能抑制糖尿病小鼠体质量、体脂率和空腹血糖的增加如Fig 1A-C所示,与正常组小鼠相比,模型组小鼠的体质量、体脂率和空腹血糖均增加明显(P<0.05)。与模型组相比,马钱苷与黄连素联合给药2周后体质量开始明显降低(P<0.05),给药10周后小鼠体脂率及空腹血糖明显下降(P<0.05)。这说明,马钱苷与黄连素联合用药可有效降低糖尿病小鼠的血糖和体脂率,抑制体质量增加。
2.2 马钱苷与黄连素联合用药能改善糖尿病小鼠的血脂水平及糖耐量如Fig 2A-D,与正常组相比,模型组小鼠血清TG、TC、LDL水平明显增加,HDL水平明显降低(P<0.05)。联合给药干预10周后明显逆转了糖尿病小鼠血清中TG、TC、LDL和HDL水平(P<0.05)。如Fig 2E所示,第10周各组小鼠的糖耐量测试结果显示,与正常组相比,模型组小鼠的血糖值在0、30、60、90、120 min均处于较高水平,而联合治疗组小鼠各时间点的血糖水平较模型组明显降低(P<0.05)。Fig 2F所示,计算第10周OGTT实验结果的AUC,模型组小鼠AUC相较正常组升高了60.9%(P<0.05),而阳药组和马钱苷与黄连素联合治疗组小鼠相较模型组AUC分别降低了26.5%和32.6%(P<0.05)。以上结果表明,高脂饮食喂养的小鼠血脂水平紊乱,葡萄糖耐量受损,而马钱苷与黄连素联合用药可以改善糖尿病小鼠的血脂水平和修复受损的糖耐量。
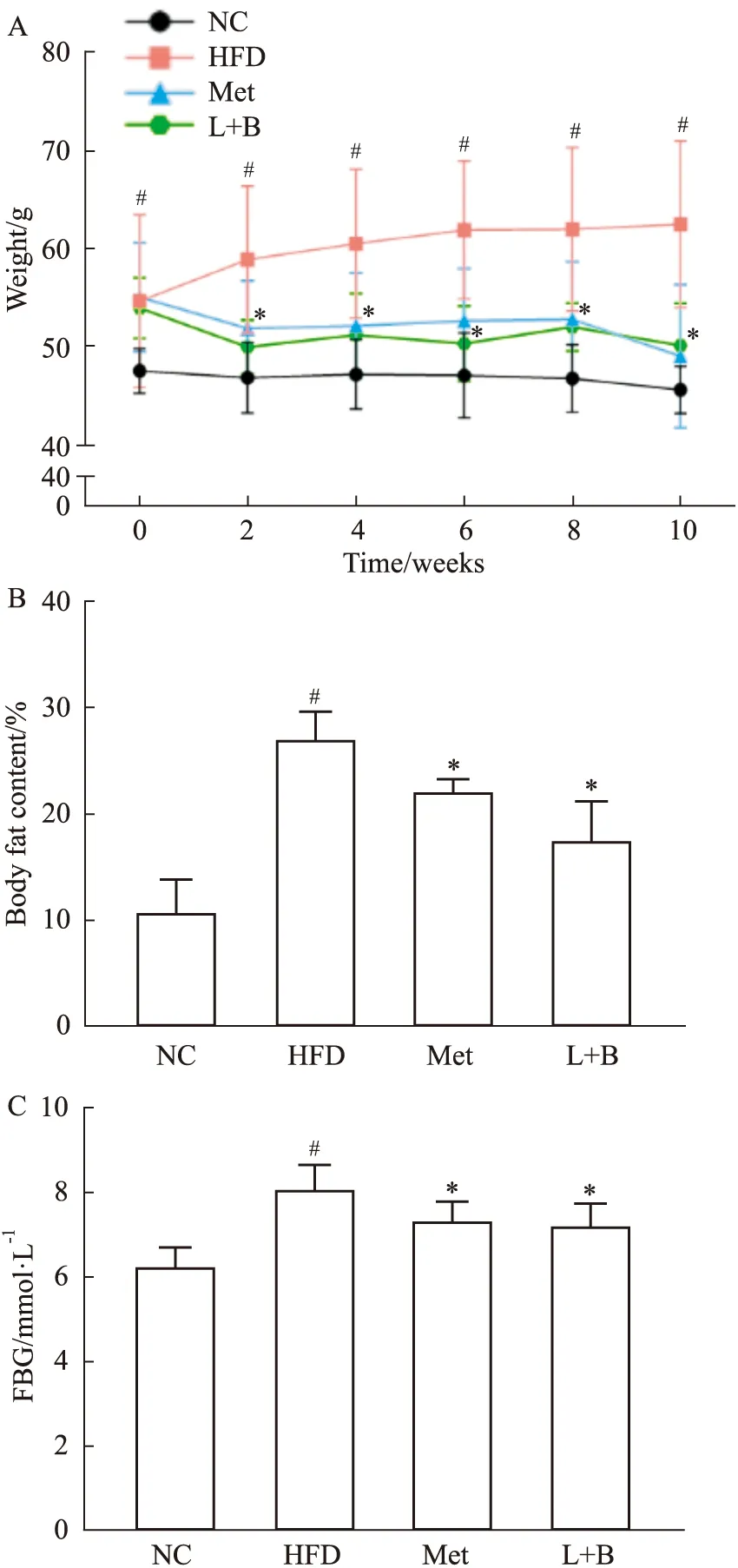
Fig 1 Effects of combined administration of loganin and berberine on body weight (A),body fat content (B)and fasting blood-glucose,FBG (C)in diabetic mice *P<0.05 vs model group;#P<0.05 vs control group.
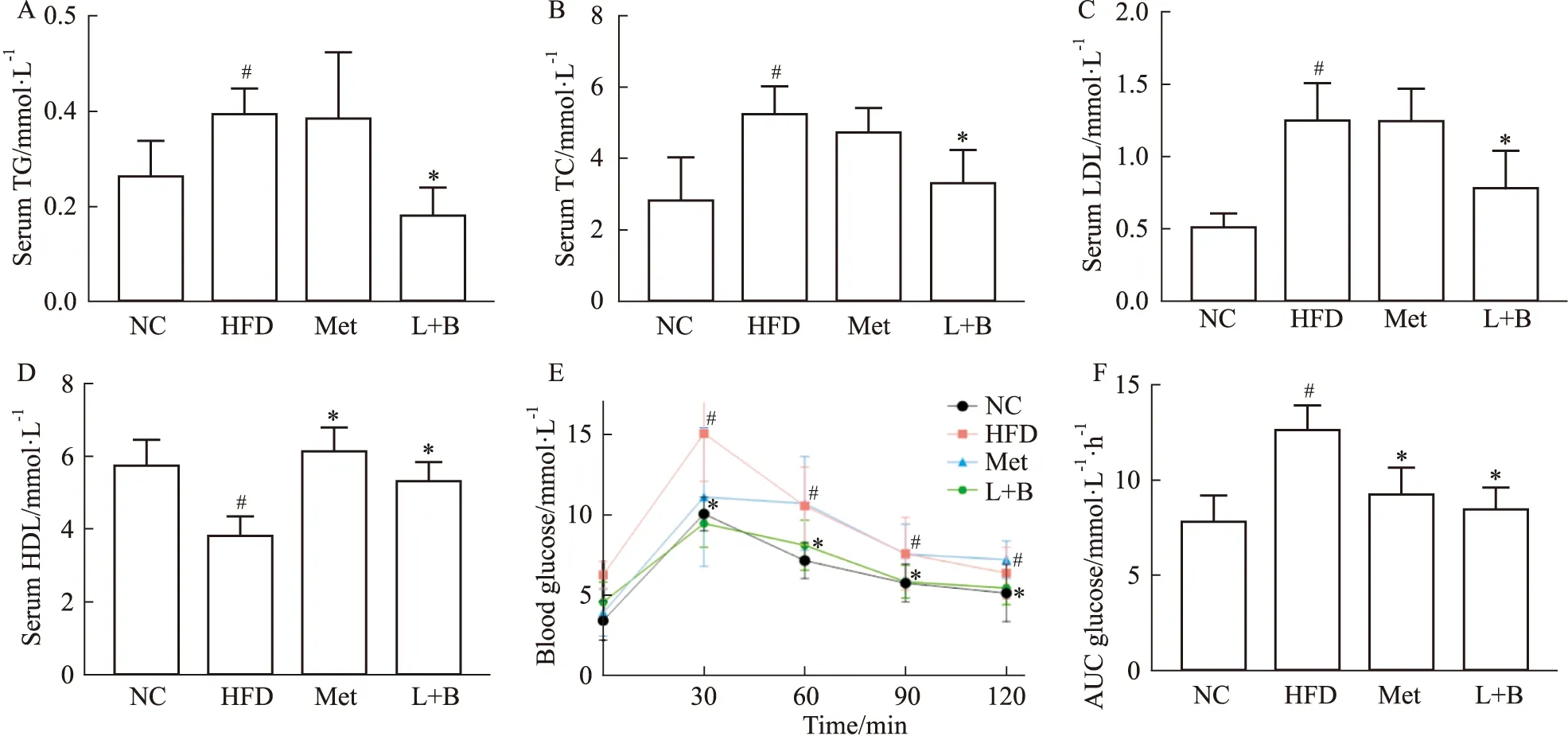
Fig 2 Effects of combined administration of loganin and berberine on glucose and serum lipid parameters in diabetic n=10)A:Serum TG;B:serum TC;C:Serum LDL;D:Serum HDL;E:OGTT at 10th week;F:AUC of OGTT at 10th week.*P<0.05 vs model group;#P<0.05 vs control group.
2.3 马钱苷与黄连素联合用药能改善糖尿病小鼠的骨微结构和骨生物力学性能如Fig 3A所示,正常组小鼠骨小梁结构完整,模型组结构稀疏,阳药组和马钱苷与黄连素联合治疗组小鼠的骨小梁结构得到改善。CT分析结果(Fig 3B-G)也与此一致:与正常组比较,模型组小鼠胫骨的Tb.Sp明显升高(P<0.05),BS/BV、Ps.Pm、BMD降低(P<0.05),Tt.Ar、Tb.N亦有降低趋势;与模型组比较,联合治疗10周后小鼠的Tb.Sp明显下降(P<0.05),BS/BV、Ps.Pm、BMD、Tt.Ar、Tb.N明显升高(P<0.05)。小鼠胫骨生物力学的测定结果如Fig 3H所示,相较于正常组,模型组小鼠最大载荷明显降低(P<0.05);给药干预10周后,与模型组小鼠比较,联合治疗组小鼠的最大载荷明显升高(P<0.05)。以上结果提示,糖尿病小鼠骨微结构受损,骨生物力学下降;马钱苷与黄连素联合给药后,其骨微结构和骨强度得到明显改善。
2.4 马钱苷与黄连素联合用药能改善糖尿病小鼠的骨材料构成骨材料构成也是评价骨质量的重要因素,Fig 4A是各组小鼠骨质的红外光谱图,其分析结果如Fig 4B-E。与正常组比较,模型组小鼠的胶原矿化程度、碳酸盐替代程度、矿物成熟度以及胶原蛋白成熟度都明显升高(P<0.05),给药干预10周后各项指标均下降(P<0.05)。这些结果表明,马钱苷与黄连素联合治疗能改善糖尿病小鼠的骨材料构成。
2.5 马钱苷与黄连素联合用药能改善糖尿病小鼠骨组织病理改变HE染色显示(Fig 5A),正常组小鼠股骨中骨小梁致密,厚度较大,未出现脂滴样空泡,而模型组小鼠骨小梁稀疏,厚度降低,存在大量脂滴样空泡。阳药组及联合治疗组小鼠股骨的整体病变程度低于模型组,提示马钱苷与黄连素能够改善糖尿病小鼠骨微结构。TRAP染色结果表明(Fig 5B),与正常组小鼠比较,模型组小鼠股骨中破骨细胞数目明显增加,药物联合干预后数目降低(P<0.05)。这说明,糖尿病小鼠破骨细胞的骨吸收活性增加,骨微结构被破坏,而马钱苷与黄连素联合用药可以改善糖尿病小鼠骨组织病理变化,可能与其抑制破骨细胞的骨吸收有关。
2.6 马钱苷与黄连素联合用药能降低糖尿病小鼠血清氧化应激水平MDA、SOD、T-AOC用于评估机体氧化损伤的程度。如Fig 6A-C所示,与正常组相比,模型组小鼠血清MDA水平明显升高(P<0.05),血清SOD和T-AOC水平明显降低(P<0.05);而与模型组相比,联合治疗组小鼠血清MDA和SOD水平明显改善(P<0.05),T-AOC水平亦有升高趋势。以上结果说明,糖尿病小鼠血清氧化应激水平升高,马钱苷与黄连素联合用药能减轻机体氧化应激反应。

Fig 3 Effects of combined administration of loganin and berberine on bone microstructure and biomechanics in diabetic n=10)A:Micro-CT scanning stereogram of tibial metaphysis in mice;B:Trabecular bone separation,Tb.Sp;C:Ratio of segmental bone surface to segmental bone volume,BS/BV;D:Periosteal perimeter,Ps.Pm;E:Bone mineral density,BMD;F:Number of bone trabeculae,Tb.N;G:Total cross-sectional area in the periosteum,Tt.Ar;H:Maximum load/bone volume.*P<0.05 vs model group;#P<0.05 vs control group.
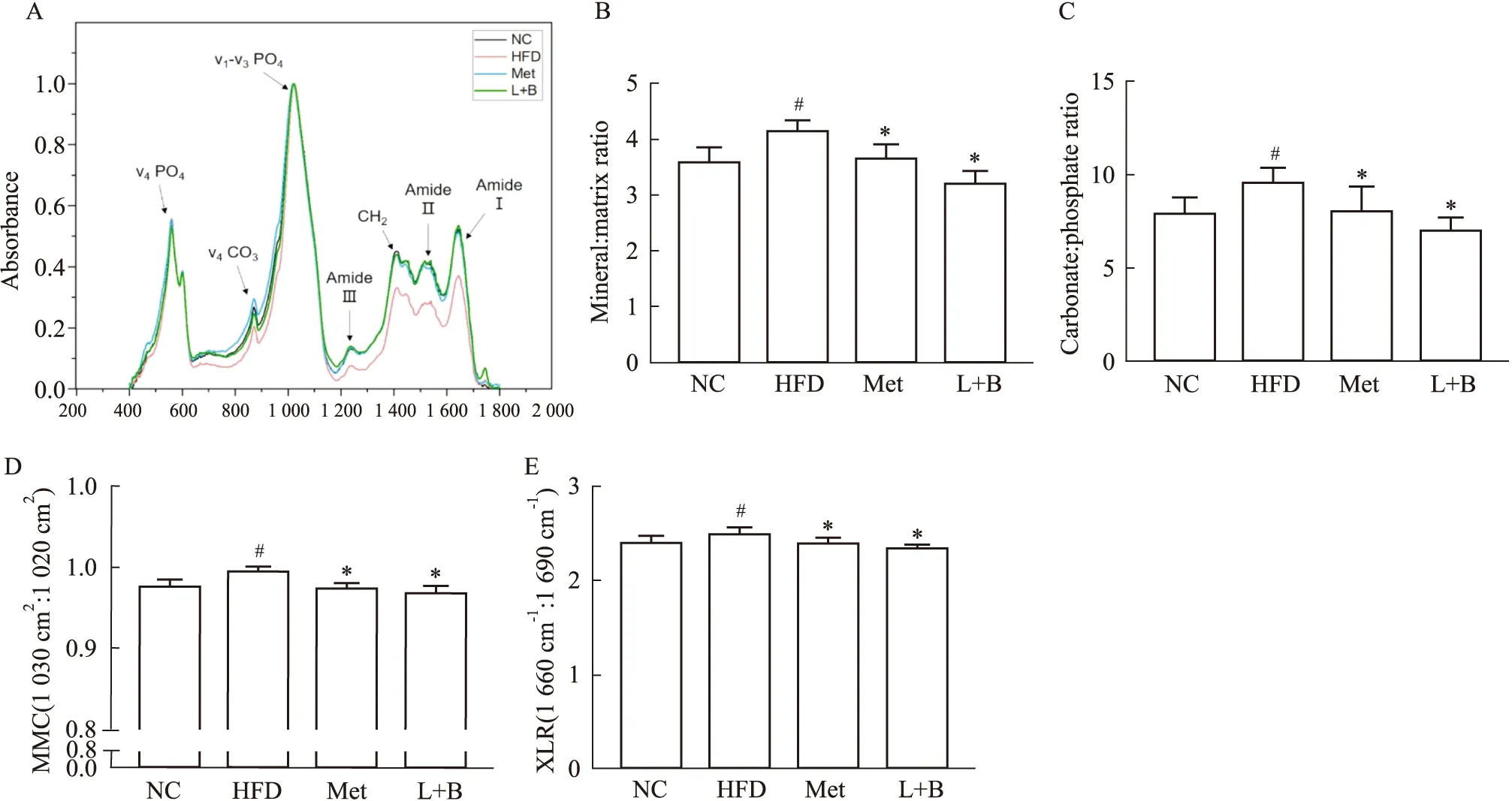
Fig 4 Effects of combined administration of loganin and berberine on bone material properties in diabetic n=10)A:The infrared spectra;B:Mineral:matrix ratio;C:Carbonate:phosphate ratio;D:Mineral maturity (1 030 cm-1:1 020 cm-1);E:Collagen maturity/Collagen cross-link ratio (1 660 cm-1:1 690 cm-1).*P<0.05 vs model group;#P<0.05 vs control group.
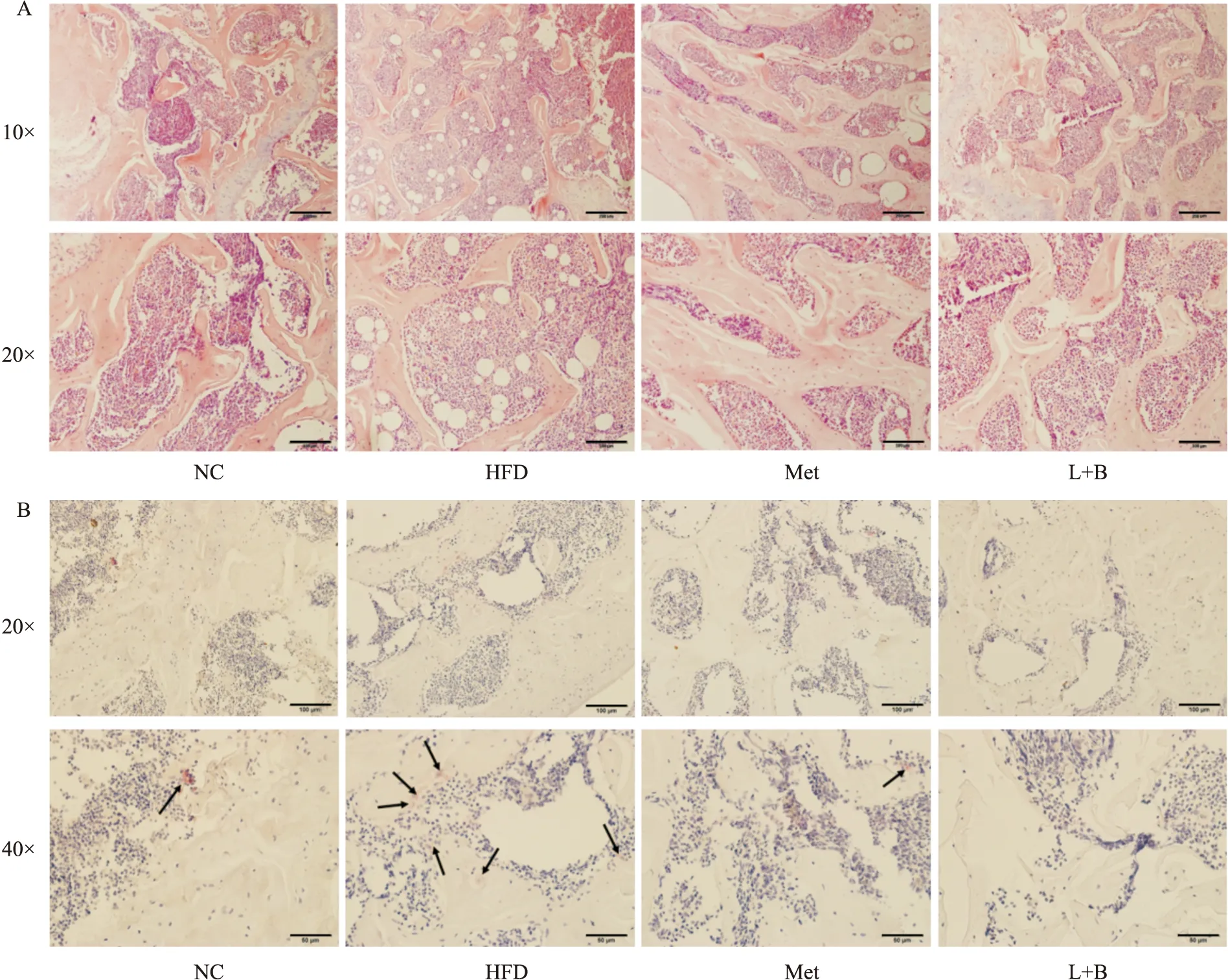
Fig 5 Effects of combined administration of loganin and berberine on bone histopathological changes in diabetic miceA:HE staining,pink -bone trabeculae,purple -bone marrow;B:TRAP staining,red -osteoclasts (arrow),dark blue -bone marrow,light blue -bone.
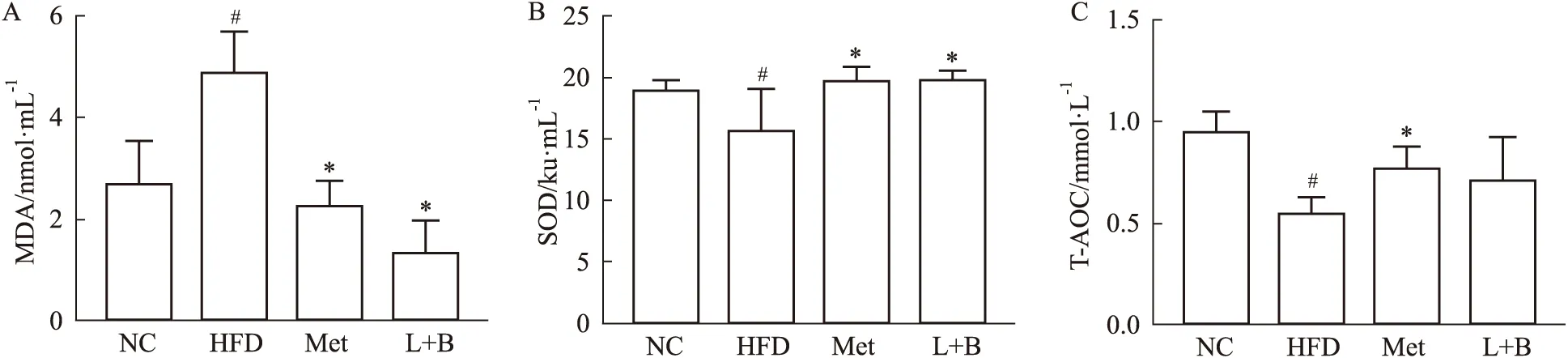
Fig 6 Effects of combined administration of loganin and berberine on serum oxidative stress markers in diabetic n=10)A:MDA;B:SOD;C:T-AOC.*P<0.05 vs model group;#P<0.05 vs control group.
2.7 马钱苷与黄连素可能通过调节AGEs/RAGE/NF-κB信号通路调节骨代谢如Fig 7A、B所示,与正常组小鼠相比,模型组小鼠股骨中AGEs和RAGE表达明显增加(P<0.05),而与模型组小鼠相比,药物干预10周后其水平明显降低(P<0.05)。NF-κB的活化是指p65亚基被磷酸化激活后向核内转移发挥生理作用。如Fig 7C和7D所示,模型组小鼠股骨中NF-κB-p65与p-NF-κB-p65较正常组小鼠明显升高(P<0.05),马钱苷与黄连素联合治疗的小鼠其水平明显降低(P<0.05)。这些结果提示,马钱苷与黄连素联合用药能明显抑制糖尿病小鼠体内AGEs的积累,从而抑制ROS诱发的NF-κB活化。
免疫组化染色测定各组小鼠组织蛋白酶K(Cathepsin K)的表达量如Fig 7E所示,与正常组相比,模型组小鼠股骨中Cathepsin K表达明显增多(P<0.05),联合治疗组小鼠Cathepsin K的表达较模型组小鼠明显降低(P<0.05)。这说明,马钱苷与黄连素联合能降低Cathepsin K的表达。以上免疫组化染色结果表明,马钱苷与黄连素联合可以调节Cathepsin K的表达,抑制破骨细胞的骨吸收活性,从而改善糖尿病小鼠的骨质量。
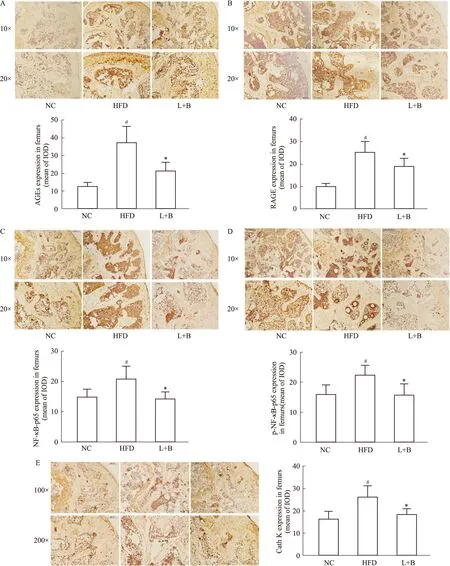
Fig 7 Expressions of AGEs,RAGE,NF-κB-p65,p-NF-κB-p65 and Cathepsin K in femurs of diabetic mice determined by n=10)A:Immunohistochemical staining and analysis of AGEs;B:Immunohistochemical staining and analysis of RAGE;C:Immunohistochemical staining and analysis of NF-κB-p65;D:Immunohistochemical staining and analysis of p-NF-κB-p65;E:Immunohistochemical staining and analysis of Cathepsin K.*P<0.05 vs model group;#P<0.05 vs control group.
3 讨论
本研究利用经典的高脂饮食诱导法复制糖尿病小鼠模型,发现小鼠成模后体质量增加,体脂率升高,小鼠血糖水平升高,糖耐量降低,血脂紊乱,血清氧化应激水平升高;同时,其骨微结构被破坏,骨强度降低,骨材料构成改变;破骨细胞数目明显增加;AGEs/RAGE/NF-κB信号通路相关蛋白及Cathepsin K表达增加,马钱苷与黄连素联合治疗小鼠10周后,可明显逆转上述改变,从而调节小鼠的骨代谢。
本研究通过分析小鼠骨微结构、骨强度等一般情况,发现糖尿病骨质疏松小鼠骨小梁结构稀疏,硬度下降,呈现骨质疏松症状,该结果与文献报道一致[16]。马钱苷与黄连素干预后能明显升高BS/BV、Ps.Pm、BMD、Tt.Ar、Tb.N,降低Tb.Sp,提示马钱苷与黄连素联合干预具有调节骨代谢紊乱,改善骨结构的作用。Doucette等[17]提出高脂喂养C57BL/6J小鼠12周后皮质骨无明显变化。而本实验中,模型组小鼠22周后皮质骨BMD及Ps.Pm有明显改变,可能是因为前期高脂饮食对骨小梁的影响更明显,而本实验中小鼠高血糖症状进一步加重骨代谢紊乱。有研究报道,随着骨组织年龄增加,矿物基质比、碳酸盐取代矿物晶格的程度、MMC以及XLR都会升高[13]。本实验显示高脂饮食喂养的小鼠胫骨骨质在22周后也得出一致的结果,联合给药后矿物基质比、碳酸盐取代矿物晶格的程度、MMC以及XLR都明显下降,治疗作用明显,提示马钱苷与黄连素具有调控骨材料构成的作用。
AGEs/RAGE/NF-κB信号通路在氧化应激和骨代谢过程中发挥着重要作用,可以调控ROS的产生及骨吸收活性。研究发现,马钱苷可抑制AGEs通路,减少ROS的产生[7]。此外,马钱苷具有较强的抑制NF-κB信号通路的作用[18]。体外研究也证实黄连素具有抗氧化作用,在一定程度上可抑制骨质疏松症的发展[8]。在本研究中,通过检测血清MDA、SOD和T-OAC,发现糖尿病小鼠氧化应激水平较高,骨组织也发生明显病变。而马钱苷与黄连素联合干预糖尿病小鼠10周后,血清MDA降低,SOD、T-AOC升高;HE染色、TRAP染色、IHC结果均表明马钱苷与黄连素能够改善骨质量,减轻骨组织空泡化等病变,明显降低AGEs、RAGE、NF-κB-p65、p-NF-κB-p65和破骨细胞特异性标志物TRAP及Cathepsin K的表达水平,具有减轻机体氧化应激、恢复骨代谢平衡的作用。以上研究结果表明,马钱苷与黄连素联用可通过调节AGEs/RAGE/NF-κB信号通路,降低糖尿病小鼠机体氧化应激水平,进而改善骨结构与骨强度,发挥骨保护作用。
综上所述,马钱苷与黄连素联用可以抑制骨吸收活性,进而改善骨质量,其作用机制与AGEs/RAGE/NF-κB信号通路有关。本研究为马钱苷与黄连素及其复方抗糖尿病性骨质疏松的临床应用提供了一定的科学依据,也为其他降糖药影响骨代谢的研究提供了思路。
