2型糖尿病患者血糖控制水平与角膜神经损伤的相关性
2022-02-24孙敬文陈志杰
郝 静 孙敬文 陈志杰 刘 江 刘 法
据统计,2019年全球糖尿病患病人数已达4.63亿,其中420万成年患者死于糖尿病,占全球死亡人数的 11.3%[1]。2019年,我国糖尿病患者达1.164 亿,位居全球第一,且其发病率呈逐年上升趋势[1]。糖尿病周围神经病变是糖尿病最常见的慢性长期并发症之一,在眼部包括视网膜病变和角膜神经病变[2],角膜神经病变往往与血管变化同时发生,甚至在血管变化之前发生,被认为是糖尿病视网膜病变的早期重要指标,可为视网膜病变风险评估和治疗提供重要参考[3]。角膜神经病变的特征是角膜神经受损和敏感性降低,已有研究认为角膜神经病变与糖尿病病程密切相关[4]。血糖控制不佳,长期高血糖可导致晚期糖基化终末产物(AGEs)生成增加[5],继而损伤角膜毛细血管周细胞和内皮细胞,减少视神经元细胞血液供给,导致神经功能损伤[3]。角膜共聚焦显微镜(CCM)检查是一种简单、快捷、无创、可重复操作的视神经小纤维损伤定量评估技术,在角膜神经病变评估中具有较高应用价值[6]。血糖控制水平与糖尿病患者角膜神经损伤的关系尚不完全清楚,目前缺乏相关报道。因此,本研究拟探讨2型糖尿病患者血糖控制水平与CCM下角膜神经损伤的关系,旨在为临床2型糖尿病患者角膜神经损伤的预防和治疗提供参考资料。
1 资料与方法
1.1 一般资料回顾性病例研究。选择2019年3月至2021年6月我院收治的468例2型糖尿病患者为研究对象。患者纳入标准:(1)符合《中国2型糖尿病防治指南(2017年版)》中相关诊断流程和标准[7];(2)临床资料完整;(3)均行CCM检查,图像质量清晰,资料完整。患者排除标准:(1)眼外伤、自身免疫性疾病、角膜病原菌感染等其他因素引起的角膜神经损伤;(2)先天性青光眼、先天性角膜畸形、角膜肿瘤;(3)患有严重贫血或血红蛋白异常影响糖化血红蛋白(HbA1c)水平者。根据HbA1c水平将468例患者分为A组(HbA1c<7%,152例)、B组(7%≤HbA1c<9%,187例)、C组(HbA1c≥9%,129例)[8]。另外选择20位同期于我院体检的成人自愿者为对照组,均排除干眼、圆锥角膜、感染性角膜炎、眼部外伤史、眼部手术史、糖尿病、干燥综合征等疾病以及角膜接触镜配戴史,长期全身或局部用药史。本研究已经获得我院伦理委员会批准,所有研究对象均知情同意。
1.2 CCM检查
1.2.1 仪器海德堡视网膜断层扫描仪的活体组织学显微镜检查的角膜模块(HRT-III,德国Heidelberg公司),参数设置:激光波长670 nm,放大倍数800倍,视野400 μm×400 μm,图像分辨率为每英寸384像素,轴向分辨率1 μm。
1.2.2 检查方法用5 g·L-1盐酸丁卡因对受检眼行眼球表面麻醉,卡波姆凝胶涂于CCM镜头表面,安装一次性角膜接触帽,受检者端坐于仪器前,前额和下颌分别固定于前额架及下颌托,选择“section” 拍摄模式,拍摄角膜中央及周边上方、下方、鼻侧、颞侧神经丛图像,每层至少拍摄10张图片。每个受检者选择 5 张图片,由我院眼科2名主治医师进行图像定量分析,两者误差超过10%时由副主任医师参与分析,取两个最相近结果的平均值。角膜神经损伤指标主要包括神经密度、主干神经长度、主干神经数量、主干神经弯曲度;检测方法:采用ImageJ软件的NeuronJ插件描记角膜基底膜下神经密度。计算每平方微米神经纤维长度。通过多张CCM图像对比确定主干神经数量,NeuronJ测量主干神经长度以及起止相连直线长度,主干神经弯曲度=主干神经长度/起止相连直线长度[9]。
1.3 相关资料收集收集所有受试者年龄、性别、体重指数、吸烟史、饮酒史、基础疾病(高血压、高脂血症、心脑血管疾病)、合并症(糖尿病肾病、糖尿病视网膜病变、糖尿病足)、收缩压、舒张压、2型糖尿病病程、降糖治疗(口服降糖药物、胰岛素皮下注射),实验室指标:血糖[HbA1c、空腹血糖(FPG)、餐后2 h血糖(2 hPG)、空腹胰岛素(FINS)]、血脂[总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白-胆固醇(LDL-C)、高密度脂蛋白-胆固醇(HDL-C)]、肝功能[谷丙转氨酶(ALT)、谷草转氨酶(AST)]、肾功能[尿素氮(BUN)、血肌酐(Scr)]。

2 结果
2.1 基线资料比较2型糖尿病不同血糖控制水平患者高血压、高脂血症、糖尿病肾病、糖尿病视网膜病变及糖尿病足患者比例,收缩压,HbA1c,FPG,2hPG,FINS,TC,TG,HDL-C,LDL-C,BUN,Scr水平均高于对照组(均为P<0.05)。C组患者糖尿病肾病、糖尿病视网膜病变比例均高于A组(均为P<0.05),与B组间差异均无统计学意义(均为P>0.05)。C组患者2型糖尿病病程、HbA1c、FPG、BUN、Scr水平均高于B组和A组(均为P<0.05),B组患者2型糖尿病病程、HbA1c、FPG、BUN、Scr水平均高于A组(均为P<0.05)。其他指标4组间比较差异均无统计学意义(均为P>0.05)(表1)。

表1 各组受试者基线资料比较
2.2 各组受检者CCM参数比较对照组受检者角膜基底膜下神经纤维数量较多,分支密集,走行平缓(图1A),2型糖尿病患者角膜基底膜下神经纤维数量较少,分布疏松,排列紊乱,走行弯曲(图1B、C、D)。2型糖尿病不同血糖控制水平患者神经密度、主干神经长度、主干神经数量均低于对照组(均为P<0.05),C组患者主干神经弯曲大于对照组(P<0.05),B组和A组患者主干神经弯曲与对照组比较差异均无统计学意义(均为P>0.05)。C组患者角膜基底膜下神经密度、主干神经长度、主干神经数量均低于B组和A组(均为P<0.05),主干神经弯曲均大于B组和A组(均为P<0.05),B组患者角膜基底膜下神经密度、主干神经长度、主干神经数量均低于A组(均为P<0.05),主干神经弯曲与A组相比差异无统计学意义(P>0.05)(表2)。
2.3 2型糖尿病患者临床指标与CCM参数的相关性分析相关性分析结果显示:年龄、2型糖尿病病程、HbA1c、FPG、2hPG、BUN、Scr与2型糖尿病患者角膜基底膜下神经密度均呈负相关(均为P<0.05),2型糖尿病病程、HbA1c、FPG与主干神经长度和数量均呈负相关(均为P<0.05),主干神经弯曲度与临床指标均无相关性(均为P>0.05)(表3)。
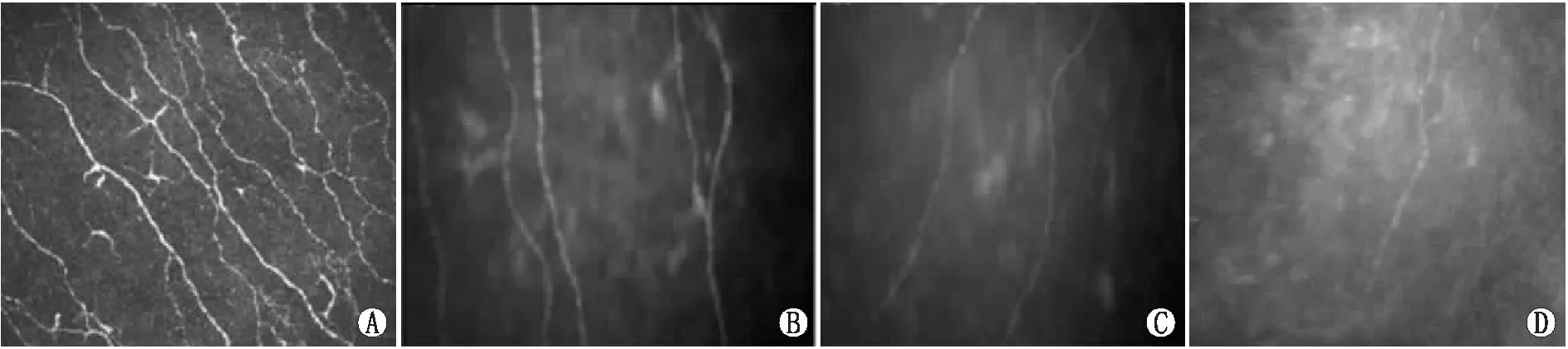
图1 各组受检者角膜基底膜下神经丛 A:对照组;B:A组;C:B组;D:C组。
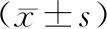
表2 各组受检者CCM参数比较
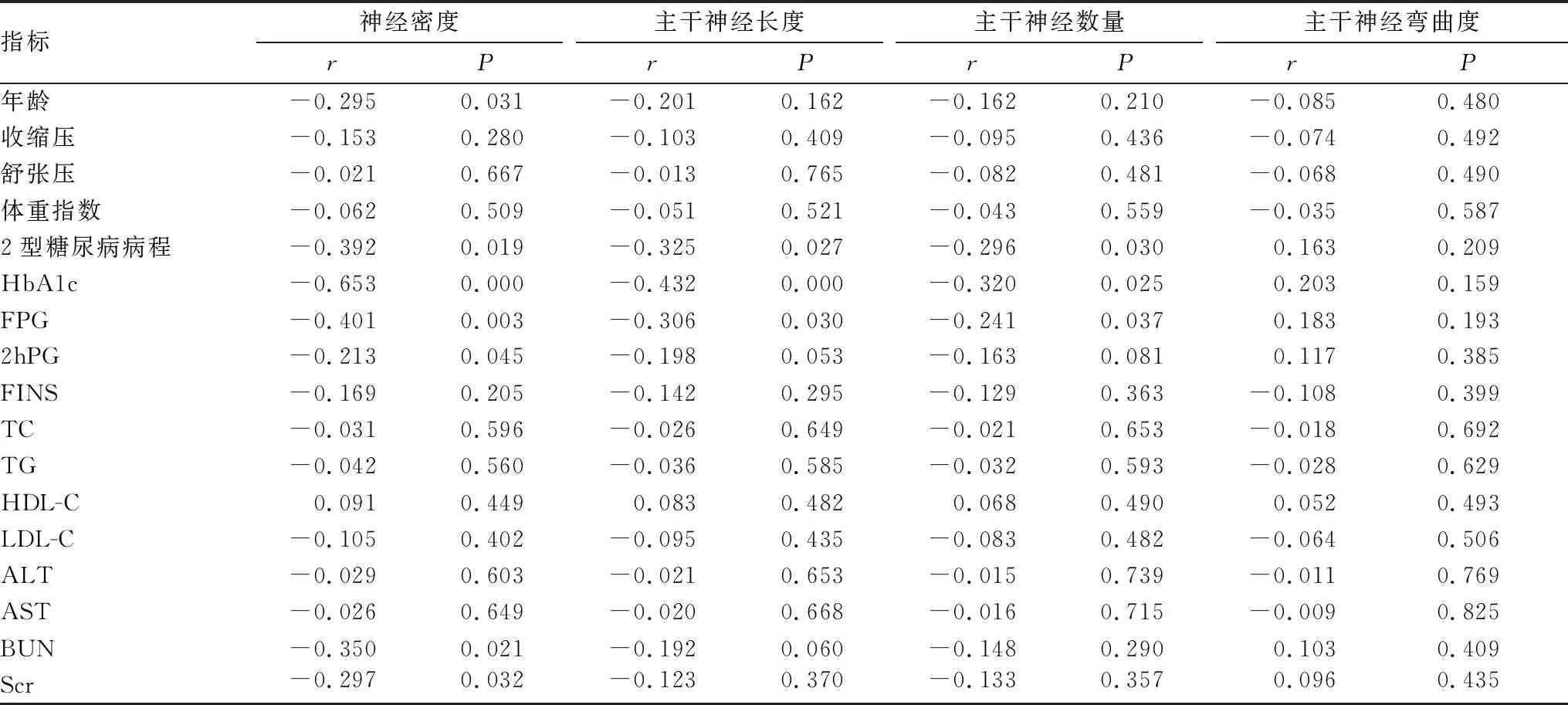
表3 临床指标与CCM参数相关系数
2.4 影响2型糖尿病患者角膜基底膜下神经密度的多重线性回归分析构建多重线性回归方程,以2型糖尿病患者角膜基底膜下神经密度为因变量,年龄、性别(赋值:0=女,1=男)、体重指数、吸烟史(赋值:0=否,1=是)、饮酒史(赋值:0=否,1=是)、高血压(赋值:0=否,1=是)、高脂血症(赋值:0=否,1=是)、心脑血管疾病(赋值:0=否,1=是)、糖尿病肾病(赋值:0=否,1=是)、糖尿病视网膜病变(赋值:0=否,1=是)、糖尿病足(赋值:0=否,1=是)、收缩压、舒张压、2型糖尿病病程、降糖治疗(赋值:0=胰岛素皮下注射,1=口服降糖药物)、HbA1c、FPG、2hPG、FINS、TC、TG、HDL-C、LDL-C、BUN、Scr为自变量,共线性分析各自变量Tolerance(容忍度)>0.2,VIF(方差膨胀因子)<10,提示各自变量间不存在共线性关系。逐步法排除无关变量后,最终结果显示,年龄、2型糖尿病病程、HbA1c、BUN与 2型糖尿病患者角膜基底膜下神经密度均有相关性(均为P<0.05)(表4)。
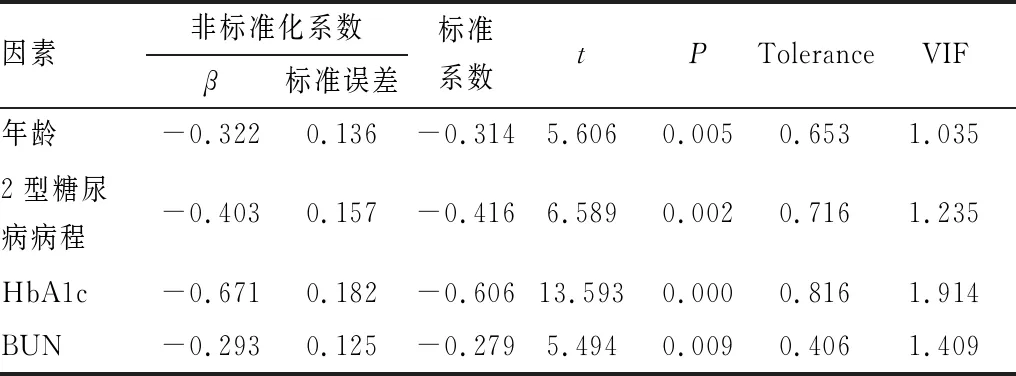
表4 影响2型糖尿病患者角膜基底膜下神经密度的多重线性回归分析
3 讨论
角膜是眼前段最外层的透明结构,其表面分布密集的角膜神经,角膜神经的生长和功能依赖角膜细胞产生的各种营养物质和生长因子[10]。角膜神经通过调节泪液分泌和保护性反射保持角膜透明度并促进角膜健康,并为上皮细胞和基质细胞提供营养支持,机械或化学创伤、疼痛、寒冷、感染、手术伤口、眼部或全身合并症等均可诱发角膜神经损伤[11]。角膜神经损伤会损害患者最佳矫正视力,严重影响患者生活质量。
糖尿病是引起角膜神经损伤的主要原因之一,在糖尿病发病早期即可出现角膜神经损伤,被认为是糖尿病视网膜病变的标志和早期征兆,且随着视网膜病变进展角膜神经结构缺失逐渐加重[12]。糖尿病角膜神经损伤的机制复杂。有研究显示,AGEs积聚,神经源性营养因子、P物质和胰岛素样生长因子缺乏,内源性小单链非编码RNA调控机制异常等多种因素均与糖尿病角膜神经损伤有关[3]。AGEs积聚于角膜损伤毛细血管,导致角膜神经元因缺乏血液供应而凋亡及坏死[13-14]。AGEs的产生与血糖控制水平密切相关,因此推测血糖控制水平可能与糖尿病角膜神经损伤有关。
本研究结果发现,2型糖尿病患者均存在不同程度的角膜神经损伤,与对照组比较,A组、B组、C组患者角膜基底膜下神经密度、主干神经长度、主干神经数量均降低,且C组患者出现明显的主干神经弯曲。刘廷等[15]发现,2型糖尿病患者角膜上皮下神经纤维密度、分支密度均低于健康对照组,弯曲度大于健康对照组。Cruzat等[16]发现,2型糖尿病可引起角膜神经纤维数量及分支密度减少,迂曲度增加,是角膜神经损伤的危险因素。进一步分析发现,不同血糖控制水平患者角膜神经损伤程度不同,其中C组患者角膜神经损伤最严重,相关性分析结果显示,只有HbA1c与角膜基底膜下神经密度呈高度负相关,提示血糖控制不良引起血糖水平偏高可能是角膜神经损伤发生的重要原因。Di Zazzo等[17]发现,高HbA1c水平患者角膜病变更严重,敏感性更低,HbA1c水平与角膜病变程度密切相关。Chao等[18]研究同样发现2 型糖尿病患者HbA1c水平增高与中央角膜神经纤维密度降低有关。分析原因为:首先,高血糖上调细胞内还原型辅酶Ⅱ表达,促使内皮细胞过度产生活性氧,并抑制内皮一氧化氮合酶合成,诱导氧化应激反应和血管内皮功能障碍[19],影响角膜神经细胞血供,导致角膜神经损伤。其次,高血糖状态下AGEs不断产生和积聚于角膜上皮基底膜、基质、后弹力层,引起蛋白异常交联,破坏细胞结构,引起无菌性角膜炎,加剧细胞内活性氧水平,导致细胞内DNA氧化损伤,最终影响角膜上皮和基质功能[20],加速角膜神经细胞凋亡,导致神经纤维减少。最后,高血糖直接导致细胞内葡萄糖浓度升高,高血糖通过增加醛糖还原酶活性激活多元醇代谢途径,诱导具有细胞毒性的活性氧产生,引起氧化损伤和线粒体功能障碍,导致神经轴突脱髓鞘,破坏轴突内稳态,影响轴突再生[21],继而引起角膜神经缺血、水肿和变性。
本研究多重线性回归分析发现,年龄、2型糖尿病病程、HbA1c、BUN均与2型糖尿病患者角膜神经损伤有相关性,说明2型糖尿病角膜神经损伤是多种因素共同作用的结果,年龄的增加,病程的延长,高HbA1c,血糖控制不良以及合并肾功能损害可能协同作用促使了角膜神经细胞损伤、结构改变和功能障碍。
综上所述,2型糖尿病患者血糖控制不良可能与角膜神经损伤有关,控制血糖水平在稳定状态可能有助于延缓角膜神经损伤进程,降低角膜病变风险。本研究结果提示,临床上对糖尿病患者应重视角膜神经病变的检查,以便早期诊断、早期干预,控制病情进展,预防相关并发症的发生。由于目前国内外缺乏统一的角膜神经损伤评价标准,可能导致本研究结果产生偏倚,这一问题尚有待进一步解决。
