人脐带间充质干细胞对DR大鼠视网膜神经节细胞凋亡的影响及对p38MAPK通路的调控作用
2022-02-23刘曦孙晓萍杨建伟朱冬梅王媛
刘曦 孙晓萍 杨建伟 朱冬梅 王媛
郑州大学附属郑州市中心医院眼科 450000
视网膜神经节细胞(retinal ganglion cells,RGCs)是视网膜最早分化的神经细胞,具有转导和加工视觉信号的功能。长期慢性高血糖可引起RGCs凋亡和功能障碍,导致视网膜形态和功能发生异常,进而造成糖尿病患者视力丧失[1]。现有的临床治疗方法存在固有的局限性,难以完全治愈糖尿病视网膜病变(diabetic retinopahy,DR)。寻找更安全有效的治疗方法是目前DR研究关注的热点。间充质干细胞(mesenchymal stem cells,MSCs)是一类具有自我更新能力和多项分化潜能的干细胞,为神经再生提供有利条件,促进神经细胞再生和功能恢复[2]。人脐带间充质干细胞(human umbilical cord derived mesenchymal stem cells,hUC-MSC)是从人脐带获取的一类MSCs,来源广泛、取材方便、免疫原性低,可修复多种原因引起的器官损伤,其在心肌梗死、卵巢早衰等多种疾病的治疗中被广泛应用[3-4]。已有研究证实,通过移植hUC-MSC对视网膜和视神经损伤具有一定修复作用[5]。但hUC-MSC对RGCs凋亡作用机制的研究尚缺乏。本研究拟观察hUC-MSC玻璃体内注射对DR模型大鼠RGCs凋亡的作用,并探讨其可能的作用机制。
1 材料与方法
1.1 材料
1.1.1实验动物 SPF级8周龄SD雄性大鼠[SCXK(京)2016-0011,北京维通利华实验动物技术有限公司]65只,体质量(230±20)g。大鼠于温度(20±2)℃、相对湿度(50±10)%、12 h/12 h光暗交替的环境下适应性饲养1周。所有大鼠实验前全部用裂隙灯显微镜进行眼底检查,排除眼部疾病。实验动物的饲养和使用遵循美国视觉和眼科研究协会声明。本研究方案经郑州大学附属郑州市中心医院动物实验伦理委员会审核批准(批文号:20180316)。
1.1.2主要试剂及仪器 链脲佐菌素(streptozotocin,STZ)(美国Sigma公司);hUC-MSC(1×106个/管,广州赛莱拉干细胞科技股份有限公司);异硫氰酸荧光素葡聚糖(瑞典TdB Labs AB公司);高糖高脂饲料(江苏省协同医药生物工程有限公司);荧光金(fluoro gold,FG)(美国Biotium公司);TUNEL试剂盒(瑞士Roche公司);免疫组化试剂盒(美国Santa Cruz Biotechnology公司);兔抗大鼠B细胞淋巴瘤/白血病-2(B cell lymphoma /leukemia-2,Bcl-2)单克隆抗体(ab182858)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)单克隆抗体(ab32503)、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)单克隆抗体(ab32142)、磷酸化p38MAPK(phosphorylated p38 mitogen-activated protein kinase,p-p38MAPK)多克隆抗体(ab47363)、β-actin(ab8227)、辣根过氧化物酶(horseradish peroxidase,HRP)标记、山羊抗兔IgG(ab6721)(英国Abcam公司)。裂隙灯显微镜(YZ5S)、检眼镜(YZ-6E)(苏州六六视觉科技股份有限公司);脑立体定位仪(深圳瑞沃德生命科技有限公司);TOPCON50DX型血管荧光造影机(日本TOPCON公司);DMi8倒置荧光显微镜(德国Leica公司);PowerPac系列电泳仪(美国Bio-Rad公司)。
1.2 方法
1.2.1DR模型的制备及分组 STZ以pH4.5的柠檬酸缓冲液稀释,随机选取45只大鼠,按照60 mg/kg单次腹腔注射STZ,诱导糖尿病大鼠模型。STZ注射后72 h,尾静脉采血测量大鼠血糖,连续测量3 d,3次血糖均≥16.7 mmol/L,视为成功建立糖尿病大鼠模型。45只大鼠均成功建立糖尿病模型,继续饲喂高糖高脂饲料(江苏省协同医药生物工程有限公司)4周,期间每周测一次空腹血糖(fasting blood glucose,FBG)和体质量,使其血糖维持在16.7 mmol/L以上,剔除实验过程中死亡及白内障大鼠5只,剩余40只大鼠。末次饲喂高糖高脂饲料后,将50 mg/ml异硫氰酸葡聚糖溶解于磷酸盐缓冲液(phosphate buffer saline,PBS)中后经尾静脉注入,采用眼底血管荧光造影机行眼底血管荧光造影检查,眼底出现微血管瘤或者微血管病变的大鼠视为DR造模成功。DR模型大鼠按照随机数字表法分为模型组20只,hUC-MSC注射组20只。另选取20只正常大鼠为对照组,腹腔注射等量柠檬酸缓冲液,饲喂正常饲料。
1.2.2hUC-MSC玻璃体内注射 DR造模成功后,采用复方托吡卡胺滴眼液[参天制药(中国)有限公司]充分扩瞳后进行干预。hUC-MSC注射组大鼠玻璃体内注射hUC-MSC,注射剂量参照文献[6],使用微量注射器抽取1 μl hUC-MSC(1×106个),打散细胞,注射器于角巩膜缘后1 mm约40°斜角进针,绕过晶状体到达视网膜中央,透过角膜和晶状体看到针尖出现进行注射,避免损伤晶状体,注射完毕后停留30 s后拔针。对照组和模型组大鼠注射等量PBS。注射完毕后用红霉素眼膏(上海通用药业股份有限公司)点眼以预防炎症。各组均注射2次,2次注射间隔7 d。
1.2.3FG逆行示踪标记RGCs观察存活RGCs数目 末次玻璃体内注射后7 d,每组采用随机数字表法随机取5只大鼠,麻醉后固定于脑立体定位仪上,颅顶备皮,分离头皮筋膜组织暴露颅骨前囟骨性标志,确定Bregme点,根据大鼠脑立体定位图谱确定双侧上丘及外侧膝状体,用牙科钻钻约1 mm直径骨孔,用10 μl微量注射器向4个骨孔注射体积分数2%的FG各2 μl,注射完毕后,留针5 min再缓慢拔出针头,缝合筋膜和皮肤。标记后4 d,腹腔注射麻醉大鼠,开胸,左心室插管用生理盐水进行灌注,改用质量浓度4%多聚甲醛固定,待四肢及尾部出现颤动、逐渐僵硬,肝脏颜色变白时停止灌注。摘取左侧眼球,剪除角膜、晶状体和玻璃体,分离视网膜,铺于载玻片上,选取视网膜周边4处剪开并铺平,50%甘油封片,荧光显微镜下拍照,采用Image Pro-Plus软件计数RGCs,以每mm2中的RGCs数量作为细胞密度。
1.2.4苏木精-伊红染色观察视网膜形态学变化 末次玻璃体内注射后7 d,每组采用随机数字表法随机取10只大鼠过量麻醉法处死,摘取左侧眼球,于4%多聚甲醛中固定24 h;去除眼前节和玻璃体,梯度浓度乙醇脱水,二甲苯透明,石蜡包埋,切片机连续切片,切片厚度4 μm,常规苏木精-伊红染色,中性树胶封片,光学显微镜下观察视网膜形态变化。
1.2.5TUNEL染色观察RGCs凋亡情况 取石蜡切片,常规脱蜡水化,体积分数30% H2O2室温处理10 min,PBS冲洗;蛋白酶K 37 ℃消化10 min,PBS冲洗;加入标记液于37 ℃湿盒内孵育2 h,滴加封闭液室温封闭30 min,加入生物素化抗地高辛抗体于37 ℃湿盒孵育30 min,PBS冲洗;加入链霉亲和素-生物素-过氧化物酶复合物(streptavidin-biotin complex,SABC)于37 ℃湿盒孵育30 min,二氨基联苯胺(diaminobenzidine,DAB)显色5 min,中性树胶封片,光学显微镜下观察RGC层细胞凋亡情况。细胞凋亡率=(凋亡细胞数/细胞总数)×100%。
1.2.6Western blot法检测视网膜Bax、Bcl-2、p38MAPK、p-p38MAPK蛋白相对表达水平 末次玻璃体内注射后7 d,摘取各组剩余5只大鼠左侧眼球,保存于液氮中。取液氮中保存的眼球,剥离视网膜,加入RIPA液裂解组织,冰上孵育30 min,12 000×g4 ℃条件下离心10 min,取上清,BCA法蛋白定量。取加样缓冲液加入蛋白样品中,煮沸10 min使蛋白变性,进行SDS-聚丙烯酰胺凝胶电泳,电泳结束后将蛋白转印至PVDF膜,置于质量浓度5%脱脂奶粉中封闭2 h;TBST溶液洗膜,加入1∶ 2 000稀释的Bax、Bcl-2、p38MAPK、p-p38MAPK或β-actin一抗,4 ℃条件下孵育过夜;TBST溶液洗膜,加入1∶ 5 000稀释的HRP标记二抗,室温下孵育2 h;TBST溶液洗膜,加入ECL化学发光液,曝光显影,用ImageJ软件分析条带灰度值。以β-actin作为内参照,计算目的蛋白与内参条带灰度比值,作为目的蛋白相对表达量。
1.3 统计学方法
采用SPSS 24.0统计学软件进行统计分析。本研究中计量资料经W检验呈正态分布,以mean±SD表示,各组计量资料比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 造模过程中FBG和体质量变化情况
实验过程中,对照组大鼠FBG维持在正常水平,体质量随时间逐步增长;造模组大鼠FBG维持在较高水平,体质量增长缓慢,并于造模第2周开始,呈现逐渐下降的趋势(图1)。

图1 造模组和对照组大鼠FBG和体质量随时间变化情况 A:各组大鼠不同时间FBG变化曲线 对照组大鼠FBG维持在正常水平;造模组大鼠FBG维持在高水平 B:各组大鼠不同时间体质量变化曲线 对照组大鼠体质量随时间平稳增长;造模组大鼠体质量增长缓慢,并于造模第2周开始逐步下降 FBG:空腹血糖Figure 1 Changes of FBG and body weight of rats in each group A:Change curves of FBG The FBG of rats in the control group was maintained at a normal level,and the FBG of rats in the modeling group was maintained at a high level B:Change curves of body weight The body weight of rats in the control group was increased steadily over time,and the body weight of rats in the modeling group was increased slowly,and began to gradually decrease on the second week after modeling FBG:fasting blood glucose
2.2 造模后视网膜血管走行和渗漏情况
对照组大鼠视网膜血管呈放射状排列,分布规则,血管走行正常,无荧光素渗漏;造模组大鼠视网膜远端血管发生扭曲,形状不规则,可见毛细血管荧光素渗漏,渗漏面积较大(图2)。

图2 各组大鼠眼底血管荧光造影图 A:对照组大鼠视网膜血管走行正常,无荧光素渗漏 B:造模组大鼠视网膜远端血管发生扭曲,可见大面积荧光素渗漏Figure 2 Fundus angiography images of the two groups A:The retinal blood vessels of rats in the control group run normally without fluorescein leakage B:The distal retinal vessels of rats in the modeling group were distorted and large area of fluorescein leakage was observed
2.3 各组大鼠RGCs存活情况变化
对照组、模型组和hUC-MSC注射组FG逆行示踪标记RGCs密度分别为(2 136.10±215.17)、(849.40±167.82)和(1 549.20±183.26)个/mm2,各组RGCs密度总体比较差异有统计学意义(F=115.218,P<0.01);其中模型组和hUC-MSC注射组RGCs密度较对照组减少,差异均有统计学意义(均P<0.05);hUC-MSC注射组RGCs密度较模型组增加,差异有统计学意义(P<0.05)(图3)。

图3 各组大鼠视网膜铺片荧光金逆行标记RGCs染色图(FG ×200,标尺=40 μm) A:对照组RGCs密度较大 B:模型组RGCs密度较对照组明显降低 C:hUC-MSC注射组RGCs密度较模型组升高Figure 3 Fluoro gold retrogradely labeled RGCs staining images of retina stretched preparation in each group(FG ×200,bar=40 μm) A:The RGCs density was high in the control group B:The RGCs density in the model group was lower than that in the control group C:The RGCs density in the hUC-MSC injection group was higher than that in the model group
2.4 各组大鼠视网膜组织病理形态学变化
对照组视网膜结构清晰,层次分明,RGCs形态完整,数目较多;模型组RGCs数量明显减少,出现核固缩,RGC层变薄萎缩;hUC-MSC注射组视网膜结构较完整,RGCs数目较模型组多(图4)。

图4 各组大鼠视网膜组织病理学染色结果(HE ×400,标尺=50 μm) A:对照组视网膜结构正常 B:模型组视网膜RGCs数量较对照组减少,出现核固缩 C:hUC-MSC注射组视网膜结构接近对照组Figure 4 Histopathological staining results of rat retina in each group(HE ×400,bar=50 μm) A:The retinal structure in the control group was normal B:The number of RGCs in the model group was reduced with pyknosis C:The retinal structure in the hUC-MSC injection group was similar to that in the normal group
2.5 各组大鼠RGCs凋亡率变化
对照组、模型组和hUC-MSC注射组RGCs凋亡率分别为(2.16±1.11)%、(43.47±2.26)%和(20.75±2.18)%,各组RGCs凋亡率总体比较差异有统计学意义(F=445.159,P<0.01);其中模型组和hUC-MSC注射组RGCs凋亡率明显高于对照组,hUC-MSC注射组RGCs凋亡率低于模型组,差异均有统计学意义(均P<0.05)(图5)。
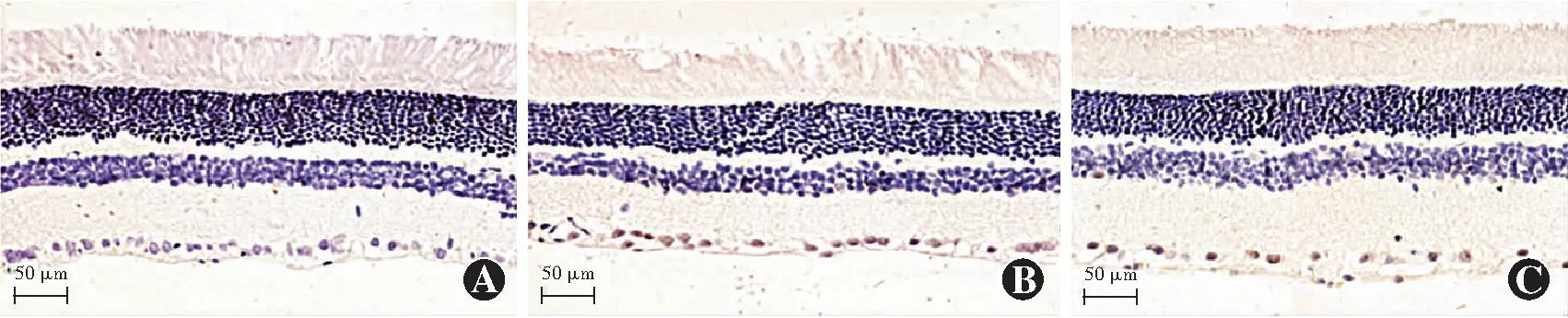
图5 各组大鼠RGCs凋亡染色图(TUNEL ×400,标尺=50 μm) A:对照组未见明显TUNEL阳性细胞 B:模型组TUNEL阳性细胞数较对照组明显增多 C:hUC-MSC注射组TUNEL阳性细胞数较模型组减少Figure 4 Apoptosis staining images of RGCs in each group(TUNEL ×400,bar=50 μm) A:No obvious TUNEL-positive cells was found in the retina of the control group B:There were more TUNEL-positive cells in the retina of model group than that of the control group C:There were fewer TUNEL-positive cells in the retina of hUC-MSC injection group than that of the model group
2.6 各组大鼠视网膜组织Bax、Bcl-2、p38MAPK和p-p38MAPK蛋白相对表达量变化
对照组、模型组和hUC-MSC注射组视网膜组织Bax、Bcl-2、p-p38MAPK蛋白相对表达量总体比较差异有统计学意义(F=30.982、12.526、73.158,P<0.01),p38MAPK蛋白相对表达量总体比较差异无统计学意义(F=1.182,P=0.322);模型组和hUC-MSC注射组的Bax和p-p38MAPK蛋白相对表达量明显高于对照组,Bcl-2蛋白相对表达量明显低于对照组,差异均有统计学意义(均P<0.05);hUC-MSC注射组Bax和p-p38MAPK蛋白相对表达量明显低于模型组,Bcl-2蛋白相对表达量明显高于模型组,差异均有统计学意义(均P<0.05)。(图6,表1)。
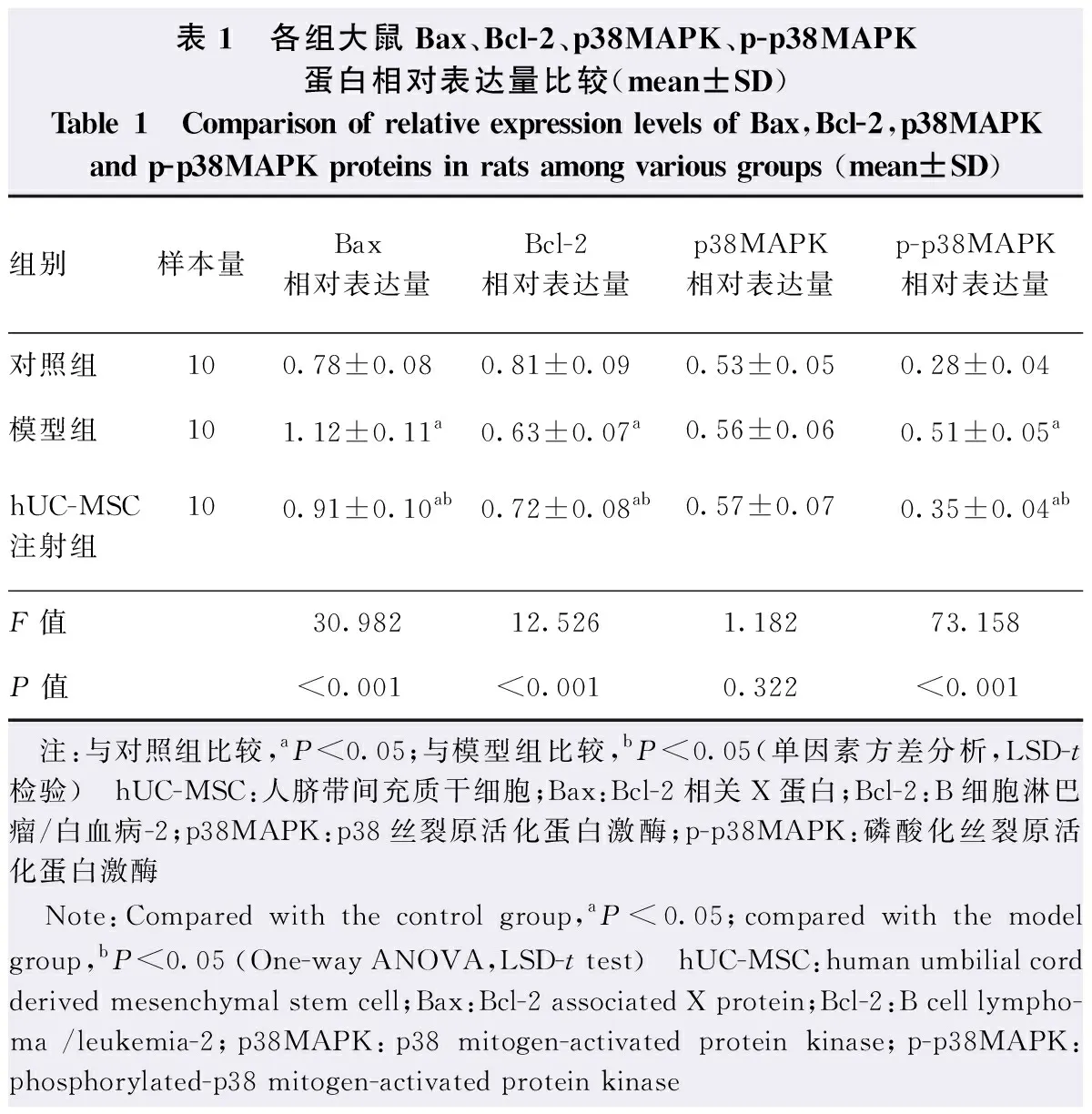
表1 各组大鼠Bax、Bcl-2、p38MAPK、p-p38MAPK蛋白相对表达量比较(mean±SD)Table 1 Comparison of relative expression levels of Bax,Bcl-2,p38MAPK and p-p38MAPK proteins in rats among various groups (mean±SD)组别样本量Bax相对表达量Bcl-2相对表达量p38MAPK相对表达量p-p38MAPK相对表达量对照组100.78±0.080.81±0.090.53±0.050.28±0.04模型组101.12±0.11a0.63±0.07a0.56±0.060.51±0.05ahUC-MSC注射组100.91±0.10ab0.72±0.08ab0.57±0.070.35±0.04abF值30.98212.5261.18273.158P值<0.001<0.0010.322<0.001 注:与对照组比较,aP<0.05;与模型组比较,bP<0.05(单因素方差分析,LSD-t检验) hUC-MSC:人脐带间充质干细胞;Bax:Bcl-2相关X蛋白;Bcl-2:B细胞淋巴瘤/白血病-2;p38MAPK:p38丝裂原活化蛋白激酶;p-p38MAPK:磷酸化丝裂原活化蛋白激酶 Note:Compared with the control group,aP<0.05;compared with the model group,bP<0.05 (One-way ANOVA,LSD-t test) hUC-MSC:human umbilial cord derived mesenchymal stem cell;Bax:Bcl-2 associated X protein;Bcl-2:B cell lympho-ma /leukemia-2;p38MAPK:p38 mitogen-activated protein kinase;p-p38MAPK:phosphorylated-p38 mitogen-activated protein kinase

图6 各组大鼠视网膜组织Bax、Bcl-2、p38MAPK、p-p38MAPK蛋白表达电泳图 模型组和hUC-MSC注射组Bax和p-p38MAPK蛋白表达条带较对照组增强,Bcl-2蛋白条带较对照组减弱;hUC-MSC注射组Bax和p-p38MAPK蛋白表达条带较模型组减弱,Bcl-2蛋白表达条带较模型组增强,各组p38MAPK蛋白表达条带强度无显著差别 Bcl-2:B细胞淋巴瘤/白血病-2;Bax:Bcl-2相关X蛋白;p38MAPK:p38丝裂原活化蛋白激酶;p-p38MAPK:磷酸化丝裂原活化蛋白激酶;β-actin:β-肌动蛋白;hUC-MSC:人脐带间充质干细胞Figure 6 Electrophoretogram of Bax,Bcl-2,p38MAPK,p-p38MAPK protein expression of retinal tissues in each group The Bax and p-p38MAPK protein expression bands were stronger and the Bcl-2 protein band was weaker in the model group and the hUC-MSC injection group than those in the control group;the Bax and p-p38MAPK protein expression bands were weaker and the Bcl-2 protein expression band was stronger in the hUC-MSC injection group than those in the model group.There was no significant difference in the intensity of the p38MAPK protein expression bands among the three groups Bcl-2:B cell lymphoma/leukemia-2;Bax:Bcl-2 associated X protein;p38MAPK:p38 mitogen-activated protein kinase;p-p38MAPK:phosphorylated-p38 mitogen-activated protein kinase;hUC-MSC:human umbilial cord derived mesenchymal stem cell
3 讨论
DR与糖尿病病程密切相关,病程越长DR发病率越高。高血糖可引起细胞内渗透压升高、电解质代谢紊乱,破坏细胞结构的完整性,还可结合蛋白质、脂质等物质,引起细胞损伤和凋亡,导致视网膜微血管病变和神经元功能受损[7-8]。细胞凋亡在DR发生和发展过程中起重要作用,DR患者早期可表现出RGCs凋亡现象,而RGCs细胞凋亡是引起视力下降的主要原因,抑制高糖诱导RGCs细胞凋亡对保护糖尿病患者视力具有重要意义[9-10]。张惟等[11]研究证实,hUC-MSC能明显修复DR大鼠视网膜损伤,对DR视神经损伤具有一定治疗作用。另有研究显示,抑制p38MAPK通路,能够增强hUC-MSC的组织修复能力[12]。鉴于hUC-MSC对神经损伤具有保护作用且与p38MAPK信号通路有关,本研究探讨玻璃体内注射hUC-MSCs对DR模型大鼠RGCs凋亡的抑制作用及对p38MAPK信号通路的调控作用。
MSCs是治疗多种疾病的细胞来源,可分化为神经元细胞,还可分泌神经营养因子,促进神经细胞存活,对视网膜退行性病变有良好的效果,对视神经损伤患者视力、闪光型视觉诱发电位均有明显改善效果[13-14]。hUC-MSC是MSCs主要来源之一,具有干细胞的一般特点,可向损伤部位定向迁移,修复组织损伤。已有研究显示hUC-MSC分化为神经元样细胞,并能表达神经细胞标志物,其诱导分化的神经干细胞能增加糖尿病模型大鼠视网膜RGCs数量,表明hUC-MSC具有一定的神经保护作用[15]。本研究结果显示,参与造模的大鼠FBG维持在高水平,体质量逐渐下降,且视网膜远端血管发生扭曲,毛细血管出现荧光素渗漏,表明DR模型建立成功。在使用hUC-MSC注射后,RGCs数量较模型组明显增多,细胞凋亡率较模型组明显降低,视网膜病理学形态得到显著改善,提示hUC-MSC可减少RGCs凋亡,减轻视网膜病理损伤。Yao等[16]研究显示,hUC-MSC可减轻氧化应激反应,进而防止肝脏缺血-再灌注损伤引起的肝细胞凋亡。Liu等[17]研究表明,hUC-MSC外泌体可抑制H9C2细胞凋亡。以上研究均提示hUC-MSC在抑制细胞凋亡方面具有重要作用。基于以上研究,推测hUC-MSC可抑制RGCs凋亡,对DR大鼠视网膜结构有一定保护作用。
Bcl-2是常见凋亡抑制基因,Bax是Bcl-2家族相关成员之一,具有促进细胞凋亡的作用。高糖可激活RGCs内MAPK相关通路,导致Bax和Bcl-2表达异常,引起细胞内线粒体损伤,降低RGCs活性,进而诱导细胞凋亡[18]。MAPK信号通路广泛存在于各种细胞中,参与细胞增生、分化和凋亡等生物学过程,与DR发生发展过程密切相关[19]。p38MAPK属于MAPK经典途径,是多种细胞信息传导的共同通路,在应激及细胞因子等因素刺激下,p38MAPK被激活或过度表达,形成活性形式p-p38MAPK,继而诱导Bax蛋白激活并转移到线粒体外膜,促进脑组织神经元细胞及静脉内皮细胞凋亡[20-21]。刘高虹等[22]研究表明,高糖可诱导肾小管上皮细胞p-p38MAPK表达升高,进而诱导上皮细胞Bax蛋白表达增加和Bcl-2蛋白表达减少,参与诱导细胞凋亡。本研究结果显示,模型组视网膜组织中p-p38MAPK蛋白和Bax相对表达量较对照组明显升高,Bcl-2蛋白相对表达量较对照组降低,推测视网膜组织p38MAPK信号通路在DR过程中被激活,并参与RGCs凋亡过程;hUC-MSC注射组p-p38MAPK和Bax蛋白相对表达量明显低于模型组,且Bcl-2蛋白相对表达量高于模型组,推测hUC-MSC可能通过p38MAPK信号通路抑制RGCs凋亡。
综上所述,本研究结果证实,hUC-MSC对DR大鼠视网膜损伤具有一定保护作用,可能通过阻断p38MAPK信号通路来抑制RGCs凋亡,改善视网膜病理损伤,从而延缓DR进展,为临床治疗DR提供一定理论参考。但本研究仅为在体动物水平研究,尚缺乏安全性研究和离体细胞水平实验研究结果,其安全性和有效性有待进一步验证。此外,本研究中仅使用单一剂量进行干预,其是否可作为最适剂量,仍需进行剂量实验以验证效果。
利益冲突所有作者均声明不存在任何利益冲突
