ROS/NLRP3/Caspase-1信号通路在高糖诱导视网膜色素上皮细胞凋亡中的作用
2022-02-23李宏松李蓉王丽君廖丁莹王建明
李宏松 李蓉 王丽君 廖丁莹 王建明
1西安交通大学第二附属医院眼科710004;2西安医学院第一附属医院眼科 710077
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病常见的眼部并发症之一,是一种与持续性高血糖相关的慢性、进行性、可致盲的视网膜微血管病变[1]。研究表明,高血糖、氧化应激和慢性炎症是DR发生的重要机制[2]。核苷酸结合寡聚化结构域样受体家族含Pyrin结构域蛋白3(nucleotide-binding domain,leucine-rich-containing family,pyrin domain-containing 3,NLRP3)炎症小体是固有免疫的重要组分,是参与多种炎症相关疾病的关键因子,其能被活性氧簇(reactive oxygen species,ROS)激活,并调控下游的炎症反应及细胞凋亡等病理生理过程[3]。有研究显示,DR患者玻璃体腔纤维增生膜中NLRP3高表达[4]。视网膜色素上皮(retinal pigment epithelium,RPE)细胞是DR增生膜的重要细胞来源,位于神经视网膜和脉络膜之间,组成血-视网膜屏障,从而维持视网膜正常功能,而且RPE细胞具有清除自由基、分泌色素上皮衍生因子(pigment epithelium-derived factor,PEDF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)等活性物质的功能[5]。RPE细胞功能异常会导致血-视网膜屏障的破坏以及PEDF和VEGF分泌失衡,最终引起新生血管的产生,而且RPE细胞间紧密连接的破坏会引起细胞迁移和增生,最终参与增生膜的形成[6]。因此,RPE细胞在DR发生和发展中具有重要作用。目前,NLRP3炎症小体在高糖诱导RPE细胞损伤中的作用及其机制尚不清楚。本研究拟探讨NLRP3炎症小体途径在高糖损伤RPE细胞中的作用及机制,以期为DR的预防和治疗提供新靶点。
1 材料与方法
1.1 材料
1.1.1细胞来源 人RPE细胞株ARPE-19购自美国ATCC细胞库。
1.1.2主要试剂及仪器 DMEM/F12培养基、胎牛血清(美国Gibco公司);兔抗凋亡相关斑点样蛋白单克隆抗体(apoptosis associated speck-like protein containing CARD,ASC)(ab155970)、兔抗Caspase-1单克隆抗体(ab207802)(英国Abcam公司);兔抗NLRP3多克隆抗体(NBP2-12446)(美国Novus Biologicals公司);兔抗凋亡相关蛋白B淋巴细胞瘤2(B cell lymphoma/leukemia-2,Bcl-2)多克隆抗体(3869)、兔抗Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)多克隆抗体(2772)、兔抗Caspase-3多克隆抗体(9662)(美国CST公司);兔抗磷酸甘油醛脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GAPDH)多克隆抗体(AB-P-R 001)(杭州贤至生物有限公司);NLRP3抑制剂CY-09(美国Selleck公司);细胞计数试剂盒8(cell counting kit,CCK-8)(美国MedChemExpress公司);APC/7-AAD细胞凋亡试剂盒(天津三箭生物技术股份有限公司);活性氧检测试剂盒、RIPA裂解液、BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);超氧化物歧化酶(superoxide dismutase,SOD)及丙二醛(malondialdehyde,MDA)生化试剂盒(南京建成生物工程研究所)。CO2恒温培养箱(日本Sanyo公司);倒置相差显微镜(日本Olympus公司);全自动酶标仪(美国Thermo Fisher Scientific公司);流式细胞仪(美国Beckman Coulter公司);电泳仪及电泳槽(北京六一仪器厂);室温低速离心机(德国Eppendorf公司);低温高速离心机(上海力康生物医疗科技公司)。
1.2 方法
1.2.1高糖诱导RPE细胞损伤模型建立 取ARPE-19细胞株,用含体积分数10%胎牛血清的DMEM/F12培养液,置于37 ℃、体积分数5%CO2恒温培养箱中培养。取处于对数生长期、生长状态良好的细胞分为正常对照组和高糖组,分别置于正常培养液和含终浓度30 mmol/L葡萄糖培养液中培养48 h。
1.2.2荧光探针及生物化学检验法检测正常对照组和高糖组细胞氧化应激相关指标 (1)DCFH-DA荧光探针检测各组细胞中ROS含量 取各组培养48 h的细胞,质量浓度0.25%胰蛋白酶消化细胞,1 500 r/min离心5 min,收集细胞;用无血清培养液按照1∶ 1 000稀释DCFH-DA,使终浓度为10 μmol/L,用稀释好的DCFH-DA重悬细胞,于37 ℃恒温培养箱内孵育20 min,流式细胞仪上机检测。(2)生物化学检验法检测各细胞中SOD活力值和MDA浓度 将细胞以2×105个/ml密度接种于6孔板中,收集各组细胞放入EP管中,加入200 μl双蒸水,直接放入液氮3~5 s,立即取出并转入-20 ℃冰箱中放置20~30 s,取出于室温下解冻约5 min(EP管内冰融化即可),上述操作重复3次,形成匀浆液;将匀浆液于5 000 r/min离心5~10 min,取上清液待用。分别根据SOD和MDA生化试剂盒说明书对上清液进行SOD活力值和MDA浓度检测。
1.2.3CCK-8法检测不同浓度CY-09作用后细胞增生率 取处于对数生长期的细胞,制成5×104个/ml的单细胞悬液,按照每孔100 μl单细胞悬液均匀接种至96孔板中,同时设置空白孔作为对照,置于37 ℃、5%CO2及饱和湿度的条件下培养过夜。按照1.2.1部分进行分组处理,并取正常对照组和高糖组细胞分别加入0、2、5、10、15和20 μmol/L CY-09培养48 h,向每孔加入10 μl CCK-8溶液,于37 ℃培养4 h,振荡10 min,使用全自动酶标仪测定各孔在450 nm处的吸光度(A)值。计算各组不同浓度CY-09处理后细胞增生率,细胞增生率(%)=(实验组A值-空白孔A值)/(正常对照组A值-空白孔A值)×100%。根据细胞增生率选择CY-09作用的适宜浓度。
1.2.4流式细胞术检测细胞凋亡率 将细胞以2×105个/ml密度接种于6孔板中,将细胞分为正常对照组、正常+CY-09组、高糖组和高糖+CY-09组,其中正常+CY-09组和高糖+CY-09组培养液中添加15 μmol/L CY-09;培养48 h,1 500 r/min离心5 min,收集细胞。按照Annexin-APC/7-AAD细胞凋亡检测试剂盒说明书进行操作,磷酸盐缓冲液洗涤细胞,加入500 μl上样缓冲液重悬细胞,分别加入5 μl 7-AAD和Annexin-APC染色,室温下避光孵育15 min,用流式细胞仪检测各组细胞的凋亡率。
1.2.5Western blot法检测细胞炎症小体相关蛋白、凋亡相关蛋白的表达 按照1.2.4部分收集各组细胞,加入400 μl RIPA裂解液充分裂解细胞,12 000 r/min离心10 min,提取细胞总蛋白,BCA法测定蛋白浓度。每孔上样40 μg蛋白进行SDS-聚丙烯酰胺凝胶电泳,将蛋白转印至PVDF膜;取膜于含有50 g/L脱脂奶粉的TBST缓冲液内室温封闭2 h,加入GAPDH、NLRP3、ASC、Caspase-1、Bcl-2、Bax、Caspase-3一抗(均1∶ 1 000稀释),4 ℃孵育过夜,含体积分数0.1%吐温20的TBS缓冲液(TBST)洗膜;用TBST稀释HRP标记羊抗兔二抗(1∶ 50 000)室温下摇床上孵育2 h。超敏ECL化学发光液显色曝光后扫描胶片,并采用ImageJ软件进行图像处理与分析。以GAPDH作为内参,以目的蛋白与GAPDH的蛋白产物条带灰度值之比作为其蛋白的相对表达量。
1.3 统计学方法
采用SPSS 23.0统计学软件进行统计分析,采用Graphpad Prism 8.0软件绘制图表。计量资料数据经Shapiro-Wilk检验证实呈正态分布,以mean±SD表示。采用均衡分组单因素干预多水平研究设计,正常对照组与高糖组间各计量资料差异比较采用独立样本t检验;多组间计量资料总体差异比较采用单因素方差分析,组间多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 正常对照组与高糖组RPE细胞内ROS含量、MDA浓度和SOD活力值的比较
高糖组RPE细胞内ROS荧光强度值为120 020±3 245,明显高于正常对照组的35 426±811,差异有统计学意义(t=35.760,P<0.05)。高糖组RPE细胞内MDA浓度为(4.92±0.09)nmol/mg,明显高于正常对照组的(1.78±0.03)nmol/mg,差异有统计学意义(t=46.960,P<0.05);高糖组SOD活力值为(35.65±1.22)μmol/(min·mg),明显低于正常对照组的(74.96±1.41)μmol/(min·mg),差异有统计学意义(t=29.830,P<0.05)(图1)。
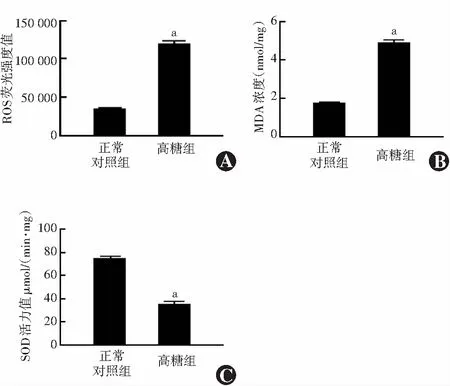
图1 正常对照组与高糖组RPE细胞内ROS含量、MDA浓度、SOD活力值比较 A:各组ROS荧光强度值比较 B:各组MDA浓度比较 C:各组SOD活力值定量比较 与正常对照组比较,aP<0.05(独立样本t检验,n=3) ROS:活性氧簇;MDA:丙二醛;SOD:超氧化物岐化酶Figure 1 Comparison of ROS content,MDA concentration and SOD activity in RPE cells between the two groups A:Comparison of ROS fluorescence intensity B:Comparison of MDA concentration C:Comparison of SOD activity Compared with the normal control group,aP<0.05 (Independent samples t-test,n=3) ROS:reactive oxygen species;MDA:malondialdehyde;SOD:superoxide dismutase
2.2 各组内不同浓度CY-09处理细胞的增生率比较
倒置显微镜下可见,正常对照组RPE细胞贴壁良好,形态多呈较为饱满的多边形及梭形、细胞质丰富,相邻细胞呈聚集状态;高糖组RPE细胞呈散在分布,细胞活力及细胞密度均较正常对照组降低(图2)。高糖组细胞增生率明显低于正常对照组,差异有统计学意义(t=18.820,P<0.05)。正常对照组中不同浓度CY-09处理细胞的增生率总体比较,差异有统计学意义(F=6.729,P=0.003),其中2、5、10和15 μmol/L CY-09处理细胞的增生率与0 μmol/L CY-09处理细胞比较,差异均无统计学意义(均P>0.05);20 μmol/L CY-09处理细胞的增生率明显低于0 μmol/L CY-09处理细胞,差异有统计学意义(P<0.05)。高糖组中不同质量浓度CY-09处理细胞的增生率总体比较差异有统计学意义(F=39.490,P<0.001),其中2 μmol/L和5 μmol/L CY-09处理细胞的增生率与0 μmol/L CY-09处理细胞比较差异均无统计学意义(均P>0.05);10、15和20 μmol/L CY-09处理细胞的增生率明显高于0 μmol/L CY-09,差异均有统计学意义(均P<0.05)(表1)。15 μmol/L CY-09处理细胞的增生值达到高糖组峰值且该浓度对正常细胞增生率无明显影响。因此,确定15 μmol/L CY-09为实验组后续干预浓度。

图2 正常对照组和高糖组培养后48 h RPE细胞形态(×100,标尺=100 μm) A:正常对照组细胞形态多呈较为饱满的多边形,相邻细胞呈聚集状态 B:高糖组细胞呈低密度散在分布Figure 2 Morphology of RPE cells after 48-hour culture in the two groups (×100,bar=100 μm) A:Cells were full polygons in shape and gathered in clusters in the normal control group B:Cells were scatteredly distributed with low density in the high-glucose group

表1 正常对照组和高糖组不同浓度CY-09处理细胞增生率比较(mean±SD,%)Table 1 Comparison of proliferation rate of cells among different concentrations of CY-09 treatment in the two groups (mean±SD,%)不同浓度CY-09样本量正常对照组细胞增生率高糖组细胞增生率0 μmol/L3100.00±1.9866.50±1.562 μmol/L3100.28±2.3967.78±1.735 μmol/L399.86±1.5570.78±0.5310 μmol/L399.33±2.6379.51±2.53a15 μmol/L395.14±2.6587.90±2.08a20 μmol/L390.43±1.43a79.36±2.17aF值6.72939.490P值0.003 <0.001 注:与各自组内0 μmol/L CY-09处理比较,aP<0.05(单因素方差分析,LSD-t检验) Note:Compared with the respective 0 μmol/L CY-09 treatment,aP<0.05 (One-way ANOVA,LSD-t test)
2.3 各组细胞NLRP3炎症小体相关蛋白表达比较
正常对照组、正常+CY-09组、高糖组和高糖+CY-09组NLRP3、ASC、活化Caspase-1(cleaved-Caspase-1,相对分子质量为20 000)蛋白相对表达量总体比较差异均有统计学意义(F=158.700、172.100、135.100,均P<0.05)。Caspase-1前体(pro-Caspase-1,相对分子质量为45 000)相对表达量总体比较,差异无统计学意义(F=0.195,P=0.897)。正常+CY-09组NLRP3和ASC蛋白相对表达量明显低于正常对照组,高糖组NLRP3、ASC和cleaved-Caspase-1相对表达量明显高于正常对照组和高糖+CY-09组差异均有统计学意义(均P<0.05)(图3,表2)。
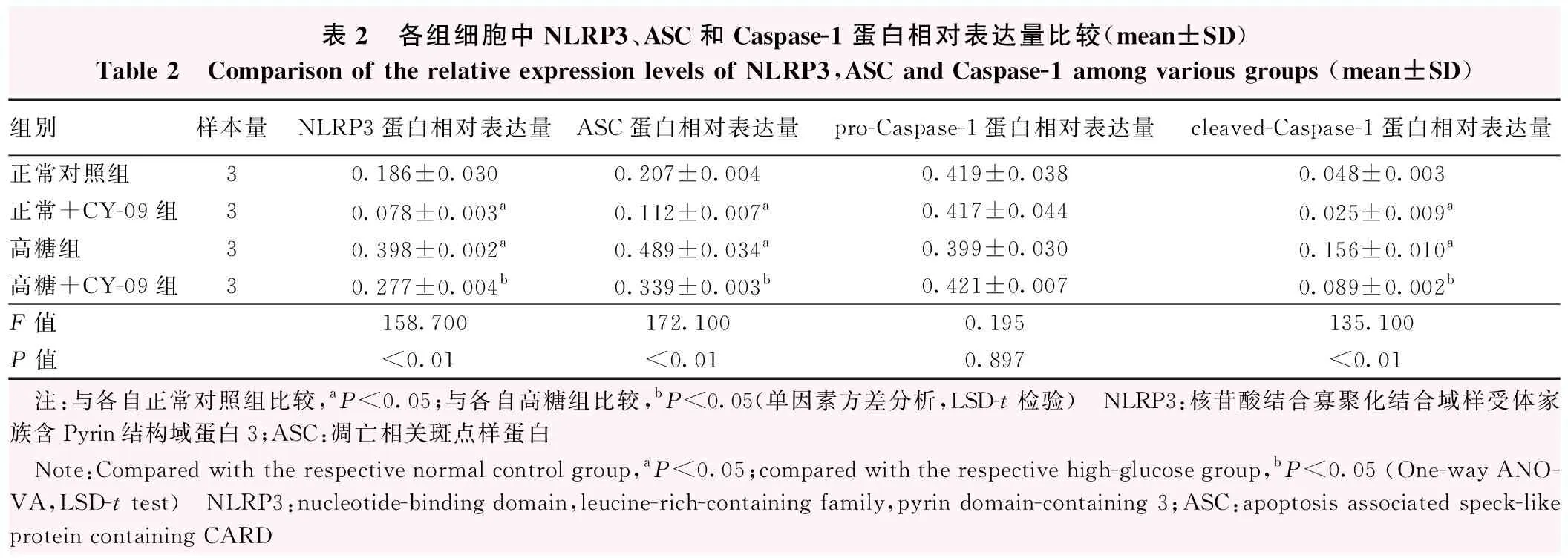
表2 各组细胞中NLRP3、ASC和Caspase-1蛋白相对表达量比较(mean±SD)Table 2 Comparison of the relative expression levels of NLRP3,ASC and Caspase-1 among various groups (mean±SD)组别样本量NLRP3蛋白相对表达量ASC蛋白相对表达量pro-Caspase-1蛋白相对表达量cleaved-Caspase-1蛋白相对表达量正常对照组30.186±0.0300.207±0.0040.419±0.0380.048±0.003正常+CY-09组30.078±0.003a0.112±0.007 a0.417±0.0440.025±0.009 a高糖组30.398±0.002 a0.489±0.034 a0.399±0.0300.156±0.010 a高糖+CY-09组30.277±0.004b0.339±0.003 b0.421±0.0070.089±0.002bF值158.700172.1000.195135.100P值<0.01<0.010.897<0.01 注:与各自正常对照组比较,aP<0.05;与各自高糖组比较,bP<0.05(单因素方差分析,LSD-t检验) NLRP3:核苷酸结合寡聚化结合域样受体家族含Pyrin结构域蛋白3;ASC:凋亡相关斑点样蛋白 Note:Compared with the respective normal control group,aP<0.05;compared with the respective high-glucose group,bP<0.05 (One-way ANO-VA,LSD-t test) NLRP3:nucleotide-binding domain,leucine-rich-containing family,pyrin domain-containing 3;ASC:apoptosis associated speck-like protein containing CARD

图3 各组RPE细胞内炎症小体NLRP3、ASC和Caspase-1蛋白表达电泳图 正常+CY-09组NLRP3、ASC和cleaved-Caspase-1蛋白条带灰度弱于正常对照组,高糖组NLRP3、ASC、cleaved-Caspase-1蛋白条带灰度强于正常对照组和高糖+CY-09组;pro-Caspase-1蛋白条带灰度在各组间无明显差异 1:正常对照组;2:正常+CY-09组;3:高糖组;4:高糖+CY-09组 NLRP3:核苷酸结合寡聚化结构域样受体家族含Pryrin结构域蛋白3;ASC:凋亡相关斑点样蛋白;GAPDH:磷酸甘油醛脱氢酶Figure 3 Electrophoretogram of NLRP3,ASC and Caspase-1 in different groups detected by Western blot Compared with the normal control group,the intensity of NLRP3,ASC and cleaved-Caspase-1 bands was decreased in normal+CY-09 group.Compared with the high-glucose group,the intensity of NLRP3,ASC and cleaved-Caspase-1 bands was decreased in the normol control group and the high-glucose+CY-09 group.The intensity of pro-Caspase-1 bands was not significantly different among various groups 1:normal control group;2:normal+CY-09 group;3:high-glucose group;4:high-glucose+CY-09 group NLRP3:nucleotide-binding domain,leucine-rich-containing family,pyrin domain-containing 3;ASC:apoptosis associated speck-like protein containing CARD;GAPDH:glyceraldehyde 3-phosphate dehydrogenase
2.4 各组细胞凋亡率比较
正常对照组、正常+CY-09组、高糖组、高糖+CY-09组细胞凋亡率分别为(6.67±1.05)%、(5.12±0.19)%、(21.68±0.41)%和(13.96±0.07)%,总体比较差异有统计学意义(F=346.300,P<0.05),其中高糖组细胞凋亡率明显高于正常对照组和高糖+CY-09组,差异均有统计学意义(均P<0.05);正常+CY-09组细胞凋亡率略低于正常对照组,差异无统计学意义(P>0.05)(图4)。

图4 各组细胞凋亡情况 A:各组细胞凋亡流式细胞检测图 B:各组细胞凋亡率比较 F=346.300,P<0.05. 与正常对照组比较,aP<0.05;与高糖组比较,bP<0.05(单因素方差分析,LSD-t检验,n=3) 1:正常对照组;2:正常+CY-09组;3:高糖组;4:高糖+CY-09组Figure 4 Apoptosis of the RPE cells in various groups A:Flow cytometry results of various groups B:Comparison of the apoptosis rate among various groups F=346.300,P<0.05. Compared with the normal control group,aP<0.05;compared with the high-glucose group,bP<0.05 (One-way ANOVA,LSD-t test,n=3) 1:normal control group;2:normal+CY-09 group;3:high-glucose group;4:high-glucose+CY-09 group
2.5 各组细胞Bax、Bcl-2及Caspase-3蛋白表达比较
正常对照组、正常+CY-09组、高糖组和高糖+CY-09组间细胞cleaved-Caspase-3、Bax和Bcl-2蛋白相对表达量总体比较,差异均有统计学意义(F=85.930、239.200、332.200,均P<0.01),各组间pro-Caspase-3蛋白相对表达量总体比较,差异无统计学意义(F=0.525,P=0.677)。正常+CY-09组Bax及cleaved-Caspase-3蛋白相对表达量低于正常对照组,Bcl-2蛋白相对表达量高于正常对照组,差异均有统计学意义(均P<0.05);高糖组Bax及cleaved-Caspase-3蛋白相对表达量高于正常对照组和高糖组+CY-09组,Bcl-2蛋白相对表达量低于正常对照组和高糖组+CY-09组,差异均有统计学意义(均P<0.05)(图5,表3)。

表3 各组细胞中Caspase-3、Bax和Bcl-2蛋白相对表达量比较(mean±SD)Table 3 Comparison of the relative expression levels of Caspase-3,Bax and Bcl-2 proteins among various groups (mean±SD)组别样本量pro-Caspase-3相对表达量cleaved-Caspase-3相对表达量Bax蛋白相对表达量Bcl-2蛋白相对表达量正常对照组30.604±0.0250.083±0.0050.301±0.0280.100±0.001正常+CY-09组30.617±0.0130.051±0.006a0.123±0.006 a0.244±0.006 a高糖组30.613±0.0120.190±0.011a0.685±0.022 a0.050±0.004 a高糖+CY-09组30.598±0.0100.137±0.011b0.572±0.029 b0.174±0.010 bF值0.52585.930239.200332.200P值0.677<0.01<0.01<0.01 注:与正常对照组比较,aP<0.05;与高糖组比较,bP<0.05(单因素方差分析,LSD-t检验) Bax:Bcl相关X蛋白;Bcl-2:B淋巴细胞瘤因子-2 Note:Compared with the normal control group,aP<0.05;compared with the high-glucose group,bP<0.05 (One-way ANOVA,LSD-t test) Bax:Bcl-2 associated X protein;Bcl-2:B cell lym-phoma factor-2
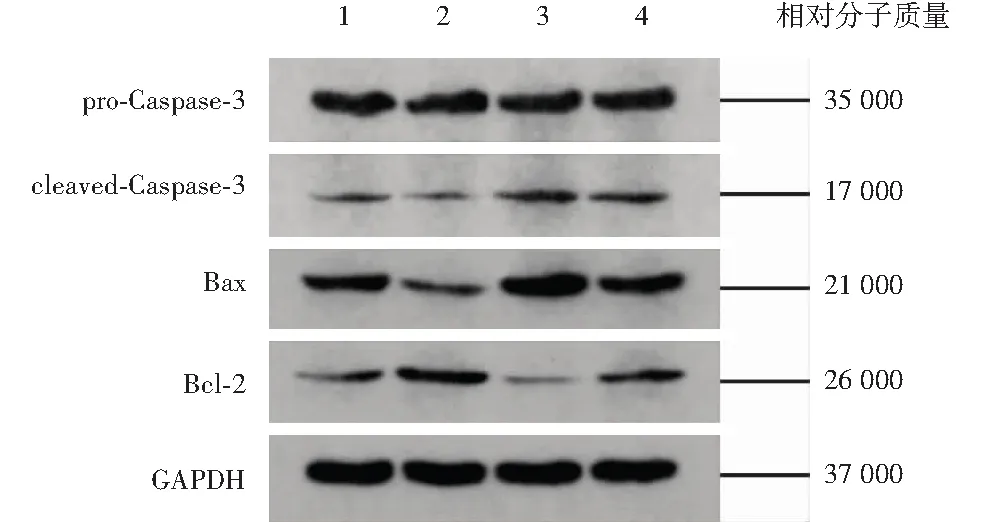
图5 各组细胞凋亡相关蛋白Bax、Bcl-2、Caspase-3表达电泳图 正常+CY-09组cleaved-Caspase-3和Bax蛋白条带灰度弱于正常对照组,Bcl-2蛋白条带灰度强于正常对照组;高糖组cleaved-Caspase-3和Bax蛋白条带灰度强于正常对照组和高糖组+CY-09组,Bcl-2蛋白条带灰度弱于正常对照组和高糖组+CY-09组;pro-Caspase-3蛋白条带灰度在各组间无明显差异 1:正常对照组;2:正常+CY-09组;3:高糖组;4:高糖+CY-09组 Bax:Bcl相关X蛋白;Bcl-2:B淋巴细胞瘤;GAPDH:磷酸甘油醛脱氢酶Figure 5 Electrophoretogram of Bax,Bcl-2 and Caspase-3 in different groups detected by Western blot Compared with the normal control group,the intensity of cleaved-Caspase-3 and Bax bands was decreased and the intensity of Bcl-2 band was increased in normal+CY-09 group.Compared with the high-glucose group,the intensity of cleaved-Caspase-3 and Bax bands was decreased and the intensity of Bcl-2 band was increased in the normal control group and the high-glucose+CY-09 group;the intensity of pro-Caspase-3 bands was not significantly different among various groups 1:normal control group;2:normal+CY-09 group;3:high-glucose group;4:high-glucose+CY-09 group Bax:Bcl-2 associated X protein;Bcl-2:B cell lymphoma-2;GAPDH:glyceraldehyde 3-phosphate dehydrogenase
3 讨论
高糖环境可激活RPE细胞内氧化应激反应,产生大量ROS,造成细胞毒性损伤,或直接通过损伤线粒体造成RPE细胞凋亡[7-8]。RPE细胞凋亡可影响ROS的清除及PEDF等活性因子的分泌,有可能促进DR的发生和发展。本研究采用高糖诱导RPE细胞氧化损伤模型,也发现高糖条件下RPE细胞中ROS含量和脂质过氧化物MDA浓度均升高,SOD活力值降低,细胞的增生受到明显抑制,证实了高糖能诱导RPE细胞发生氧化应激,抑制细胞增生。本研究结果还显示,高糖组中10、15和20 μmol/L CY-09处理细胞的增生率明显高于0 μmol/L CY-09处理细胞,推测NLRP3参与高糖环境下RPE细胞增生调控。
高糖环境下线粒体发生氧化应激,引起细胞内NLRP3介导的信号通路激活[9]。NLRP3炎症小体是由NLRP3、接头蛋白ASC和蛋白酶pro-Caspase-1组成的多蛋白复合物。Pro-Caspase-1被激活后自剪切形成的cleaved-Caspase-1介导白细胞介素(interleukin,IL)-1β和IL-18等促炎因子的分泌[10-11];NLRP3炎症小体也可以通过激活Caspase-3引起细胞凋亡[12]。Wang等[13]在增生性玻璃体疾病患者的玻璃体液中发现NLPR3、ASC、Caspase-1及其他炎症因子显著高表达,而且NLRP3炎症小体可以诱导体外培养的人视网膜微血管内皮细胞发生凋亡。
细胞凋亡是一个极其复杂的生命活动过程,涉及多种凋亡通路。Bcl-2蛋白通过阻止细胞色素C从线粒体释放来抑制细胞凋亡,Bax通过与线粒体上的膜通道结合促使细胞色素C释放而促进凋亡[14]。Caspase-3在细胞凋亡的级联反应途径中位于核心位置,是执行细胞凋亡的关键因子[15-16]。王卫等[12]研究发现,下调肾小管上皮细胞中NLRP3表达水平可以抑制高糖诱导的细胞凋亡。本研究结果显示,与正常对照组比较,高糖组RPE细胞凋亡率、炎症小体相关蛋白、Bax和Caspase-3蛋白表达均明显升高,而Bcl-2蛋白表达明显下降;正常+CY-09组与正常对照组相比,高糖+CY-09组与高糖组相比,RPE细胞凋亡率下降,NLRP3、ASC、cleaved-Caspase-1、Bax和cleaved-Caspase-3表达均降低,Bcl-2的表达则上调。以上结果充分显示高糖环境可激活炎症小体NLRP3,引起RPE细胞凋亡。
综上所述,本研究证实高糖环境可提高RPE细胞内ROS含量和MDA浓度,抑制RPE细胞增生并促进其凋亡;NLRP3抑制剂可提高高糖环境下RPE细胞的增生率并抑制其凋亡,推测NLRP3炎症小体参与了高糖条件下RPE细胞的凋亡过程。然而,本研究尚未明确NLRP3炎症小体通路与细胞凋亡之间的直接关系;未进行IL等下游分子的检测;仅为体外细胞学研究,尚需进一步开展实验动物研究。我们需进一步探讨NLRP3炎症小体与细胞凋亡的分子机制,为预防和治疗DR提供潜在的靶向目标。
利益冲突所有作者均声明不存在任何利益冲突
