Jagged1在增生性糖尿病视网膜病变纤维血管膜中的表达及其意义
2022-02-23郭庆敏孟旭霞杨堃余川
郭庆敏 孟旭霞 杨堃 余川
1青岛大学附属医院眼科 266000;2青岛大学附属医院中心实验室 266000;3郑州大学第一附属医院眼科 450052
郭庆敏现在河北省眼科医院 河北省眼科学重点实验室 河北省眼部疾病临床医学研究中心,邢台054001
Notch信号通路是一条进化上高度保守、通过调节细胞间相互作用来调控细胞命运的信号通路[1]。Notch的配体Delta样配体4(Delta-like 4,Dll4)和Jagged1主要表达于血管内皮细胞,并在血管发育中发挥重要作用[2]。有研究证实Jagged1不仅能促进肿瘤血管生成,还可通过拮抗Dll4/Notch信号通路发挥较强的血管生成调节作用[3-6]。增生性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)是以眼底新生血管形成为主要病理改变的眼底病变,Jagged1是否参与人类PDR新生血管的发生尚不清楚。本研究拟检测PDR患眼纤维血管膜病理标本中Jagged1、Dll4和Notch1的表达,探讨Jagged1在PDR新生血管形成中的作用及其与Dll4/Notch信号通路的关系。
1 材料与方法
1.1 材料
1.1.1标本来源及分组 于2014年7月至2015年7月收集在青岛大学附属医院眼科行睫状体扁平部23G标准三通道玻璃体切割手术的PDR患者57例60眼术中纤维血管膜标本,其中男32例34眼,女25例26眼;年龄36~73岁,平均(54.93±6.42)岁;糖尿病病程8~20年,平均(15.72±3.51)年。所有患者均符合2型糖尿病诊断标准及PDR诊断标准[7-8]。排除标准:肺部疾病、严重肝肾功能不全、心脑血管病变、恶性肿瘤及自身免疫性疾病患者。根据术前是否行抗血管内皮生长因子(vascular endothelial growth factor,VEGF)药物玻璃体内注射将标本分为未注药组30例32眼和注药组27例28眼,各组年龄和性别构成比差异均无统计学意义(t=4.642、3.964,均P>0.05),注药组于玻璃体切割术前2~7 d行雷珠单抗玻璃体内注射。同期选取特发性黄斑前膜患者18例18眼术中黄斑前膜标本作为对照组,排除标准:(1)有糖尿病及糖尿病家族史者;(2)有眼部及全身感染、急性炎症反应及缺血缺氧性疾病史以及全身系统性疾病者。本实验中未注药组和注药组患者控制血糖的全身用药种类相同或相似,且均无其他全身用药;所有患者术前均采用相同的质量浓度0.5%左氧氟沙星滴眼液(日本参天制药有限公司)点眼清洁结膜囊,减轻眼部炎症反应,以确保组间患者基线资料均衡。本研究经青岛大学附属医院伦理审查委员会审查批准(批文号:QYFYWZLL25645),所有患者或其家属术前均签署知情同意书。
1.1.2主要试剂及仪器 兔抗Notch1(ab52627,英国Abcam公司);鼠抗Dll4(A00875-1)、兔抗Jagged1(A00901-4)、生物素标记羊抗兔IgG(BA1003)(武汉博士德生物工程有限公司)。手术显微镜(VISU200p,德国Carl Zeiss公司);Constellation玻璃体切割机(美国Alcon公司);高速离心机(Allegra X-22,美国Beckman公司);微量移液器(P4608-200°,美国Labnet公司);荧光定量PCR系统(Light Cycler 96,罗氏诊断产品有限公司);光学显微镜(DM6B)、石蜡切片机(RM2235)(德国Leica公司);紫外分光光度计(DR6000,美国哈希公司)。
1.2 方法
1.2.1组织病理学染色观察各组标本结构特征 取未注药组新鲜标本10个、注药组新鲜标本12个和对照组标本8个,置于质量浓度4%多聚甲醛溶液中固定5 h,无水乙醇脱水,二甲苯透明,浸蜡包埋,沿标本最大截面处行3 μm厚连续切片,行常规苏木精-伊红染色,于光学显微镜下观察标本的组织结构。
1.2.2免疫组织化学染色法检测各组标本中Jagged1、Dll4和Notch1蛋白表达 选取1.2.1部分的石蜡切片,每个病理标本选取截面最大处连续切片15张,各选取5张按照免疫组织化学试剂盒操作步骤进行Jagged1、Dll4和Notch1蛋白的免疫组织化学染色。具体步骤为将3 μm厚组织切片置于60 ℃恒温烤片箱中烤片1 h;将切片浸于二甲苯Ⅰ、二甲苯Ⅱ中各5 min进行脱蜡,梯度乙醇进行水化和除去二甲苯,自来水冲洗,0.01 mol/L磷酸盐缓冲液(phosphate buffered solution,PBS)冲洗2次,每次5 min;滴加体积分数3% H2O2室温孵育10 min,0.01 mol/L PBS冲洗3次,每次5 min;滴加抗原修复液,室温孵育10 min,0.01 mol/L PBS冲洗3次,每次5 min;滴加山羊血清封闭液,37 ℃恒温水浴箱内孵育20 min,甩去多余液体;滴加稀释后的Jagged1、Dll4和Notch1一抗(均1∶ 100稀释),37 ℃恒温箱内孵育2.5 h。0.01 mol/L PBS冲洗3次,每次5 min;滴加生物素标记二抗(1∶ 50稀释),室温孵育15 min。0.01 mol/L PBS冲洗3次,每次5 min;滴加辣根过氧化物酶标记链霉卵白素,37 ℃恒温箱中孵育20 min,0.01 mol/L PBS冲洗3次,每次5 min;二氨基联苯胺(diaminobenzidine,DAB)显色3 min,PBS代替一抗作为阴性对照。细胞质内出现黄色、棕黄色或棕褐色颗粒为阳性表达。采用Image pro plus 6.0软件计算每张切片中阳性染色区域的平均吸光度(A)值,以各组病理标本中蛋白表达的平均值作为相应蛋白的表达量。
1.2.3实时荧光定量PCR法测定标本中Jagged1、Dll4和Notch1 mRNA的表达 分别取未注药组标本22个、注药组标本16个和对照组标本10个,置于消毒的离心管中,-80 ℃超低温冰箱中冻存。取50~100 mg标本置于玻璃管中,加入1 ml RNAiso plus裂解液,提取总RNA,采用紫外分光光度计检测其质量浓度和纯度,取A260/A280为1.7~2.1的样本用于后续实验。将提取的RNA逆转录成cDNA,采用双链嵌合荧光染色法扩增相应基因。引物序列由北京六合华大基因科技有限公司合成。Jagged1引物:正向5’-AACTGGTACCGGTGCGAA-3’,反向5’-TGATGCAAGA TCTCCCTGAAAC-3’;Dll4引物:正向5’-CCCTGGC AATGTACTTGTGAT-3’,反向5’-TGGTGGGTGCAGTA GTTGAG-3;Notch1引物:正向5’-GTCAACGCCGTAG ATGACC-3’,反向5’-TTGTTAGCCCCGTTCTTCAG-3’;磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)引物:正向5’-CACGATGGA GGGGCCGGACTCATC-3’,反向5’-TAAAGACCTCTA TGCCAACACAGT-3’。PCR反应条件:95 ℃预变性30 s;95 ℃变性3 s,60 ℃退火及延伸30 s,共40个循环。以GAPDH作为内参基因,采用2-ΔΔCt法计算各目的基因相对表达量。
1.3 统计学方法
采用SPSS 19.0统计学软件进行统计分析。计量资料数据经Kolmogoror-Smimor检验证实呈正态分布,以mean±SD表示。未注药组、注药组和对照组标本间Jagged1、Dll4和Notch1蛋白及mRNA相对表达量差异比较采用单因素方差分析,组间两两比较采用LSD-t检验。PDR纤维血管膜标本中Jagged1 mRNA相对表达量与Dll4和Notch1 mRNA表达量关系评估采用Pearson线性相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组标本中组织病理学表现
光学显微镜下可见PDR纤维血管膜中新生血管生成,注药组纤维血管膜中血管管腔狭窄,部分管腔闭合;未注药组纤维血管膜中血管管腔充盈,且形态较完整;对照组黄斑前膜组织疏密均匀,未见新生血管结构(图1)。

图1 各组病理标本中新生血管情况(HE ×100,标尺=100 μm) A:未注药组纤维血管膜中可见新生血管管腔充盈(箭头) B:注药组纤维血管膜中血管管腔狭窄(箭头) C:对照组黄斑前膜中未见新生血管Figure 1 Neovascularization in pathological specimens of each group(HE ×100,bar=100 μm) A:Dilated lumen (arrow) of new blood vessels was found in fibrovascular membranes of the non-injection group B:Narrow lumen (arrow) of new blood vessels was found in fibrovascular membranes of the injection group C:No neovascularization was found in macular epiretinal membranes of the control group
2.2 未注药组与注药组标本中Jagged1、Dll4和Notch1蛋白的表达比较
未注药组10个标本血管内皮细胞中Jagged1、Dll4和Notch1蛋白表达均呈强阳性,主要表达在细胞质中,阳性细胞主要位于新生血管内皮组织,而非血管内皮部位的阳性染色考虑主要在切片及标本制作过程中,部分血管内皮细胞被牵拉移位至血管外部位所致;注药组12个标本血管内皮细胞中Jagged1、Dll4和Notch1蛋白表达均呈弱阳性(图2)。未注药组纤维血管膜病例标本中Jagged1、Dll4和Notch1蛋白阳性区域平均A值明显高于注药组,差异均有统计学意义(t=5.168,P=0.014;t=6.012,P=0.008;t=3.453,P=0.030)(表1)。

图2 未注药组及注药组纤维血管膜病理标本中Jagged1、Dll4和Notch1蛋白免疫组织化学染色图(DAB ×400,标尺=50 μm) 未注药组纤维血管膜中Jagged1、Dll4和Notch1蛋白均呈强阳性表达,注药组纤维血管膜中各蛋白表达减弱 箭头所示为染色阳性细胞Figure 2 Immunohistochemical staining images of Jagged1,Dll4 and Notch1 proteins in specimens of the two groups(DAB ×400,bar=50 μm) Strong positive expression of Jagged1,Dll4 and Notch1 proteins could be seen in the non-injection group,and attenuated expression of the three proteins was found in the injection group Arrows indicated the positively stained cells

表1 未注药组与注药组Jagged1、Dll4和Notch1蛋白免疫组织化学阳性染色平均A值比较(mean±SD)Table 1 Comparison of the average absorbance value of Jagged1,Dll4 and Notch1 between the two groups (mean±SD)组别样本量阳性染色A值Jagged1Dll4Notch1未注药组106.25±1.826.87±1.895.12±2.14注药组121.46±0.371.55±0.241.32±0.53t值5.1686.0123.453P值0.0140.0080.030 注:(独立样本t检验) Dll4:Delta样配体4 Note:(Independent samples t-test) Dll4:Delta-like 4
2.3 各组标本Jagged1、Dll4和Notch1 mRNA的表达比较
对照组、注药组和未注药组标本中Jagged1、Dll4和Notch1 mRNA相对表达量总体比较差异均有统计学意义(F=77.337、62.305、51.869,均P<0.01);其中,未注药组和注药组标本中Jagged1、Dll4和Notch1 mRNA相对表达量明显高于对照组,注药组Jagged1、Dll4和Notch1 mRNA相对表达量明显低于未注药组,差异均有统计学意义(均P<0.05)(表2)。

表2 各组Jagged1、Dll4和Notch1 mRNA相对表达量比较(mean±SD)Table 2 Comparison of the relative expression levels of Jagged1,Dll4 and Notch1 mRNA among the three groups (mean±SD)组别样本量各基因mRNA相对表达量Jagged1Dll4Notch1对照组101.89±0.182.20±0.751.24±0.17未注药组2221.33±2.22a38.85±11.34a9.91±2.33a注药组167.56±0.49ab10.24±1.36ab4.67±1.19abF值77.33762.30551.869P值<0.01<0.01<0.01 注:与对照组比较,aP<0.05;与未注药组比较,bP<0.05(单因素方差分析,LSD-t检验) Dll4:Delta样配体4 Note:Compared with the control group, aP<0.05;compared with the non-injection group, bP<0.05 (One-way ANOVA,LSD-t test) Dll4:Delta-like 4
2.4 PDR患者纤维血管膜标本中Jagged1与Dll4 mRNA和Notch1 mRNA相对表达量的相关性
所有PDR患者纤维血管膜标本中Jagged1 mRNA相对表达量与Dll4和Notch1 mRNA相对表达量均呈显著正相关,差异均有统计学意义(r=0.925、0.950,均P<0.05)(图3)。
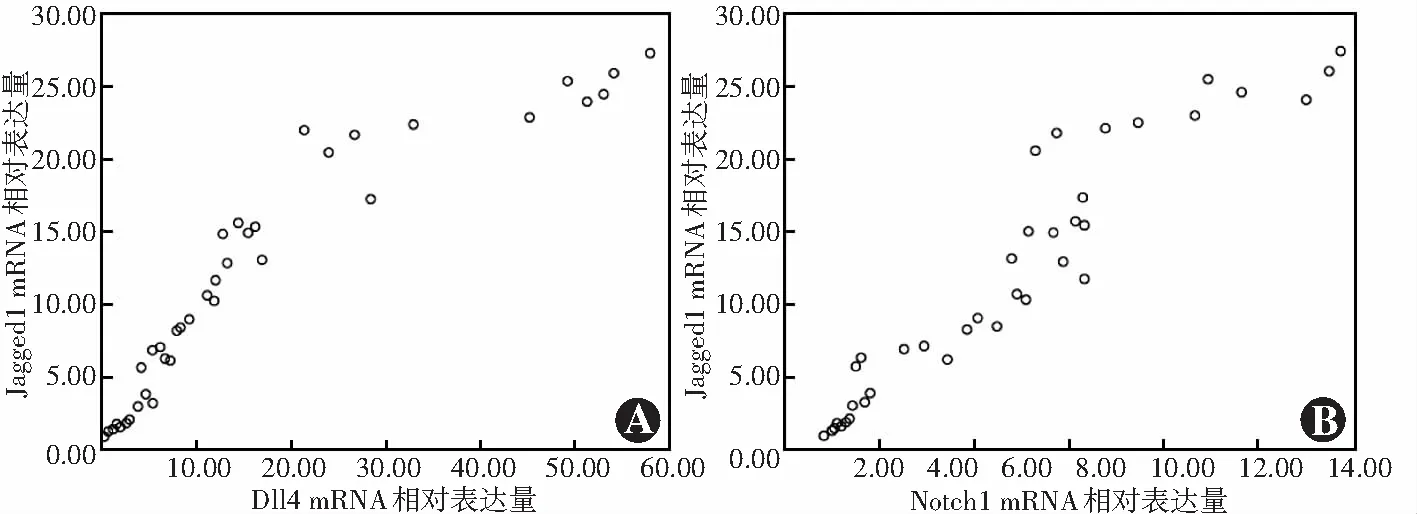
图3 PDR患者纤维血管膜标本中Jagged1与Dll4和Notch1 mRNA相对表达量相关分析散点图(Pearson线性相关分析,n=38) A:Jagged1 mRNA相对表达量与Dll4 mRNA相对表达量呈显著正相关(r=0.925,P<0.05) B:Jagged1 mRNA相对表达量与Notch1 mRNA相对表达量呈显著正相关(r=0.950,P<0.05) Dll4:Delta样配体4Figure 3 Scatter diagram of the relative expression levels of Jagged1,Dll4 and Notch1 mRNA in fibrovascular membrane specimens from PDR patients(Pearson linear correlation analysis,n=38) A:The relative expression level of Jagged1 mRNA was positively correlated with that of Dll4 mRNA (r=0.925,P<0.05) B:The relative expression level of Jagged1 mRNA was positively correlated with that of Notch1 mRNA (r=0.950,P<0.05) Dll4:Delta-like 4
3 讨论
糖尿病是一种常见的慢性疾病,约有70%的患者会并发全身小血管和微血管病变,其中糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病常见的眼底微血管并发症[9-10]。PDR可继发玻璃体反复积血、纤维增生,继而形成纤维条索,甚至出现牵拉性视网膜脱离,严重者可致盲[11]。
作为Notch信号通路的配体之一,Jagged1主要表达于血管内皮细胞,参与血管的生成和发育,其基因突变将导致Alagile综合征,表现为严重的血管缺陷[12],而卵巢癌及三阴乳腺癌的血管形成与Jagged1的表达上调密切相关[13-15]。Guo等[16]对2型糖尿病模型大鼠进行研究发现,缺氧可通过激活Jagged1-Notch1信号通路诱导脑部新生血管生成;而Zhao等[17]研究发现,细胞色素P450 2J2可通过激活Jagged1/Notch1信号通路促进心肌血管形成,进而改善心衰患者的心功能状况。本研究结果显示,Jagged1在PDR患者纤维血管膜中的表达显著高于对照组,考虑可能由于黄斑前膜组织无新生血管的形成和出芽,而注药组由于玻璃体内注射抗VEGF药物,造成部分视网膜新生血管消退萎缩,因此其Jagged1表达量较未注药组低。此外,本研究结果显示Jagged1与Notch1 mRNA相对表达量呈显著正相关,推测Jagged1与Notch1联合发挥调控新生血管生成的作用。
有研究证实,Jagged1可促进血管增生,增加新生血管数量,Dll4则抑制无功能血管的过度增生,使其功能成熟,二者相互拮抗,并保持动态平衡,共同促进血管正常生长发育,以保证血液循环系统的有效建立[3,18]。同时,有研究发现,Jagged1可作用于Dll4/Notch1信号通路下游,激活相邻细胞Notch3受体,参与平滑肌细胞分化过程并调节血管成熟;而内皮细胞特异性敲除Jagged1基因可导致血管平滑肌细胞分化障碍[19-20]。史少阳等[21]研究发现,Dll4在视网膜新生血管形成的过程中发挥重要作用,并可能通过对VEGFR的反馈抑制发挥抑制病理性新生血管过度形成的作用。而本研究结果显示,注药组患眼纤维血管膜组织Jagged1和Dll4 mRNA及蛋白的表达量均低于未注药组,且PDR患眼纤维血管膜组织中Jagged1 mRNA与Dll4 mRNA表达呈正相关;Jagged1与Dll4蛋白阳性表达部位大体一致,均主要表达于血管内皮组织,推测Jagged1与Dll4相互调节、相互制约,共同调节PDR新生血管的形成。同时,本研究结果显示,对照组黄斑前膜组织中无新生血管形成,Jagged1和Dll4蛋白及mRNA表达量也明显降低,推测二者在促进病理性新生血管的发生和成熟过程中发挥一定作用。
本课题组前期研究发现,糖尿病模型大鼠视网膜中VEGF与Dll4和Notch1表达量均呈显著正相关[22];结合本研究中Jagged1与Dll4和Notch1的相关性,推测VEGF与Jagged1的表达同样呈正相关。后续我们将继续探索其他相邻组织中VEGF等相关因子的表达,进一步评估其与Jagged1表达的相关性。
综上所述,本研究结果表明Jagged1可能参与PDR病理性新生血管的形成与发育过程,并可能与Dll4/Notch1信号通路相互制约与调控。本研究入组标本较少,免疫组织化学染色过程中发现部分阳性表达蛋白位于血管内皮细胞之外,且在血管新生过程中,Jagged1与Dll4的表达并非完全同步。因此,未来我们将进一步行大样本临床试验,采用免疫荧光双标法确定细胞性质,并分析不同阶段Jagged1与Dll4表达的相关性,以更准确地评估Jagged1在PDR病变组织中的表达及作用,为临床预防和治疗PDR提供新的思路和靶点。
利益冲突所有作者均声明不存在利益冲突
