大鼠非动脉炎性前部缺血性视神经病变模型视神经蛋白质组学分析
2022-02-23胡立影李志清邵先锋郭小雪于大为东莉洁李筱荣
胡立影 李志清 邵先锋 郭小雪 于大为 东莉洁 李筱荣
天津医科大学眼科医院 天津医科大学眼视光学院 天津医科大学眼科研究所 国家眼耳鼻喉疾病临床医学研究中心天津市分中心 天津市视网膜功能与疾病重点实验室 300384
非动脉炎性前部缺血性视神经病变(non-arteritic anterior ischemic optic neuropathy,NAION)是临床上常见的视神经病变之一,发病率仅次于青光眼,可引起患者视野缺损及视力下降,从而影响患者的生活质量[1]。NAION早期可表现为视盘充血、水肿,随着病程进展,出现视网膜神经节细胞(retinal ganglion cells,RGC)和轴突丢失,最终导致视神经萎缩[2]。一旦视神经萎缩,患者视功能将发生不可逆改变。然而目前尚缺乏视神经萎缩的有效治疗方法。因此,若能在视神经萎缩发生前找到相关治疗靶点,将有可能避免视神经萎缩的发生,或减轻视神经萎缩的程度。蛋白组是机体产生或修饰的整套蛋白质,会随着机体的状态变化而发生变化[3]。蛋白质组学用于探讨生物体内蛋白质的组成及变化,可真实反映生理及病理条件下的细胞功能,为疾病各阶段的纵向研究、相关疾病间的横向比较、疾病发生的分子标志物及治疗靶点的寻找提供重要理论依据[4]。同位素标记相对和绝对定量(isobaric tag for relative and absolute quantification,iTRAQ)采用高通量筛选技术,具有良好的精确度及可信度,是一种常用的定量蛋白质组学技术。近年来,蛋白质组学技术已逐步应用到眼科疾病的研究中,如糖尿病视网膜病变、黄斑变性、青光眼、白内障、葡萄膜炎和角膜病变等[5-10]。目前尚缺乏关于NAION的蛋白质组学相关研究报道。鉴于动物疾病模型在研究疾病发病机制方面具有重要作用,目前NAION的人类视神经检测标本无法获取,而且动物模型通常可以在较短时间内建立以模拟人类相关疾病的病理过程,动物模型的组织标本容易获得,蛋白组学在疾病动物模型方面的研究非常多,为人类NAION的发病机制和治疗靶点研究提供了可行的途径。本研究拟建立大鼠NAION模型,利用iTRAQ标记结合液相质谱-串联质谱检测(liquid chromatograph-mass spectrometer and mass spectrometer,LC-MS/MS)对NAION模型大鼠视神经整体蛋白进行分析,筛选差异蛋白,为NAION的基础研究及治疗靶点的选择提供理论依据。
1 材料与方法
1.1 材料
1.1.1实验动物 健康、无眼部疾病的8周龄雄性SPF级SD大鼠14只,购于中国食品药品检定研究院,体质量200~250 g。所有大鼠均置于同一20~22 ℃鼠舍,正常昼夜节律,自由饮食、饮水。实验动物的饲养和使用遵循国家科学技术委员会《实验动物管理条例》的规定,本研究经天津医科大学眼科医院动物伦理委员会审核批准(批文号:TJYY2021041029)。
1.1.2主要试剂及仪器 孟加拉玫瑰红(rose Bengal,RB)(美国Sigma公司);水合氯醛、复方托吡卡胺滴眼液、荧光素钠注射液(美国Alcon公司);BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司)。眼底荧光造影仪(德国海德堡公司);Infinite M200型酶标仪(瑞士Tecan公司);532激光机(美国科医人公司);ekspert nanoLC 415液相色谱仪、Triple TOF 6600质谱仪(美国AB SCIEX公司)。
1.2 方法
1.2.1大鼠NAION模型的建立及分组处理 取10只大鼠采用RB联合激光光动力方法建立单眼NAION模型[11]。将大鼠腹腔内注射质量浓度10%水合氯醛(0.35 ml/100 g)进行麻醉,复方托吡卡胺滴眼液点右眼扩瞳后置于532激光机前,按照1 ml/kg剂量经鼠尾静脉注入2.5 mmol/L RB溶液,立即用激光照射视盘上方2/3(激光参数:波长532 nm,能量50 mW,光斑直径500 μm,照射时间12 s);造模后3 d在裂隙灯显微镜及眼底前置镜下观察模型眼眼底,并行荧光素眼底血管造影(fluorescein fundus angiography,FFA)以进一步确保NAION模型组大鼠视盘水肿形成,具体方法为大鼠腹腔内注射麻醉后置于造影机上,鼠尾静脉注射0.1 ml荧光素钠注射液,将造影镜头对准视盘,早期为动态录像,后期逐个象限拍摄中周部视网膜,5 min后再次拍摄视盘,若FFA图像上出现视盘荧光素钠渗漏则认为视盘水肿存在,并排除模型建立过程中造成的其他眼部病变,如眼底出血(1只)和视网膜脱离(1只)。最终造模成功的大鼠共8只,任意选取4只大鼠作为NAION模型组。另取4只体质量和周龄相匹配的健康、无眼疾SD大鼠作为正常对照组,不做任何干预处理。
1.2.2分离大鼠视神经及提取组织蛋白 于造模后7 d,分别取NAION模型组及正常对照组大鼠,水合氯醛腹腔内注射麻醉后摘除眼球,沿眼球壁剪下球后视神经(长度3~5 mm)于冻存管中,即刻置于液氮中,保存于-80 ℃冰箱备用。采用胰蛋白酶在37 ℃下消化视神经12 h后加入500 μl尿素裂解液在室温下裂解5 min,冰上超声(能量为35%)2 min破碎后20 ℃下14 000×g离心10 min,取上清液。BCA法测蛋白浓度,先后经还原1 h、烷基化1 h后加入胰蛋白酶,37 ℃孵育12~16 h;4 ℃下14 000×g离心20 min,加入体积分数1%甲酸终止酶切后制成肽段。
1.2.3组织蛋白质谱鉴定及定量分析 取2 μg组织蛋白肽段载入C18的预柱上,并用不同梯度(6%、9%、12%、15%、18%、21%、25%、30%、35%水相)的洗脱剂(水相:0.1%甲酸、2%乙腈、97.9%水;有机相:98%乙腈、1.9%水、0.1%甲酸)进行洗脱,肽段经过C18分析柱分离后进入质谱仪中进行一级和二级质谱分析。数据的采集模式为数据依赖性。将质谱分析结果数据导入到Proteinpilot软件进行数据库检索,选用uniprot数据库来鉴定肽段,得到肽段数和每个蛋白的相对定量值。
1.2.4生物信息学分析 使用R语言stats包和clusterProfiler包对数据进行生物信息学分析,包括差异蛋白分析、基因本体论(Gene Ontology,GO)和京都基因与基因组(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。使用STRING数据库对所有差异蛋白进行相互作用分析。
1.3 统计学方法
采用SPSS 22.0统计学软件进行统计分析。NAION模型组与正常对照组间蛋白差异比较采用独立样本t检验。将差异表达倍数变化大于1.5倍且差异具有统计学意义的蛋白定义为差异蛋白。P<0.05为差异有统计学意义。
2 结果
2.1 NAION模型的建立情况
造模后3 d,正常对照组大鼠视盘边界清晰(图1A),FFA图像显示眼底未见明显荧光素钠渗漏点(图1C)。NAION模型组大鼠视盘隆起(图1B),FFA图像显示视盘区有荧光素钠渗漏(图1D),提示视盘水肿,模型建立成功。
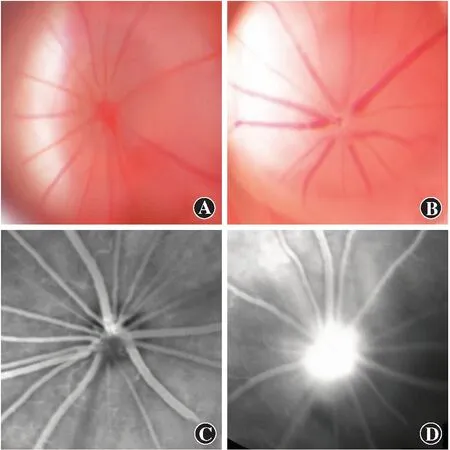
图1 各组大鼠造模后3 d眼底及FFA图像 A:正常对照组眼底图像 可见视盘边界清晰 B:NAION模型组眼底图像 可见视盘水肿 C:正常对照组FFA图像 眼底未见明显荧光素钠渗漏点 D:NAION模型组FFA图像 可见视盘区有荧光素钠渗漏Figure 1 Fundus and FFA images of rats in different groups at 3 days after modeling A:Fundus image of normal rats The boundary of the optic disc was clear B:Fundus image of NAION rats Swollen optic disc was observed C:FFA image of normal rats No fluorescein leakage was found in the optic disc D:FFA image of NAION rats Fluorescein leakage was found in the optic disc
2.2 各组大鼠视神经组织蛋白表达变化
与正常对照组比较,NAION模型组共鉴定出差异蛋白80个,其中上调蛋白5个,下调蛋白75个。上调蛋白为V型胶原α1链(collagen alpha-1(V) chain,Col5A1)、cAMP依赖性蛋白激酶催化亚基β(cAMP-dependent protein kinase catalytic subunit beta,Prkacb)、Stomatin样蛋白2(stomatin-like protein 2,Stoml2)、G蛋白相关支架蛋白(disks large homolog 1,Dlg1)、跨膜运输蛋白10(Transmembrane emp24 domain-containing protein 10,Tmed10);下调蛋白中变化明显的有丝氨酸/苏氨酸蛋白激酶N2(serine/threonine-protein kinase N2,Pkn2)、血小板活化因子乙酰水解酶IB亚基(platelet-activating factor acetylhydrolase IB subunit beta,Pafah1b1)、神经微丝蛋白(neurofilament medium polypeptide,Nefm)、细胞周期蛋白依赖性激酶5(mitochondrial tRNA methylthiotransferase CDK5RAP1,Cdk5)、微管相关蛋白1b(microtubule-associated protein 1B,Map1b)、腺苷酸激酶4(adenylate kinase 4,AK4)、重组人微管关联蛋白Tau(microtubule-associated protein tau,Mapt)和核蛋白TPR等(图2)。
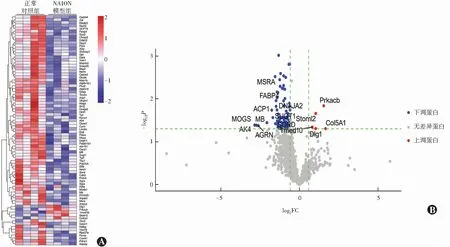
图2 各组视神经组织差异蛋白分析 A:视神经组织差异蛋白聚类分析热图 颜色代表标准化蛋白表达量 B:差异蛋白火山图 2条竖虚线分别代表FC=0.67和FC=1.5时的分界线,横虚线代表P值为0.05的分界线 FC:差异倍数Figure 2 Analysis of differentially expressed proteins in the optic nerves between the two groups A:Cluster heat map of differentially expressed proteins Color represented the standard ized protein expressions B:Volcano plot of differentially expressed proteins Two vertical dashed lines represented the dividing lines of FC=0.67 and FC=1.5,respectively,and the horizontal dashed line indicated the dividing line of P=0.05 FC:fold change
2.3 差异蛋白的生物信息学分析
GO分析结果显示,差异蛋白的细胞组分主要富集于细胞外泌体、细胞质、细胞核、髓鞘、线粒体、细胞膜、神经元投射、突触及神经细胞胞体等(图3A);差异蛋白的生物学进程主要富集在对药物的反应、细胞分裂、细胞运动、细胞对缺氧的反应、轴突生成及延伸、突触调节、神经元凋亡调控、轴浆运输等(图3B);差异蛋白的分子功能主要富集于蛋白结合、蛋白同源二聚化、三磷酸鸟苷(guanosine triphosphate,GTP)结合、蛋白结构域特异性结合、GTP酶活性、肌球蛋白结合等(图3C)。KEGG富集分析结果显示,NAION模型组主要参与代谢通路、抗生素的生物合成、碳代谢作用、突触囊泡循环、果糖和甘露糖代谢、血小板活化等信号通路(图4)。

图3 NAION模型组与正常对照组视神经组织差异蛋白GO富集分析 A:差异蛋白的细胞组分分析 横轴示差异蛋白数量;纵轴示细胞组分 B:差异蛋白的生物学过程分析 横轴示差异蛋白数量;纵轴示生物学过程 C:差异蛋白分子功能分析 横轴示差异蛋白数量;纵轴示分子功能Figure 3 GO enrichment analysis of the differentially expressed proteins between the two groups A:Cellular components analysis of differentially expressed proteins The abscissa showed the number of differentially expressed proteins,and the ordinate showed the cellular components B:Biological processes analysis of the differentially expressed proteins The abscissa showed the number of differentially expressed proteins,and the ordinate showed the biological process C:Molecular function analysis of the differentially expressed proteins The abscissa showed the number of differentially expressed proteins,and the ordinate showed the molecular function
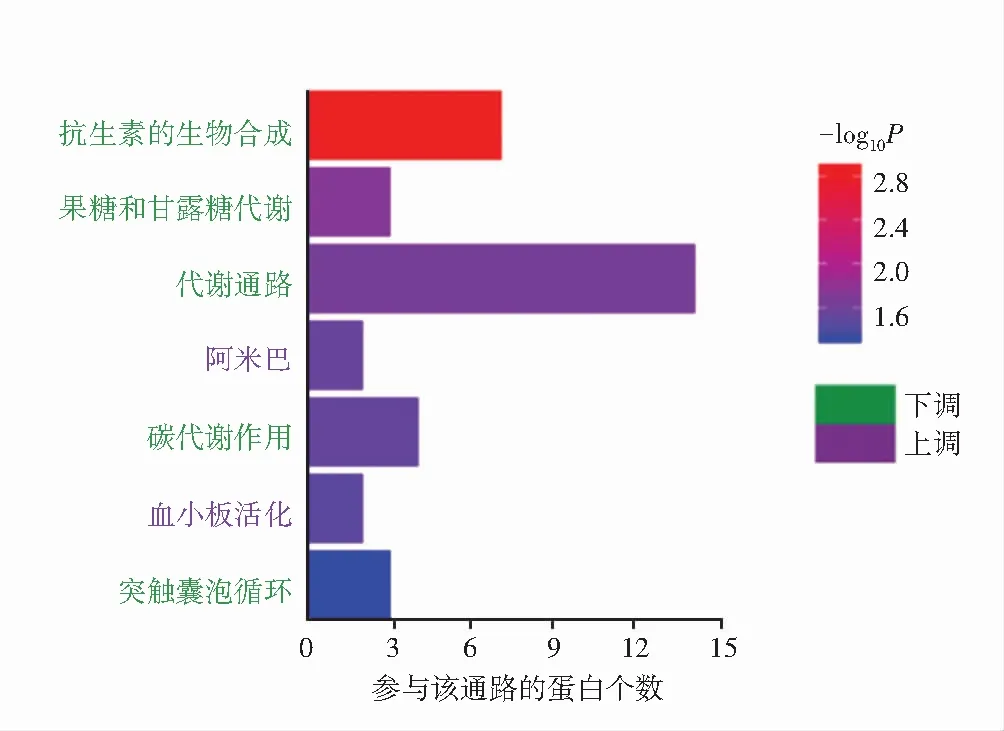
图4 NAION模型组与正常对照组视神经组织差异蛋白KEGG通路富集分析Figure 4 KEGG pathway enrichment analysis of the differentially expressed proteins between the two groups
2.4 差异蛋白的蛋白与蛋白相互作用分析
蛋白与蛋白相互作用分析结果显示,蛋白-蛋白间具有较多相互作用的有ATP柠檬酸合酶(ATP-citrate synthase,Acly)、DNA拓扑异构酶2a(DNA topoisomerase 2-alpha,Top2a)、磷酸核糖胺咪唑羧化酶(multifunctional protein ADE2,Paics)、磷酸三糖异构酶(triosephosphate isomerase 1,Tpi1)、Ras相关蛋白(Ras-related protein Ral-A,Rala)、Prkacb、体积调节阴离子通道亚基(volume-regulated anion channel subunit LRRC8E,Lrrc8e)、山梨糖醇脱氢酶(sorbitol dehydrogenase,Sord)、Dlg1、Pkn2、Pafah1b1和丝氨酸/苏氨酸蛋白磷酸酶2A催化亚基β亚型(serine/threonine-protein phosphatase 2A catalytic subunit beta isoform,Ppp2cb)等(图5)。
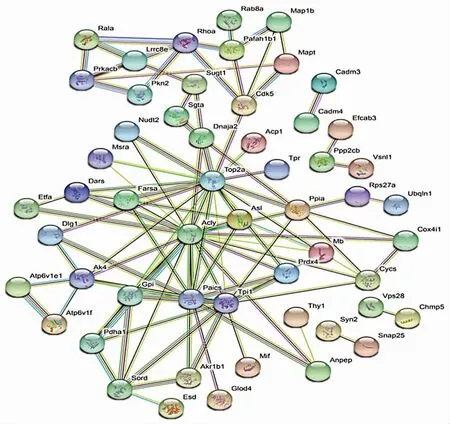
图5 蛋白与蛋白相互作用网络图 蛋白与蛋白之间关系越密切,其间连接线段数量则越多Figure 5 Protein-protein interaction network The closer the relationship between proteins,the more the lines between them
3 讨论
NAION是一种常见的视神经病变,最终可导致视神经萎缩,目前尚缺乏有效的治疗方法。蛋白质组学技术可用于探讨该疾病相关的致病蛋白并寻找治疗靶点。由于NAION患者多为内科治疗,无法获得患者的眼内液及病理组织进行检测,又考虑到血液标本对视神经组织中蛋白变化的反映有限,且受全身疾病及用药影响因素较大,故采用实验动物疾病模型进行研究。啮齿类动物的视盘血液供应方式与灵长类类似[11],因此本研究采用大鼠NAION模型。Bernstein等[12]成功应用光动力学方法制备SD大鼠AION模型,后期大量研究均证实该模型可模拟临床AION的病理过程,为AION的相关基础研究提供帮助[13-15]。Slater等[13]研究利用啮齿动物SD大鼠制备的缺血性视神经病变的动物模型发现,在造模后7~15 d开始逐渐出现RGC凋亡。鉴于此,本研究将取材时间点定于造模后第7天,以便更好地反映NAION急性期蛋白的改变。
本研究结果显示,视神经组织差异蛋白中包含许多与神经系统发育及功能相关的蛋白,如Nefm和Map1b。Nefm属于组神经丝三联体蛋白之一,是中枢神经系统神经元主要的细胞骨架组成部分,可维持轴突机械强度和稳定性,并参与轴突内成分间的运输或定位。多项研究结果证实,外伤或疾病导致的视神经损伤过程中,Nefm表达下调[16-17],这与本研究中NAION模型大鼠视神经组织Nefm蛋白表达下调的结果相一致。Map1b可促进神经元微管中的α-微管蛋白酪氨酸化,在伴随神经突延伸的细胞骨架变化中起重要作用。本研究中Map1b在NAION模型大鼠视神经组织中表达下调,与Tzekov等[17]研究发现外伤性脑损伤诱导视神经损伤小鼠模型视神经组织Map1b蛋白表达下调的结果一致。但Dieterich等[18]研究发现,视神经组织中Map1b表达水平在视神经挤压后2周内升高。该差异可能与轴突破裂和变性的不同时期有关,具体机制需进一步研究。我们推测,在NAION发生时,Nefm和Map1b可能通过改变细胞骨架的稳定性来影响轴突的功能。
Rho激酶是一种丝氨酸/苏氨酸蛋白激酶,Rho/Rho激酶信号通路普遍存在于各组织细胞中,可参与多种生物学功能。Rho/Rho激酶信号通路可调节细胞肌动蛋白骨架状态并参与调控细胞增生与凋亡等;在中枢神经系统中,Rho/Rho激酶信号通路可被缺血、缺氧等因素异常激活,发挥调节神经细胞迁移、增生及影响轴突再生的作用,与许多神经系统疾病的发生密切相关,如癫痫、阿尔茨海默病及脑卒中等[19-21]。本研究结果显示,NAION模型视神经组织中Rala、Pafah1b1、Pkn2和RhoA等与Rho的功能密切相关的蛋白表达下调。Rala属于Ras小G蛋白家族,可参与细胞物质转运、增生、迁移和凋亡等多种生物学功能[22]。Ral/Rho通路与神经系统功能密切相关。研究表明,Rala在胚胎期的中枢神经系统和外周神经系统中均有表达,在眼部视网膜上亦有表达变化,在视网膜色素变性中可调节视网膜色素上皮细胞凋亡[23-24]。Rala还可影响胚胎神经元的神经突的分化及极性,对神经母细胞的迁移具有调节作用[25-26]。此外,Rala也可通过调节线粒体膜电位影响ATP的生成,从而影响细胞能量代谢[27]。因此,我们推测在NAION中,Rala可能通过改变线粒体膜电位来影响神经细胞代谢。Pafah1b1是大脑皮层正常发育所必需的,也是首个被发现与神经元迁移异常相关的基因[28-29]。Pafah1b1可激活Rho激酶和肌动蛋白,通过调节细胞骨架动力学来控制神经元迁移[30]。Pafah1b1活性降低的小鼠可表现出严重的大脑混乱以及小脑缺陷[30]。Pafah1b1基因突变是轻度脑干钙化和基底节钙化的原因[31]。Pkn2是一种丝氨酸/苏氨酸蛋白激酶,是体内重要的信号转导蛋白,在调节细胞周期进程、肌动蛋白细胞骨架装配、细胞迁移、细胞黏附、肿瘤细胞侵袭和转录激活等信号传导过程中发挥作用[32],既往研究表明,Pkn2可被Rho激酶激活,调节细胞周期相关蛋白,从而发挥促进突触生长的作用[33-34]。因此,我们推测当NAION发生时,Pafah1b1可通过影响Rho/Rho激酶信号通路,进而引起Pkn2的表达异常,导致神经元迁移和细胞周期异常、细胞骨架改变,最终导致视神经萎缩。
本研究结果还显示,NAION模型视神经组织中Prkacb和Col5a蛋白表达上调。Prkacb为蛋白激酶cAMP激活的催化亚基β,可介导cAMP依赖性信号转导通路。cAMP依赖蛋白激酶PKA的激活可调节多种细胞过程,例如细胞增生、细胞周期、微管动力学的分化和调节、染色质凝结和解凝、核被膜拆解和重组以及细胞内转运机制和离子通量的调节。cAMP/PKA通路与RGC的存活和轴突生长发育密切相关[35-36]。有研究表明,视神经损伤后,蜥蜴RGC中cAMP水平升高,cAMP/PKA信号通路的激活在蜥蜴视网膜轴突再生中起关键作用[37]。而大鼠视神经损伤后也可通过激活PKA途径提高RGC的存活率[38]。青光眼的动物模型中,cAMP/PKA通路的激活可减轻神经胶质细胞增生,降低促炎介质的表达水平,并增强青光眼中的神经元活力[39]。因此,我们推测在NAION发生过程中,Prkacb可通过激活cAMP通路发挥重要作用,其可能成为未来治疗靶点之一。胶原蛋白V是一种形成原纤维的胶原蛋白,普遍存在于人体中,与胶原纤维生成有关,其表达异常可导致神经系统疾病。在青光眼患者的视神经组织中,Col5A1表达明显上调,它可能是通过细胞外基质(extracellular matrix,ECM)受体的交叉反应及局部黏连继而引起ECM重塑等通路导致视神经萎缩[40-42]。此外,Col5A1基因与腕管综合证的发病相关[43]。在NAION中,Col5A1可能与胶质细胞增生密切相关,其机制仍有待进一步研究。
蛋白与蛋白相互作用分析结果表明,Acly、Paics及Tpi1与其他蛋白之间的联系密切,这几个蛋白均与能量的合成有关,推测这些蛋白表达水平的下调可能是由于在NAION大鼠中RGC能量合成受到抑制,出现能量代谢障碍,从而影响轴突再生并促进RGC细胞的凋亡。
本研究尚存在一些不足,如未能直接对临床病理标本进行蛋白组学分析;NAION动物模型不能完全模拟NAION患者疾病发病过程;未设置单纯RB注射组及单纯激光照射组,故无法完全排除这些因素导致的视神经组织蛋白变化;一种蛋白质组学检测技术并不能完全检测出组织中全部蛋白,且检测出的蛋白需要与数据库进行比对鉴定,此过程有可能产生误差;此外,本研究未能对差异蛋白进行功能验证。未来我们将采用实时荧光定量PCR及Western blot等手段对差异蛋白进行验证,并将分组细化至NAION模型组、单纯RB注射组、单纯激光照射组及正常对照组,从而确保差异蛋白的准确性,并对差异蛋白进一步进行功能及机制研究。由于本研究是基于动物模型的蛋白组学研究,其结果与人类疾病的关联性还有待进一步验证,但该研究结果可为人类疾病研究提供一定的实验依据。
综上所述,本研究利用iTRAQ蛋白质组学技术对NAION大鼠模型中视神经组织差异蛋白进行定量检测,共检测差异蛋白80个,这些差异蛋白主要与神经生长、能量代谢、轴浆运输及凋亡等信号通路相关,本研究结果为寻找NAION相关治疗靶点提供了实验依据。
利益冲突所有作者均声明不存在利益冲突
