臂旁核神经元生理功能的研究进展
2022-02-22陈惠敏余守洋杨文沈伟王海英
陈惠敏 余守洋 杨文 沈伟 王海英
1遵义医科大学附属医院麻醉科(贵州遵义563000);2贵州省普通高等学校脑科学特色重点实验室(贵州遵义563000);3上海科技大学生命科学与技术学院(上海201210)
臂旁核(parabrachial nucleus,PBN)位于脑桥背外侧,主要分为三个亚核,包括内侧臂旁核(medial parabrachial nucleus,MPB)、外侧臂旁核(lateral parabrachial nucleus,LPB)和Kölliker⁃Fuse(KF)核[1](图1)。臂旁核作为传递各种感觉信息的中继站,与脑内多个核团存在紧密的神经纤维连接(图2)。臂旁核的传入纤维主要来自下丘脑、杏仁核、孤束核头端的味觉感觉区和尾端的内脏感觉区,部分来自皮层和极后区。臂旁核发出的纤维投射相当广泛。MPB 主要向皮质、丘脑和杏仁核发出纤维投射;LPB 主要向与参与调节自主神经系统功能相关的脑区发出纤维投射,如下丘脑视前区(hypothalamic preoptic area,POA)、室旁核、中央杏仁核、终纹床核等;KF 核是发出下行投射的主要部位,主要投射至延髓,如孤束核、延髓腹外侧核和脊髓中间外侧核,部分投射至副交感神经。臂旁核内大部分神经元为谷氨酸能,少部分是γ⁃氨基丁酸(γ⁃aminobutyric acid,GABA)能。然而神经元类型具有高度多样性,数十种神经肽与这两大类神经元共表达,其中包括降钙素基因相关肽(calcitonin gene⁃related peptide,CGRP)、强啡肽原(prodynorphin,Pdyn)、脑啡肽原(proenke⁃phalin,Penk)、促肾上腺皮质激素释放激素(corti⁃cotropin releasing hormone,CRH)、垂体腺苷酸环化酶激活肽(pituitary adenylate cyclase⁃activating peptide,PACAP)、神经降压素(neurotensin,NTS)、P 物质(substance P,SP)、胆囊收缩素(cholecysto⁃kinin,CCK)等。本篇综述以神经元高表达的神经肽基因为分型策略,总结不同亚型神经元参与调控的生理过程,并以功能为线索,对臂旁核亚核间的功能整合和不同亚型神经元的共性提出猜想,以期精准识别调控特定生理过程的神经元,从而为神经调控失衡相关疾病的预防和治疗提供基础。
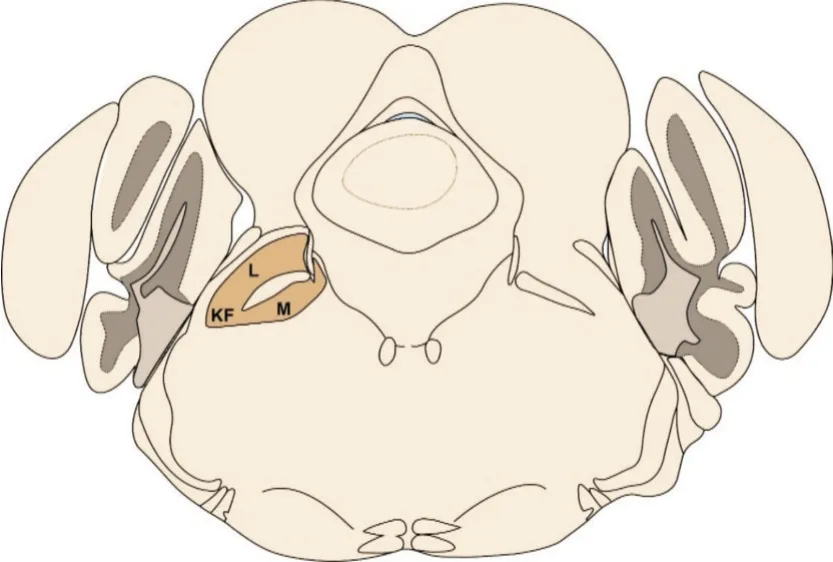
图1 臂旁核主要亚核示意图Fig.1 A schematic of major subnuclei within the PBN
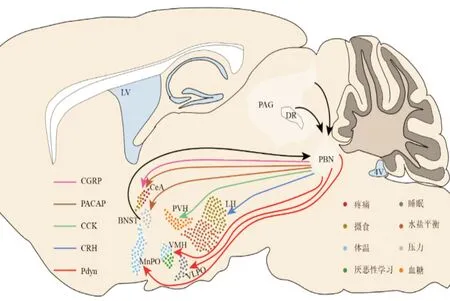
图2 臂旁核部分重要的神经纤维投射Fig.2 Some important hardwired circuits of the PBN
1 维持内环境稳态
1.1 能量代谢臂旁核中表达CGRP、Pdyn、CCK、NTS 的神经元参与调节摄食平衡。小鼠进食期,LPB 内超过50% CGRP 阳性神经元表达即刻早期基因fos,激活LPBCGRP神经元致小鼠食欲不振[2],提示LPBCGRP神经元参与传递进食期的饱腹感信号并抑制摄食。其神经环路机制可能是促进进食的下丘脑刺鼠相关蛋白(agouti⁃related peptide,AgRP)神经元对LPBCGRP神经元的抑制性投射在饱腹时发生去抑制,LPBCGRP神经元活性增加,终止进食。其分子机制可能是LPBCGRP神经元细胞膜上GDNF 家族α 样受体(GDNF⁃family receptor α⁃like,GFRAL)识别生长分化因子⁃15,减缓胃排空以减少食物摄入[3]。背外侧和内侧臂旁核接受终纹床核GABA能和谷氨酸能神经元的神经纤维投射[4]也可影响进食,而这些亚区CGRP 表达量极低,提示CGRP阳性神经元不是唯一参与调控进食量的亚型。实际上,激活背外侧PBNPdyn神经元可限制进食,其通过监测摄入液体或固体后产生的机械感觉信号,维持发放饱腹信号以防止机体过量摄食[5]。CCK是调节食欲和饱腹感的关键分子,激活PBNCCK神经元可限制胰岛素浓度升高,维持高浓度血糖水平,从而抑制食物摄入。
摄食行为除受饱腹和饥饿信号的调控,还受光照周期的影响。西伯利亚仓鼠通过整合来自胃肠道的短期饱腹感信号与包括可用能量储备状态和现行光照周期在内的长期信号,以保持摄食平衡。短时间(8 h)光照的仓鼠进食量减少,且臂旁核内的NTS 表达量增加[6],提示PBNNTS神经元参与调控受光照周期影响的饱腹感信号传递过程。上述神经元被激活后均抑制进食,然而其解剖分布及作用机制有所不同,提示它们为不同神经元群,彼此是否存在交互影响以调控进食仍是谜题。摄食失衡常导致超重、甚至肥胖,目前临床上应用GFRAL 作为靶标分子而设计的减重药,会伴发恶心和呕吐反应[7],使其应用受限。因此,为高效且无副作用治疗摄食失衡需针对更特异神经元上的分子靶点进行药物研发,臂旁核作为复杂的调控节点,具有积极的研究意义。
1.2 体温臂旁核内Pdyn、Penk、CCK 阳性神经元参与维持体温相对恒定。环境温度升高时,投射至体温调节中枢POA 的PBNPdyn神经元活性增加[8-9],产生抑制棕色脂肪组织(brown adipocytes tissue,BAT)产热的效应,从而限制体温升高。肥胖患者常表现出低代谢水平及弱产热能力[10],这些变化可能与PBNPdyn神经元活性增加相关。大鼠因长期摄入高脂食物而肥胖后,其BAT 产热能力受损,可能机制为高脂食物代谢物之一充当瞬时受体电位香草酸亚型1(transient receptor potential vanilloid 1,TRPV1)的配体。孤束核上TRPV1 活化后,兴奋性信号传至背侧PBNPdyn神经元,促使其释放强啡肽并作用于正中视前核,抑制BAT 产热能力[11],从而降低体温。笔者团队研究代谢与体温间的关系时发现,抑制LPBPdyn神经元活性可促进BAT 产热并抵抗高脂饮食所引发的肥胖[8],提示高脂饮食所致的肥胖可能受到PBNPdyn神经元的影响,即激活导致肥胖,抑制抵抗肥胖。有趣的是,PBNPdyn神经元被激活可抑制进食从而减重,提示非同群PBNPdyn神经元调控能量摄入及代谢。这为探寻特异调控能量平衡的神经元类型以治疗能量代谢紊乱提供新的研究方向。
PBNPenk神经元参与调控散热过程。臂旁核内热响应的神经元高表达Penk[9],且与投射至POA并参与促进机体散热的谷氨酸能神经元存在共标,提示Penk参与调控散热过程。PBNCCK神经元也参与体温调节。激活LPBCCK神经元与POA 间的神经环路,促进尾部血管舒张,降低体温[8]。临床上常见因温度调节紊乱引起的各类疾病,如中暑、炎症性发热等,而目前的治疗方案存在不足。靶向COX 酶可有效退热,但有多种副作用,如消化性溃疡及增加中风风险等。目前中暑仍依赖物理性降温,病人常因降温不及时而死亡,因此亟待研发高效的治疗手段。确定臂旁核内参与调节体温与能耗的关键分子及环路节点,可为治疗体温及能量代谢调节异常的相关疾病提供方向。
1.3 渗透压PBNCRH神经元参与调节水⁃盐平衡。CRH 神经元是调节水和盐摄入量的关键成员。LPBCRH神经元与调节水钠平衡的关键核团——孤束核和极后区,存在紧密的解剖联系。外侧下丘脑CRH 神经元对LPB 发出下行纤维投射,细胞发生脱水时[12],LPB 中CRH 表达量增加,从而激活垂体⁃肾上腺皮质系统,发挥保水排钠作用,提示该神经元可能是治疗水盐代谢紊乱的关键靶点。
2 调控感觉信息的传递
2.1 痛觉及其伴发的多种感觉组织损伤多伴发疼痛及自主神经系统功能改变,这些过程受到臂旁核内表达Penk、CRH、SP、PACAP 神经元的调控。针刺镇痛时,臂旁核内Penk 表达量明显增多,提示其参与痛觉信息处理。PBNPenk神经元可将伤害性感觉信息传入丘脑板内核和中线核[13],影响自主神经系统功能,如呼吸及恶心感。PBNCRH神经元也参与痛觉信息传递。机体发生神经病理性疼痛时,PBNCRH神经元与杏仁核特定亚区的兴奋性联系被切断,提示PBNCRH神经元参与调节疼痛反应。机体发生炎症性疼痛时,臂旁核中Fos 蛋白的表达量显著增加且与CRH阳性神经元存在重叠,提示PBNCRH神经元参与调节炎症免疫反应。抑制炎性通路可改善疼痛水平[14],提示参与调控这两个过程的CRH 神经元可能为同一群神经元,可并行处理炎症信息与疼痛感觉信息。疼痛反应还受到SP 的调控。臂旁核中SP 由tac1 基因编码,参与调节疼痛反应。热刺激致痛时,LPBSP神经元被激活并兴奋延髓网状结构内SP 阳性神经元,缩短对热刺激做出反应的时间[15]。多系统萎缩(multiple system atrophy,MSA)是影响自主神经功能的神经退行性疾病,MSA 患者臂旁核内SP 表达量显著减少,提示PBNSP神经元参与自主神经功能改变的过程。臂旁核在痛觉调控中承担复杂的角色,提示其可能是疼痛治疗的位点,明确其作用机制具有积极的临床意义。
疼痛常伴食欲不振,内脏痛所致的恶心感可通过迷走神经上行至极外侧PBNCGRP神经元并限制进食[16]。临床疗效证实臂旁核是传递多种感觉信息的节点,针对其调控不同生理过程的神经元共性而设计靶向药,可简化药物使用而达到多种疗效。CGRP 靶向药便是当前治疗偏头痛的最佳手段[17],并缓解其伴随的食欲不振。疼痛还伴发不愉快的情绪体验,包括抑郁症、焦虑症及创伤后应激障碍。PACAP 是调节慢性疼痛相关情绪反应的关键成分。持续性疼痛时,LPBPACAP神经元将疼痛感觉信号传至参与调节情绪的杏仁核,并增加杏仁核PACAP 的表达量,诱发机体出现焦虑样行为。与此同时,杏仁核对臂旁核的抑制性纤维投射发生去抑制[18],换言之,疼痛诱发焦虑,而焦虑会加剧疼痛。PBNPACAP神经元对终纹床核发出的纤维投射也参与调节焦虑水平。反复给与伤害性刺激致痛时,终纹床核PACAP 的表达量增多,且焦虑相关行为加剧[19]。PBNPACAP神经元投射至不同下游都可参与调节焦虑水平,推测它们之间存在叠加或级联效应,因此需进一步探究其具体机制为治疗焦虑相关疾病的研究提供方向。
2.2 痒觉PBNSP神经元与痒觉相关,痒觉信息上行至脊髓表达胃泌素释放肽及其受体的神经元,继而传入臂旁核内表达P 物质受体(neurokinin 1 receptor,NK⁃1R)的神经元[20-21]。强烈的疼痛可终止小鼠抓挠行为,提示传递痒觉和痛觉信息的神经间存在功能交联。PBNSP神经元已被证实参与传递痛觉信息,而SP 与臂旁核内NK⁃1R 结合可抑制臂旁核的兴奋性传递。疼痛感觉信息可能是通过增强PBNSP神经元的活性以抑制痒觉信息传递,减弱或替代瘙痒感。目前临床上存在多种抗组胺类止痒药,疗效不显著且对非组胺依赖性瘙痒无效。阻断臂旁核传递痒觉信息可缓解各类型瘙痒,提示臂旁核调控瘙痒的机制可能是止痒治疗的研究基础。
2.3 内脏感觉信息PBNNTS神经元参与传递内脏感觉信息,从而调控自主神经系统功能,如血压。NTS 神经元在臂旁核的内侧核和外侧核密集分布,可传递内脏感觉信息至丘脑的腹侧后内侧核[22]。激活该环路,可增加丘脑神经元的自发放电频率和增强迷走神经介导的信息传入,产生降压效应。臂旁核内NTS 的表达水平随着其响应迷走神经刺激时间的延长而降低,可能与迷走神经影响传入臂旁核的内脏信息量有关,即迷走神经活性对NTS 的表达存在负反馈调控。自主神经系统功能紊乱可致高血压。目前其治疗手段呈综合性,主要靶向外周脏器上的受体,而长时间使用受体阻滞剂可致受体表达上调,意味着患者需终身服药,治疗安全性欠佳。因而探究臂旁核对血压调控的具体分子机制有助于为安全无副的药物研发提供基础。
3 调控伤害性刺激相关的生理反应
机体应激时,会维持警觉状态并形成条件反射及恐惧记忆,这些过程受到臂旁核内CGRP、Pdyn 阳性神经元的调控。机体维持觉醒的机制可能是血液中二氧化碳浓度随代谢增加而升高,而应激处于高代谢状态,可发生高碳酸血症。此时,中缝背核释放5⁃羟色胺(5⁃hydroxytryptamine,5⁃HT)并结合至极外侧PBNCGRP神经元细胞膜上5⁃HT2A 受体,使机体觉醒[23]。PBNCGRP神经元可将伤害性刺激相关的信息传至杏仁核,介导逃避行为[24];传至前脑多个部位使小鼠形成条件反射及恐惧记忆[25]。LPBPdyn神经元支配腹内侧下丘脑促进机体对伤害性刺激进行厌恶性学习[26],激活该环路可提醒机体存在潜在伤害并规避危险。应激障碍是机体无法正确处理伤害性刺激的综合表现,可能涉及上述神经环路调节紊乱。而目前仅将它视为精神类疾病,暂无特异治疗药物。因此,维持臂旁核在应激时的正向调节作用可能是未来药物研发的方向。
应激时,机体需进行葡萄糖动员以满足所需能耗,这一过程受到PBNCCK神经元的调控。该机制可能是导水管周围灰质LepRb 神经元将血糖信息传至PBNCCK神经元,继而传入下丘脑腹内侧核[27],产生交感神经兴奋效应,从而提高血糖。参与摄食平衡和调节应激血糖水平的PBNCCK神经元都产生高血糖效应,提示CCK 可能是参与血糖调节的神经元所表达的特异分子标志物,其是纠正血糖紊乱的潜在分子。
4 调节睡眠觉醒周期
PBNPdyn神经元影响睡眠觉醒周期。阿片类镇痛药增加日间睡眠时间,Pdyn作为内源性阿片肽前体之一,具相似作用。中央外侧PBNPdyn神经元与维持睡眠稳态的关键核团——腹外侧视前区具有紧密的解剖联系,抑制或激活腹外侧视前区κ 受体都影响睡眠周期[28],提示中央外侧PBNPdyn神经元可能是其上游,参与调节睡眠周期。阿片类镇痛药可改善癌症患者的整体生存质量,但也影响睡眠质量,提示Pdyn 可能作为信使传递睡眠相关信息。因此,抑制中央外侧PBNPdyn神经元释放Pdyn可能是对抗镇痛药影响睡眠周期的有效策略。
5 臂旁核功能整合的机制猜想
臂旁核传递并处理各种信息,参与调节多个生理过程,如能量代谢平衡、体温相对恒定、血糖合理波动、痛觉及痒觉等感觉信息传递、睡眠稳态等。这些功能独立完成又彼此影响。假如,PBNPdyn神经元具降低体温及代谢的功能,体温与代谢往往呈现平行关系,提示PBNPdyn神经元可整合代谢及体温相关的信息,产生这两种效应的神经元可能为同一群。体温与渗透压平衡也存在交联。机体通过出汗散热时,渗透压升高。为保持渗透压平衡,机体需要进行保水排钠。因此,参与促进散热的LPBCCK神经元及降低渗透压的LPBCRH神经元可能存在功能整合。当LPBCCK神经元活性增强时,LPBCRH神经元活性也增强。觉醒状态与应激行为也息息相关,维持觉醒是机体调动应激的前提、过度应激会影响觉醒状态。臂旁核内多种亚型神经元可同时调控这两个生理功能,包括CGRP、Pdyn阳性神经元。这除了提示臂旁核内神经元存在功能整合外,也说明以其高表达的神经肽基因定义神经元亚型仍不充分,需锚定更加特异的分子标记物指征其调控的特定生理功能。
6 总结与展望
臂旁核参与调节多种生理功能,为精准定义臂旁核调控特定功能的神经元类型以设计纠正相应功能调节紊乱的药物,需探究其调节共性及整合机制。以功能为线索,初步划分臂旁核亚核。以摄食为例,极外侧臂旁核的尾端与厌食有关,中央内侧臂旁核与水盐摄入平衡有关,提示这两个亚核存在两群神经元,接下来可细分其神经元类型。然而臂旁核内大多数神经元表达囊泡谷氨酸转运蛋白2(vesicular glutamate transporter 2,Vglut2),其存在仅说明该神经元可装载并快速释放谷氨酸以兴奋下游中枢,因此,需更为特异的分子标记物以区分神经元类型。
在研究温度信号从LPB 传递到下丘脑的机制时,笔者团队发现LPB 神经元对冷热刺激均有响应,这说明LPB 存在传递不同温度信息的神经元;应用光遗传学技术选择性激活其表达最为丰富的谷氨酸能神经元发现,根据激光频率的变化,可获得升温或降温的表型,该结果提示这群谷氨酸能神经元存在可调控体温变化的不同亚型;通过特殊的基因标记方法——翻译核糖体亲和纯化法,发现LPB 可表达多种神经肽,包括CCK 及Pdyn,这两种神经肽与谷氨酸能神经元高度共表达,但这二者本身共表达率较低;通过多种神经元操纵技术发现,体温升高时,表达CCK 或Pdyn 的神经元被募集,并对POA 不同亚核发出神经纤维投射,分别产生促进血管舒张及抑制棕色脂肪产热的效应来抵御体温进一步升高,这提示神经元高表达的神经肽基因可能是区分神经元类型的潜在标志物。
实际上,臂旁核内不同神经肽阳性神经元可参与调控同个生理过程。以疼痛并伴有焦虑为例,臂旁核内CRH、PACAP 阳性神经元都参与调控这两过程,并都对杏仁核发出神经纤维投射,提示这二者可能为同一群神经元。而同一神经肽阳性的神经元可参与调控不同生理功能。LPBCCK神经元向下丘脑腹内侧核和POA 发出神经纤维投射,分别参与维持血糖平衡及体温恒定的过程,提示承担不同生理功能的CCK 神经元为不同亚群,产生效应的机制不同。此外,臂旁核参与调控的生理功能交错复杂。PBNSP神经元同时参与痛觉及痒觉信息传递,并且这两种感觉信息存在此消彼长的现象。其机制可能是PBNSP神经元投射至不同下游或以不同频率将信息传入同一下游或臂旁核内表达tacl 基因的不同群神经元处理相应感觉信息并存在交联。因此,需继续探索以明确具有一定表达特征的神经元并解析表达相关基因神经元释放的具体物质及其介导信息传递的具体机制。
