双歧杆菌三联活菌散添加治疗儿童抽动障碍疗效及对血清兴奋性氨基酸水平影响
2022-02-22王艳萍井淼华颖胡笑月孙明霞
王艳萍 井淼 华颖 胡笑月 孙明霞
南京医科大学附属无锡市儿童医院神经内科(江苏无锡214023)
抽动障碍(tic disorders,TD)是一种以不自主的、反复、快速、无目的一个或多部位肌肉的运动性抽动和(或)发声性抽动为特征的神经精神疾病。该病以5~10岁患儿多见,10~12岁最严重[1-2],男性多于女性。近年来,儿童抽动障碍发病率逐渐上升,影响儿童学习、社交和人格发展,给家庭和社会带来了极大的负担[3]。
抽动障碍发病机制不明,多巴胺(dopamine,DA)活动过度或多巴胺受体超敏感现象是目前较为公认的机制之一。根据这一理论及我国2017年版儿童抽动障碍诊断与治疗专家共识均将经典的多巴胺受体阻滞剂硫必利作为一线治疗药物[4]。多项研究表明[5-6],抽动障碍与过敏性疾病、食物过敏具有相关性,而过敏性与非过敏性婴儿肠道菌群之间存在差异性。过敏性婴幼儿肠道的有益菌双歧杆菌、乳酸杆菌数量减少[7],而肠杆菌、葡萄球菌定植数量增多。研究表明[8],补充双歧杆菌可显著改善过敏性疾病。另有研究证实[9]乳酸杆菌和双歧杆菌能产生γ⁃氨基丁酸(γ⁃aminobutyr⁃ic acid,GABA),而GABA 是人类大脑皮层中主要的抑制性神经递质,与抽动障碍的发生具有密切相关性。近年来研究发现[10],兴奋性氨基酸(EAAs)尤其是谷氨酸(Glutamic acid,Glu)、天门冬氨酸(Aspartic acid,Asp)参与抽动障碍的发病过程。本研究拟采用回顾性临床研究,探讨双歧杆菌三联活菌散联合硫必利及单用双歧杆菌治疗儿童抽动障碍的临床疗效及对血清兴奋性氨基酸水平影响,为抽动障碍治疗提供潜在的新方法。
1 对象与方法
1.1 研究对象选取2019年11月至2020年6月在无锡市儿童医院门诊就诊的抽动障碍患儿130 例作为研究对象,随机分为硫必利+双歧杆菌组50 例、硫必利组50 例、双歧杆菌组30 例。硫必利+双歧杆菌组50 例,其中男31 例,女19 例;年龄5~ 14 岁,平均年龄(7.58 ± 2.37)岁;病程6 个月~5年,平均(21.2 ± 6.1)个月。硫必利组50 例,其中男32 例,女18 例;年龄6~ 14 岁,平均年龄(8.10 ±1.87)岁;病程6 个月~4年,平均(19.2 ± 5.7)个月。双歧杆菌组30 例,其中男17 例,女13 例;年龄5~13岁,平均年龄(7.70±2.14)岁;病程7个月~4年,平均(19.2±5.7)个月。3 组间性别、年龄及病程差异均无统计学意义(P> 0.05),见表1。所有入选的患儿均经过严格的临床症状筛选,经两位神经专科医生确诊。诊断标准参照儿童抽动障碍诊断与治疗专家共识(2017 实用版)[4]及《美国精神疾病诊断与统计手册》第5 版(DSM⁃5)[11]进行筛选。所有入选患儿在采用前两个月内均未使用抗生素及微生态调节剂。排除标准:(1)有精神发育迟缓、自闭症、情绪障碍等疾病史;(2)有舞蹈症、癫痫和其他锥体外系疾病;(3)有肥胖、性早熟、哮喘、心脏病等病史;(4)近半个月全身或局部使用糖皮质激素、免疫抑制剂、抗组胺药物的患儿;(5)其他严重疾病。本研究经无锡市儿童医院伦理委员会批准(伦理号:WXCH2019⁃08⁃006)。所有入组研究对象及家属均签署知情同意书。
表1 三组一般资料比较Tab.1 Comparison of general data between the three groups ±s
表1 三组一般资料比较Tab.1 Comparison of general data between the three groups ±s
性别(例)男女年龄(岁)病程(月)硫必利+双歧杆菌组31 19 7.58±2.37 21.2±6.1硫必利组32 18 8.10±1.87 19.2±5.7双歧杆菌组17 13 7.70±2.14 19.2±5.7 P 值0.805 0.456 0.167
1.2 治疗方法硫必利组单用硫必利(江苏恩华药业股份有限公司,规格:100 mg/片),开始剂量50~ 100 mg/d,分2~ 3 次口服,隔1~ 2 周后视病情及年龄逐渐加量至200~ 400 mg/d,定期复诊观察。双歧杆菌组单用双歧杆菌三联活菌散(上海信谊药厂有限公司,规格:2 g/包),剂量为1 次1~2 g,1日3 次。硫必利+双歧杆菌组在硫必利的基础上,添加双歧杆菌三联活菌散。三组治疗和观察时间均为12 周。
1.3 观察指标
1.3.1 抽动程度分析3 组患儿抽动症状严重程度,于治疗前、治疗后4周、治疗后12周通过耶鲁综合抽动严重程度量表(YGTSS)进行评定[12]。主要指标:抽动评分由运动性抽动和发声性抽动的类型次数、频率、强度、干扰性、复杂性五要素组成。每要素评分由0~5 分组成。运动性抽动和发声性抽动总分各25 分。次要指标:YGTSS 社会功能受损程度指抽动对自尊、家庭生活、社交、学习或工作上带来的困扰,按6 级(无~严重)进行评定,相应记0~ 50 分,分数越高表示社会功能受损程度越重。YGTSS 总分=主要指标评分+次要指标评分,总分为100分,得分越高表示抽动障碍越严重。
1.3.2 疗效评估3 组患儿在治疗前及治疗后4、12 周进行YGTSS 评定其临床疗效。临床疗效:痊愈为YGTSS 减分率≥80%;显效:YGTSS 减分率60%~ 79%;有效为YGTSS 减分率30%~ 59%;无效为YGTSS 减分率<30%。减分率=(治疗前评分⁃治疗后评估)/治疗前评估分。总有效率=(痊愈例数+显效例数+有效例数)/总例数×100%。
1.3.3 生化指标水平治疗前及治疗后12 周采集空腹静脉血2 mL,离心,分离血清后采用高效液相色谱系统检测血清中Glu、Asp 水平。
1.4 统计学方法采用SPSS 22.0统计软件进行数据分析,计量资料以均数±标准差表示,多组比较采用方差分析,两两比较采用SNK检验。计数资料比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 3 组患儿治疗前后YGTSS 评分比较治疗前3 组YGTSS 评分比较差异无统计学意义(P>0.05);3 组患儿在治疗4、12 周YGTSS 评分均较治疗前降低,差异有统计学意义(P< 0.05)。治疗后4 周,硫必利+双歧杆菌组与硫必利组相比,YGTSS评分差异无统计学意义(P> 0.05),但均低于双歧杆菌组(P< 0.05)。治疗后12 周,硫必利+双歧杆菌组YGTSS 评分较硫必利组、双歧杆菌组降低(P<0.05),硫必利组YGTSS 评分低于双歧杆菌组(P<0.05)。见表2。
表2 3 组不同时间YGTSS 评分比较Tab.2 Comparison of YGTSS scores in three groups at different times±s

表2 3 组不同时间YGTSS 评分比较Tab.2 Comparison of YGTSS scores in three groups at different times±s
注:与硫必利组比较,*P<0.05;与双歧杆菌组比较,△P<0.05
时间治疗前治疗后4 周治疗后12 周F 值P 值硫必利+双歧杆菌组33.56±6.86 24.42±4.53△12.60±4.51*△188.472<0.05硫必利组32.84±4.30 24.56±3.2△14.92±5.98△187.047<0.05双歧杆菌组32.33±5.09 27.37±4.82 21.13±6.88 29.387<0.05 F 值0.486 5.573 21.405 P 值0.616<0.05<0.05
2.2 3 组患儿临床疗效比较治疗12 周后,硫必利+双歧杆菌组总有效率为94%,硫必利组总有效率为82%,双歧杆菌组总有效率为56.7%,3 组临床总有效率比较差异有统计学意义(χ2=16.90,P<0.05)。硫必利+双歧杆菌组、硫必利组总有效率都高于双歧杆菌组,差异有统计学意义(χ2=16.33、6.04,P< 0.05)。硫必利+双歧杆菌组临床总有效率高于硫必利组,差异无统计学意义(χ2=3.41,P=0.065)。见表3。
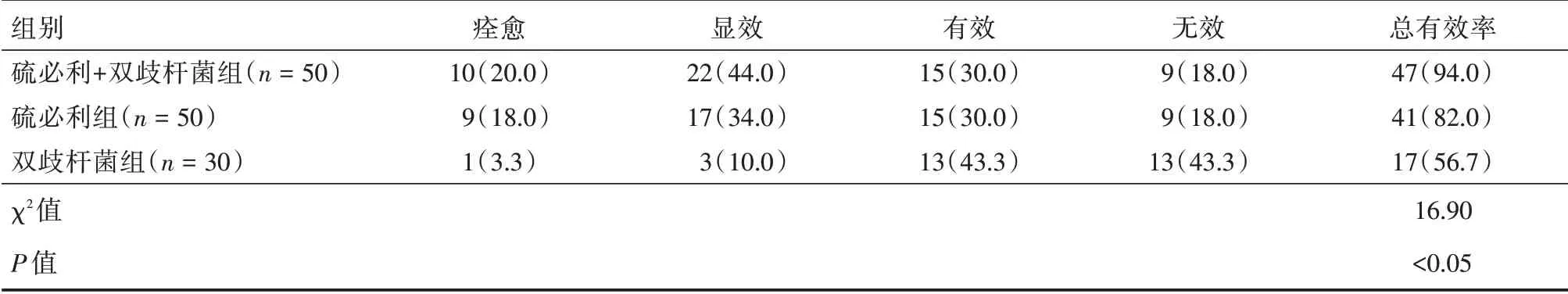
表3 3 组临床疗效比较Tab.3 Comparison of clinical efficacy 例(%)
2.3 3 组治疗前后血清兴奋性氨基酸水平治疗前,3 组患儿血清Glu 水平及Asp 水平比较无明显差异,治疗12 周后3 组患儿Glu、Asp 水平均较治疗前降低(P<0.05),硫必利+双歧杆菌组Glu 水平及Asp 水平均明显降低,且低于硫必利组及双歧杆菌组,组间比较差异有统计学意义(P< 0.05),硫必利组低于双歧杆菌组(P<0.05),见表4。
表4 3 组血清兴奋性氨基酸水平对比Tab.4 Comparison of serum excitatory amino acid levels in three groups ±s,μmol/L
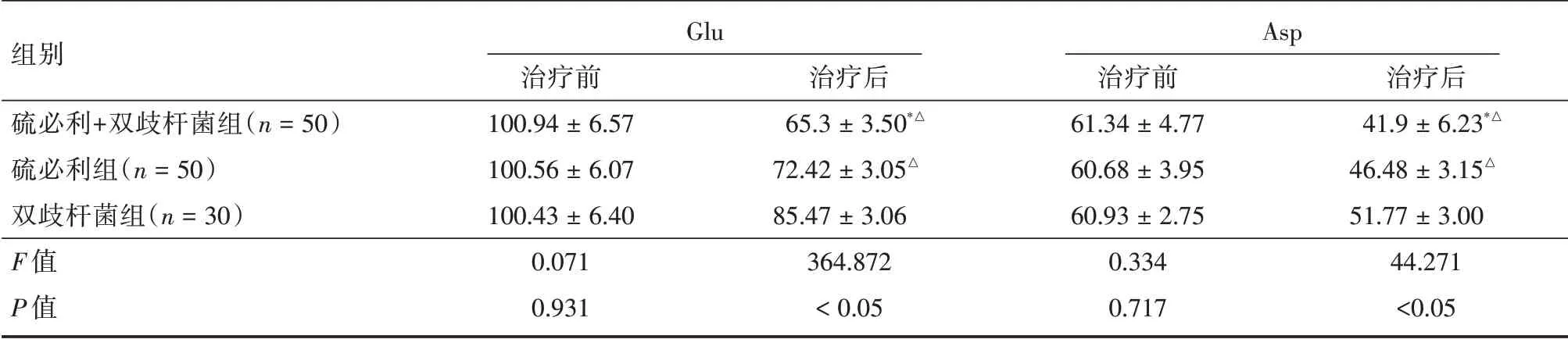
表4 3 组血清兴奋性氨基酸水平对比Tab.4 Comparison of serum excitatory amino acid levels in three groups ±s,μmol/L
注:与硫必利组比较,*P<0.05;与双歧杆菌组比较,△P<0.05
组别硫必利+双歧杆菌组(n=50)硫必利组(n=50)双歧杆菌组(n=30)F 值P 值Glu治疗前100.94±6.57 100.56±6.07 100.43±6.40 0.071 0.931治疗后65.3±3.50*△72.42±3.05△85.47±3.06 364.872<0.05 Asp治疗前61.34±4.77 60.68±3.95 60.93±2.75 0.334 0.717治疗后41.9±6.23*△46.48±3.15△51.77±3.00 44.271<0.05
2.4 不良反应比较硫必利+双歧杆菌组发生不良反应发生率为8%,硫必利组不良反应发生率为10%,双歧杆菌组不良反应发生率为0,比较差异无统计学意义(χ2=0.122,P>0.05)。3组均未出现严重不良反应。见表5。

表5 3 组不良反应比较Tab.5 Comparison of adverse reactions in three groups 例(%)
3 讨论
抽动障碍是一种起病于儿童时期的慢性神经精神疾病[1]。目前抽动障碍发病机制仍未完全探明。有学者认为[6,13],其发病机制可能与遗传、环境、免疫、过敏因素和神经递质失衡有关。研究表明[4,14],大脑基底神经节及边缘系统皮质多巴胺系统功能紊乱可能是抽动障碍的主要发病机制。经典的多巴胺受体阻滞剂硫必利作为一线治疗药物,其属于苯甲酰胺类药物,是一种新型神经精神安定药,可选择性抑制中脑边缘系统多巴胺功能亢进,拮抗纹状体多巴胺能神经运动障碍,从而控制抽动症状的发作。
已有研究表明,肠道菌群与中枢神经系统疾病密切相关[15-18],例如癫痫、自闭症(ASD)、抽动障碍、注意缺陷多动障碍(ADHD)等。XI 等[18]研究发现,抽动障碍儿童肠道微生物群与健康儿童相比存在明显差异,其肠道微生物群中GABA 降解增多。目前已被证实[9]双歧杆菌能产生GABA,而GABA 是大脑皮层中主要的抑制性神经递质,其表达异常可导致抽动障碍的发生。
近年来肠道菌群的研究为利用肠道菌群治疗神经系统疾病提供了新的理论依据[19-20]。益生菌可通过调整肠道微生物菌群[21],使肠道中条件致病菌数量减少,有效降低了各类疾病发病率,已广泛应用于临床治疗。SHAABAN 等[19]发现联合应用乳酸杆菌和双歧杆菌可缓解ASD 患儿疾病严重程度及胃肠道症状。RIANDA 等[20]发现益生菌对儿童和青少年认知功能有改善作用,它可以降低发展为ADHD 或ASD 的风险。
本研究发现,采用双歧杆菌三联活菌散联合硫必利及单用双歧杆菌治疗抽动障碍,在治疗4、12 周后YGTSS 评分均较治疗前有改善。双歧杆菌三联活菌散联合硫必利治疗12 周时YGTSS 评分低于硫必利组及双歧杆菌组,其临床总有效率高于硫必利组、双歧杆菌组,为双歧杆菌三联活菌散添加治疗儿童抽动障碍提供了临床依据。ZHANG等[10]研究发现,抽动障碍的发病过程与EAAs 尤其是Glu、Asp 密切相关。抽动障碍患儿脑内抑制性神经递质GABA 直接和间接投射通路减少,导致对丘脑皮层兴奋性神经元抑制不足,从而引起Glu和Asp 等神经兴奋性氨基酸水平增加,增强大脑皮层兴奋性,产生抽动症状。本研究结果显示,治疗12 周后3 组血清Glu、Asp 水平均较治疗前降低,硫必利+双歧杆菌组Glu 及Asp 水平低于硫必利组及双歧杆菌组,上述研究结果均提示双歧杆菌三联活菌散联合硫必利治疗抽动障碍临床疗效更显著,其能抑制Glu、Asp 释放,降低神经细胞兴奋性,从而有效改善抽动症状。单用双歧杆菌三联活菌散治疗儿童抽动障碍有一定的临床疗效,其可能通过增加GABA 含量,抑制丘脑皮层兴奋性神经元,起到缓解抽动症状作用。
同时本课题组对药物安全性进行研究发现,硫必利+双歧杆菌组及硫必利组不良反应发生率相当,单用双歧杆菌组安全性高,不良反应发生率低。而众所周知,硫必利长期使用可出现头晕、疲劳、嗜睡、乏力等副作用。对于部分轻⁃中度抽动障碍患儿及部分患儿家属考虑硫必利长期使用副作用时可考虑双歧杆菌治疗。但对于中⁃重度抽动障碍患儿建议采用双歧杆菌联合硫必利治疗,其疗效更显著。但需要注意的是,抽动障碍与患儿心理有关,在药物治疗中给予必要的心理支持、认知干预等,以提高疗效。但本研究存在样本量小、观察时间短的缺点,尚缺乏大样本研究,同时未考虑心理、环境等影响抽动障碍相关因素,存在一定局限性,采用双歧杆菌治疗是否能对抽动障碍患者有很好的改善,这均有待于今后完善相关研究。在未来研究中采用多因素回归分析以期找到影响抽动障碍相关因素,采用二代高通量测序寻找肠道生物标志物,并对两者行相关性分析,进一步深入探讨肠道菌群在抽动障碍发病中的作用机制。
综上所述,双歧杆菌三联活菌散联合盐酸硫必利治疗儿童抽动障碍临床疗效更显著,单用双歧杆菌治疗有一定的临床疗效,且安全性较高,为抽动障碍患儿的诊治提供潜在新方法。
