c.1311C>T和c.1004C>A与广西G6PD缺乏症的发病风险相关性
2022-02-22滕元姬何丽桥李光景仇雯丽王春芳王俊利
石 凤,滕元姬, 何丽桥, 李 兰, 李光景, 仇雯丽, 王春芳, 王俊利
先天性溶血性贫血包括红细胞酶异常、红细胞膜异常和血红蛋白异常,其中葡萄糖-6-磷酸脱氢酶 (glucose-6-phosphate dehydrogenase,G6PD) 缺乏症是常见的因红细胞酶异常而引起的溶血性疾病[1]。G6PD是以X染色体连锁不完全的显性遗传性溶血性疾病,俗称“蚕豆病”, 临床表现为G6PD酶表达水平降低,在中国南方广东、广西地区的发病率较高。由于其遗传特性,在男性患者的发病率明显高于女性患者[2]。G6PD酶表达水平不足可影响红细胞的不稳定性,导致红细胞氧化损伤、引起溶血反应,严重者可引起高胆红素血症进而产生神经毒性,威胁患者生命健康[3]。G6PD基因突变可能会引起G6PD酶表达水平降低,广西最常见的突变基因位点包括95A>G、1376G>T、1388G>A[4]。该研究分析G6PD基因c.1311C>T和c.1004 C>A位点突变与G6PD缺乏症和酶表达水平的相关性,探讨该位点突变是否会引起表型改变,为G6PD缺乏症提供实验数据支撑,为筛查G6PD缺乏症患者提供更加全面的检测指标。
1 材料与方法
1.1 研究对象随机选取2017年1月—2019年6月经确诊的417 例G6PD缺乏症患者作为病例组,并选取同期进行G6PD筛查的295例健康人群作为对照组,其中,病例组男性261例,女性156 例;对照组男性98例,女性197例。病例组年龄为1~90(35.05±22.33) 岁,对照组年龄为1~86(36.11±18.48)岁,两组年龄差异不具有统计学意义(P=0.491)。所有研究样本均于右江民族医学院附属医院检验科检测,并经临床医师诊断确诊。本研究的所有研究对象均经受试者本人知情同意并签署知情同意书。
1.2 全基因组DNA提取采集受试者EDTA-K2抗凝全血2 ml,3 000 r/min离心5 min,去掉上清液,吸取20 μl压积红细胞于1 ml去离子水完全溶解,使用G6PD酶检测试剂盒(上海执诚生物科技有限公司),采用日立7600-series全自动生化分析仪 (日本株式会社日立高新技术公司) 检测G6PD酶活性的表达。再提取全基因组DNA,于-80 ℃超低温冰箱保存待测。
1.3 多重单核苷酸多态性(single nucleotide polymorphism, SNP)分型检测使用SNPscanTM多重SNP方法对G6PD SNP c.1311C>T和c.1004C>A进行分型。操作步骤为:① 设计3条探针引物序列,包括5′端的通用引物序列和等位基因鉴别引物序列,以及1条3′端特异性序列、位点鉴别连接序列。两个等位基因特异性鉴别序列与通用引物连接生成产物基因型,引物序列如表1所示。② 高温处理短片段基因组DNA并与探针混合物变性复性。③ 加入连接酶反应体系,特异性连接同一模板上紧邻的配对探针,生成连接产物。④ 通过荧光标记的通用引物扩增连接产物,使用荧光毛细管电泳鉴别不同长度的扩增产物,通过其峰谱鉴定不同位点的基因型。PCR反应程序为:98 ℃、2 min;94 ℃、20 s,62 ℃、40 s,72 ℃、1.5 min,9个循坏;94 ℃、20 s,57 ℃、40 s,72 ℃、1.5 min,25个循坏。

表1 c.1311C>T和c.1004C>A引物序列
1.4 统计学处理G6PD病例组和对照组的基因型和等位基因频率采用SPSS 22.0统计所得,两组的基因型和等位基因分布差异通过Logistic回归计算,并经年龄和性别校正计算P值和风险值。通过在线SHEsis软件计算两个SNPs位点的单倍型分布频率。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 G6PD病例组与对照组的性别差异比较本研究纳入对象共712例,病例组男性261例,占62.6%,女性156例,占37.4%;对照组男性98例,占33.2%,女性197例,占66.8%。与对照组相比,病例组男性发病率升高(62.6%),差异具有统计学意义(P<0.001,OR=3.363, 95%CI=2.459~4.600)。
2.2 两组G6PD SNP比较本研究选取G6PD基因两个多态性位点c.1311C>T和 c.1004C>A进行基因型和等位基因比较,如表2所示,在病例组和对照组中, c.1311C>T位点的基因型TT和CC+CT和等位基因T与G6PD缺乏症的发病风险降低有关[TTvsCC:(P=0.001,OR=0.373, 95%CI=0.204~0.683); TTvsCC+CT:(P=0.001,OR=0.371, 95%CI=0.203~0.678); TvsC:(P=0.002,OR=0.601, 95%CI=0.435~0.829)。然而,c.1004C>A位点的基因型和等位基因在两组间的分布频率差异无统计学意义。

表2 两组间G6PD SNPs基因型和等位基因分布频率比较[n(%)]
2.3 G6PD SNP与G6PD酶表达水平的相关性检测G6PD病例组和对照组两组G6PD酶的表达水平,并比较G6PD SNP c.1311C>T不同基因型之间G6PD的表达水平差异,研究结果显示,G6PD病例组的G6PD酶表达水平低于对照组(P<0.001),见图1A。在G6PD病例组中,相对于c.1311基因型TT和c.1311基因型CC患者,携带c.1311基因型CT患者有较高G6PD酶表达水平(P<0.001),见图1B,但其仍低于对照组c.1311基因型 CT的表达水平(P<0.001),见图1C。
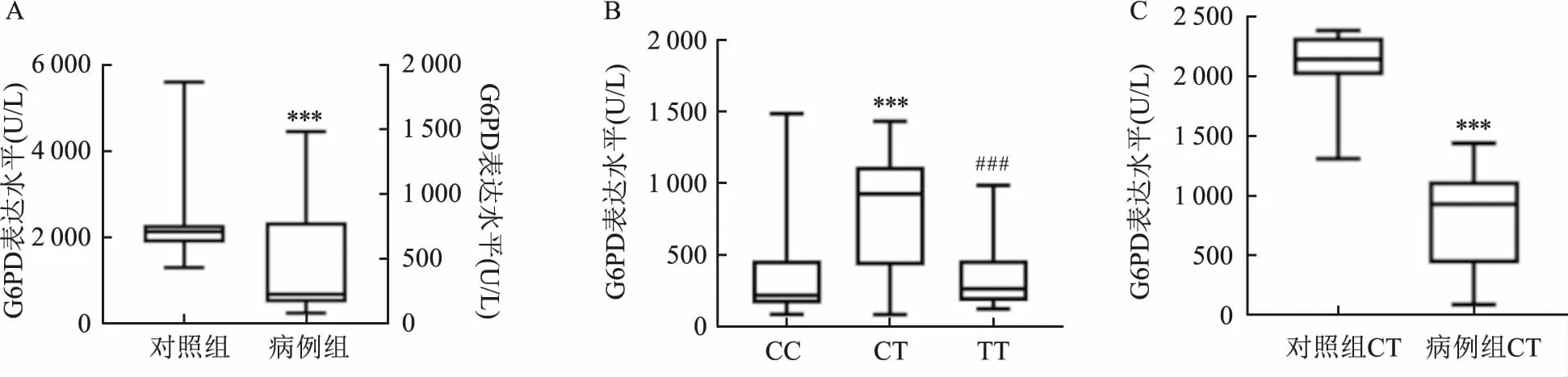
图1 c.1311C>T基因多态性与G6PD酶表达水平A:两组的G6PD酶表达水平差异;与对照组比较:***P<0.001;B:病例组G6PD基因多态性位点c.1311不同基因型的G6PD酶表达水平差异;C:对照组和病例组CT的G6PD酶表达水平差异;与CC组比较:△△△P<0.001;与CT组比较:###P<0.001;与对照组比较:***P<0.001
2.4 G6PD SNPs单倍型分析将本研究G6PD突变的两位点c.1311C>T和c.1004C>A进行在线SHEsis单倍型分型。结果显示,该两多态性位点有3种单倍型组合,包括C-C、T-C和T-A,主要为C-C单倍型,在G6PD病例组和对照组分别占89.6%和82.9%。C-C单倍型在两组间差异具有统计学意义,携带C-C单倍型与G6PD缺乏症发病风险增加有关(P<0.001,OR=2.057, 95%CI=1.494~2.832),而携带T-C单倍型与G6PD缺乏症发病风险降低有关 (P<0.001,OR=0.486, 95%CI=0.353~0.669)。见表3。

表3 病例组和对照组的G6PD SNP单倍型分析[n(%)]
3 讨论
G6PD酶是在磷酸戊糖途径中的关键酶,能使反应产物还原型辅酶Ⅱ作为保持谷胱甘肽还原性的供氢体,维持红细胞的稳定性。2017年,中国G6PD缺乏症的总体发病率达到0.77%,而新生儿G6PD缺乏症发病率高达3.39%,其中山西的发病率最低,而广西的发病率最高[5]。G6PD酶缺陷引起患者严重溶血反应、高胆红素血症和神经性脑病。既往研究[6]表明SNP影响基因功能。G6PD缺乏症主要是由于基因突变以及遗传因素导致G6PD酶表达活性或表达水平降低引起,G6PD位于X染色体长臂,遗传方式呈X连锁不完全显性遗传。男性只有一条X染色体,女性有两条X染色体。因此,男性只要发生G6PD染色体变异即呈致病表现。男性发病率较女性高。然而,G6PD酶缺陷患者在没有外源诱导发病机制时不发病,如蚕豆、某些化学药物等[7]。在广西人群中,常见的G6PD突变位点包括c.95A>G、c.871G>A、c.1024C>T、c.1376G>T和c.1388G>A[5]。c.1311C>T是指G6PD基因11外显子发生C→T突变。近年来,研究[8-10]表明c.1311C>T联合其他多态性位点的单倍型分型与G6PD酶活性降低有关。广西地区处于多种遗传性疾病的高发地区。因此,研究广西群体的基因多态性具有重要价值。
该研究检测了G6PD酶缺陷患者的c.1311C>T和c.1004C>A两位点。结果显示,在该研究群体中,男性G6PD发病风险高于女性患者,相对于对照组,G6PD缺乏症患者的G6PD酶表达水平显著降低;相对于c.1311基因型TT和CC患者,携带c.1311基因型CT患者有较高的G6PD酶表达水平,然而,c.1311基因型CT患者的G6PD酶表达水平仍比正常组人群的G6PD表达水平低。该研究显示c.1004C>A与G6PD的发病风险无关。将c.1311C>T和c.1004C>A位点联合进行单倍型分析,结果显示,单倍型C-C与G6PD发病风险增加有关,而单倍型C-T与G6PD发病风险降低有关。c.1004C>A是国内少见的G6PD基因突变类型,在李文瑞等[11]研究结果中,672例G6PD缺乏症患者出现c.1004C>A基因突变例数仅有6例。在该研究中,共检出c.1004C>A基因突变8例,其中包括4例杂合子突变CA和4例纯合子突变AA。以往研究[12]表明G6PD基因c.1311的等位基因C突变为T,其氨基酸及蛋白并未发生改变,属于同义突变,与G6PD缺乏无关,并且该基因突变位点主要出现于地中海贫血性疾病中。然而,该研究c.1311C>T位点突变降低G6PD疾病的发病风险,并且本研究群体的疾病诊断排除了地中海贫血。然而,该基因位点不同基因型的G6PD表达水平存在统计学差异,与以上研究结果不一致。其可能原因:第一,G6PD病例组研究群体所选样本均来自长期居住在广西地区,可能存在影响该位点的遗传特异性;第二,病例组人群可能存在其他位点的基因突变,影响c.1311C>T位点突变结果以及干扰G6PD表达水平。
