网络药理学分析及实验验证银丹心脑通保护MIRI的作用机制
2022-02-22徐启丽邹常超莫丽莉周海燕刘兴德
徐启丽,邹常超,莫丽莉,周海燕,刘兴德,
冠状动脉粥样硬化性心脏病(coronary heart disease,CHD),简称冠心病,是危害人类健康、造成中国人疾病负担的主要疾病之一,且发病率呈逐年上升趋势[1-2]。随着再灌注治疗的不断发展,CHD患者的病死率下降,远期预后得到明显改善,然而心肌再灌注引起的心律失常、无复流、心肌细胞凋亡等,对患者的预后有着深远的影响。临床研究表明[3-5],银丹心脑通可以降低冠心病患者心绞痛发作频率、心绞痛持续时间,改善慢性心力衰竭患者心功能,降低心血管事件发生率。然而目前对该药治疗心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)8的药理机制研究较少,该研究旨在利用网络药理学方法探讨该作用机制,为银丹心脑通软胶囊(Yindan Xinnaotong soft capsules,YD)应用于临床应用提供理论依据。
1 材料与方法
1.1 网络药理学检索下列数据库:TCMSP数据库(http://tcmspw.com/tcmsp.php),中国知网(http://search.chkd.cnki.net),SwissTargetPrediction数据库(http://www. swisstargetprediction.ch/),Uniprot数据库(https://www.uniprot.org/),GeneCards数据库(https://www.genecards.org/),STRING数据库(https://string-db.org/),Metascape数据库(https://metascape.org/);使用下列软件:Cytoscape3.7.2软件,R3.6.0软件,微生信在线作图软件(http://www.bioinformatics.com.cn/),Autodock 2.5.0,Autodock vina 1.1.2,Pymol开源版等。
1.2 细胞实验人心肌AC-16细胞株购自美国模式培养物研究所(ATCC)。胎牛血清、1%青霉素-链霉素混合液、DMEM-basic(1×)培养液、胰蛋白酶(美国Gibco公司);银丹心脑通软胶囊(贵州百灵企业集团制药股份有限公司);DMSO(美国Sigma公司);细胞增殖与毒性检测试剂盒CCK-8(日本同仁化学研究所);乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒(南京建成生物工程研究所);蛋白印迹相关试剂均购自北京索莱宝科技有限公司;抗体:AKT1、p-AKT1、p-STAT3多克隆抗体(美国CST公司),PI3K(美国abcam公司),STAT3多克隆抗体(沈阳万类生物科技有限公司),GAPDH多克隆抗体、二抗山羊抗兔二抗(武汉三鹰生物技术有限公司)。
1.3 方法
1.3.1网络药理学
1.3.1.1化学成分的收集 在CNKI数据库上对YD的药物组成及相关活性物质进行搜集,通过TCMSP数据库进行ADME参数设置(OB≥30%且 DL≥0.18 ),筛选出符合条件的活性物质作为活性成分。
1.3.1.2靶点的预测筛选及中药活性成分-靶点网络构建 将筛选得到的活性成分导入Swiss Target Prediction,物种选择为“人类”(Homo sapiens),进行靶标预测。利用 UniProt 数据库对靶点处理,得到靶基因的标准名称。利用GeneCards数据库对“心肌缺血再灌注损伤”(myocardial ischemia reperfusion injury,MIRI)进行疾病靶点筛选。然后,将得到的药物活性成分相关靶点与疾病靶点取交集,重合的靶点即为YD活性成分作用于MIRI的相关靶点。
1.3.1.3靶点蛋白相互作网络构建及关键靶点筛选 利用STRING在线数据库对靶点的蛋白间相互作用(protein protein interaction,PPI)进行分析。将靶点信息导入STRING数据库,物种选择“Homo sapiens”,将蛋白互作综合得分>0.7 作为筛选条件从而得到靶点的PPI信息,将得到的PPI信息导入 Cytoscape 软件,得到 PPI 网络图可视化。
1.3.1.4靶点基因本体论(gene ontology,GO)和KEGG通路富集分析 Metascape数据库中提交交集靶集点,进行GO和KEGG富集分析。
1.3.1.5分子对接验证 从Pubchem下载活性成分结构式,保存为*mol2格式,利用pymol转换为*pdb格式;从PDB数据库下载蛋白3D结构*pdb格式。利用Auto dock进行加氢、计算电荷等处理,保存为pdbqt文件,并用Autodock Vina进行小分子与蛋白对接,将对接结果导入Pymol进行分子对接做图。
1.3.2细胞实验
1.3.2.1细胞培养 取对数期生长良好的AC-16细胞,种植在加有10%胎牛血清、1%青霉素-链霉素混合液的DMEM中,于37 ℃、提供5% CO2饱和湿度细胞培养箱中培养。
1.3.2.2低氧/复氧模型构建 收集对数期生长良好的AC-16细胞种植在培养板中,于37 ℃、5% CO2、95%的新鲜空气培养箱中培养。贴壁后将进行低氧处理的AC-16细胞更换为不含有胎牛血清的培养液。按预定分组进行加药,需进行低氧处理的AC-16细胞于含有1% O2、94% N2、5% CO2缺氧培养箱中孵育24 h后,将细胞放置在37 ℃,含有5% CO2、95%新鲜空气培养箱中培养4 h。进行下一步检测。
1.3.2.3CCK-8比色法检测细胞活力 收集AC-16细胞调整细胞密度为1×105个/ml,按每孔100 μl细胞悬液接接种到96孔板中,培养过夜。按照不同浓度的YD进行分组:0、50、200、400 mg/L,复孔5个/组,每组均设置不加细胞的空白组进行对照,以消除药物本身的颜色对吸光度的影响。加药后按照1.3.2.2中方法进行缺氧,待细胞复氧结束后,在每孔中加入10 μl CCK-8溶液,37 ℃孵育2 h,酶标仪检测OD值。细胞活力=[(实验孔-空白孔)]/[(对照孔-空白孔)]。选取细胞活力最强的药物浓度进行后续实验。
1.3.2.4乳酸脱氢酶(LDH)渗漏检测 将细胞分成低氧/复氧组(H/R组)、低氧/复氧+银丹心脑通组(H/R+YD组),细胞复氧结束后,收集细胞培养液上清液,按照试剂盒中检测步骤,进行LDH渗漏检测。
1.3.2.5Western blot检测蛋白表达 将AC-16细胞分成对照组(Control组)、银丹心脑通组(YD组)、H/R组、H/R+YD组。低氧复氧处理结束后,吸去培养液,裂解液充分裂解后,转移至1.5 ml EP管中,4 ℃离心,14 000 r/min,20 min。将蛋白上清液转移至新的EP管中,BCA法检测蛋白浓度。按比例加入5×Loading buffer,100 ℃煮沸10 min。每孔取40 μg蛋白进行聚丙烯胺凝胶电泳,转膜结束后用质量分数为5%的脱脂牛奶封闭1 h,一抗孵育过夜,次日二抗孵育1 h,Bio-Rad成像仪显影成像,Image Lab软件进行灰度分析。
2 结果
2.1 YD的活性成分筛选利用TCMSP 数据库对YD所含成分进行检索。其中,山楂、艾片未检索到相关结果,大蒜未筛选到符合ADME参数的成分,通过文献检索获取这3味药的有效成分,并将其纳入统计;根据ADME参数对余下的6味药物进行筛选。去重后共得到YD 105个活性成分,其中银杏20个,丹参48个,绞股蓝10个,细辛11个,三七8个,大蒜4个;山楂5个,艾片4个。见表1。

表1 药物-成分-靶点统计
2.2 潜在靶点的预测取每个活性成分在Swiss Target Prediction数据库中得到的预测靶点的前15名,去重后共得到药物靶点382个。从GeneCards数据库中得到“MIRI”疾病靶点1 223个,药物-疾病共同靶点160个。见图1。其中包括TNF、MAKP、IL-2、IL-6、MMP、PPAR、PIK3等。
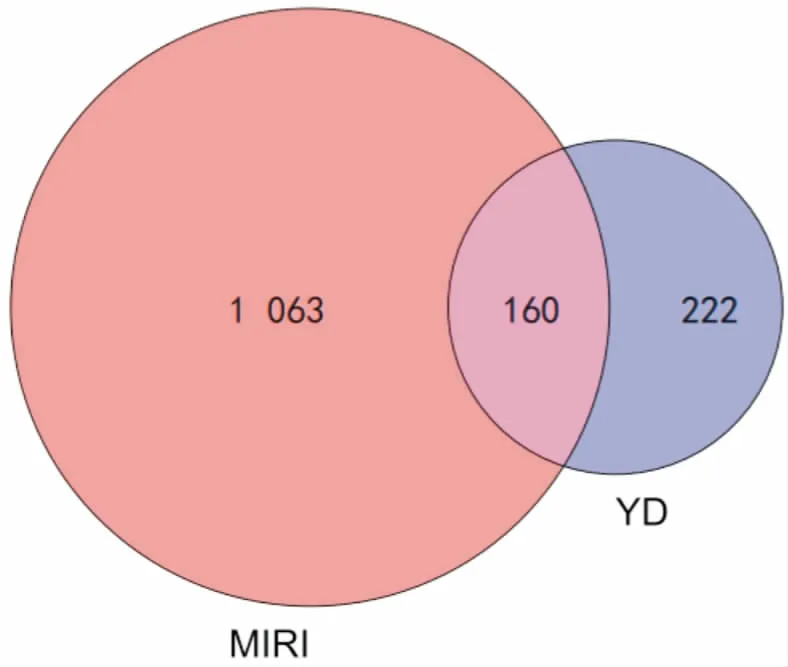
图1 YD与MIRI靶点韦恩图
2.3 活性成分-靶点网络分析利用Cytoscape软件构建YD药物-成分-疾病-靶点的相互作用网络,该网络含有485个节点,1 822个化合物-靶标关系。其中有95个化合物可同15个及以上的靶点相互连接,推测这些化合物可能是YD的主要活性成分药效物质基础,其中排名前30的活性成分。见表2。有46个靶蛋白可同10个及以上的活性成分产生相互作用。见表3。

表2 度值(degree)排名前30的活性化合物
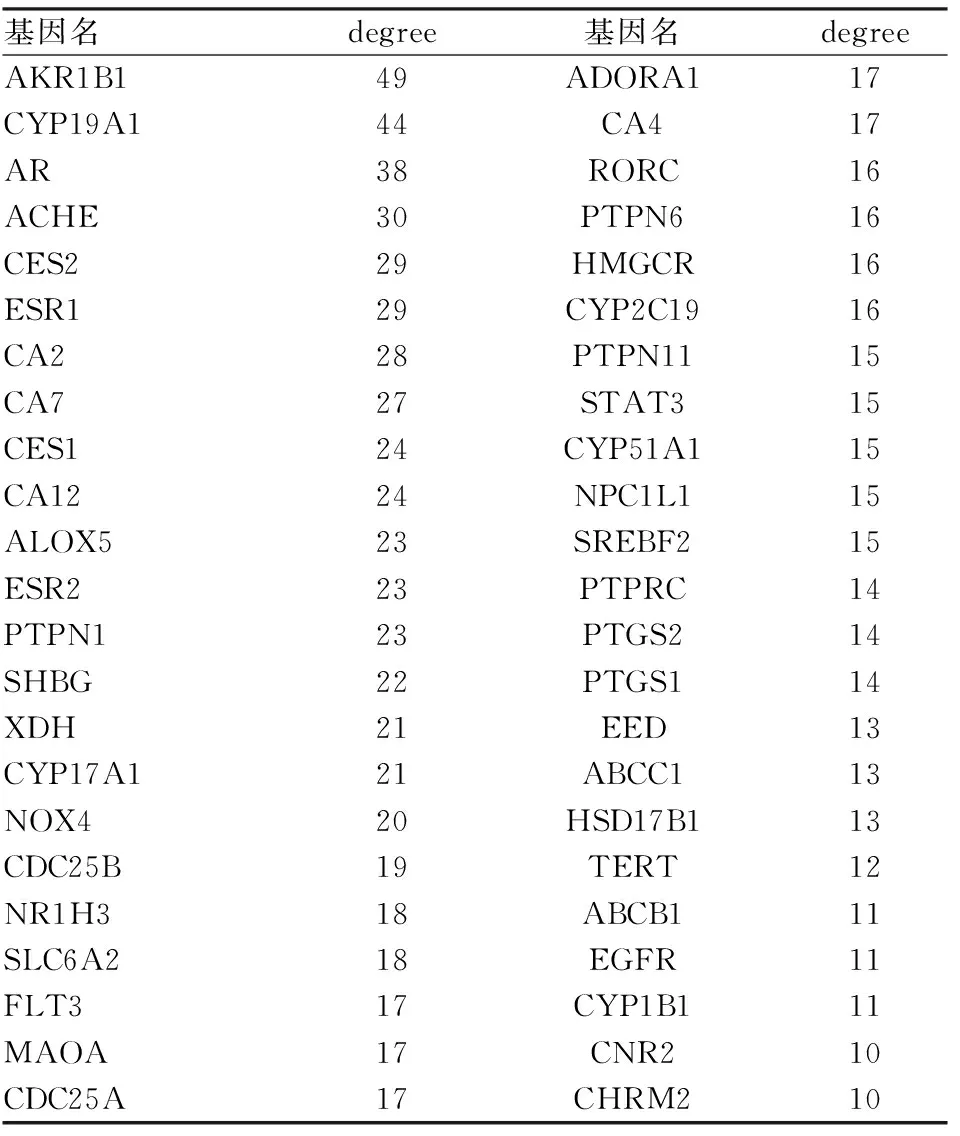
表3 能与10个及以上的活性成分相关联的基因
2.4 YD治疗MIRI的PPI网络构建通过在STRING数据库中录入药物-疾病共同靶点,选择综合得分大于0.7的靶点,并去掉独立于网络外的靶点,得到的PPI网络关系数据导Cytoscape软件进行可视化分析,构建PPI网络关系图。见图2。在该网络关系图中,包含139个节点和725个关系,大于平均度值8的靶点共70个,其中包括AKT1、HSP90、MAPK8、BCL2-L1、IL2等。根据度值(degree)、中介中心性(betweenness)、接近中心性(closeness)分别筛选出前10名的基因,去重后得到13个关键靶点,分别是AKT1、STAT3、VEGFA、TNF、MAPK8、PIK3CA、F2、PPARA、APP、PTGS2、SRC、ESR1、HSP90AA1。推测YD可能通过这些靶点发挥抗MIRI作用。见表4。

图2 YD治疗MIRI的PPI网络

表4 PPI网络中Top的靶点
2.5 靶点通路富集分析将160个共同靶点导入Metascape数据库中进行GO分析,设置Pvalue≤0.01,得到的分析结果,分别取前10名导入微生信在线作图软件绘制富集分析图。KEGG分析主要与TRP通道的炎性介质调节、脂肪细胞脂解调节、PPAR信号通路、流体剪应力与动脉粥样硬化、血小板活化、钙信号通路等相关。生物过程(biological process,BP)主要与细胞对氮化合物的反应、肌肉细胞增殖、细胞因子介导的炎症反应、氧化应激、细胞凋亡、脂溶反应等密切相关。细胞组成(cellular component,CC)主要涉及膜筏、细胞器外膜、内体管腔、膜的外在成分、血小板α颗粒、质膜蛋白复合物、溶酶体管腔、受体复合物等。分子功能(molecular function,MF)主要富集为生长因子受体结合、肽结合、激素受体结合、蛋白酶结合、内肽酶活性、蛋白磷酸酶结合、蛋白酪氨酸激酶活性、胰岛素受体底物结合、氧化还原酶活性结合等。见图3、4。

图3 GO生物学过程分析、细胞组分分析、生物功能分析
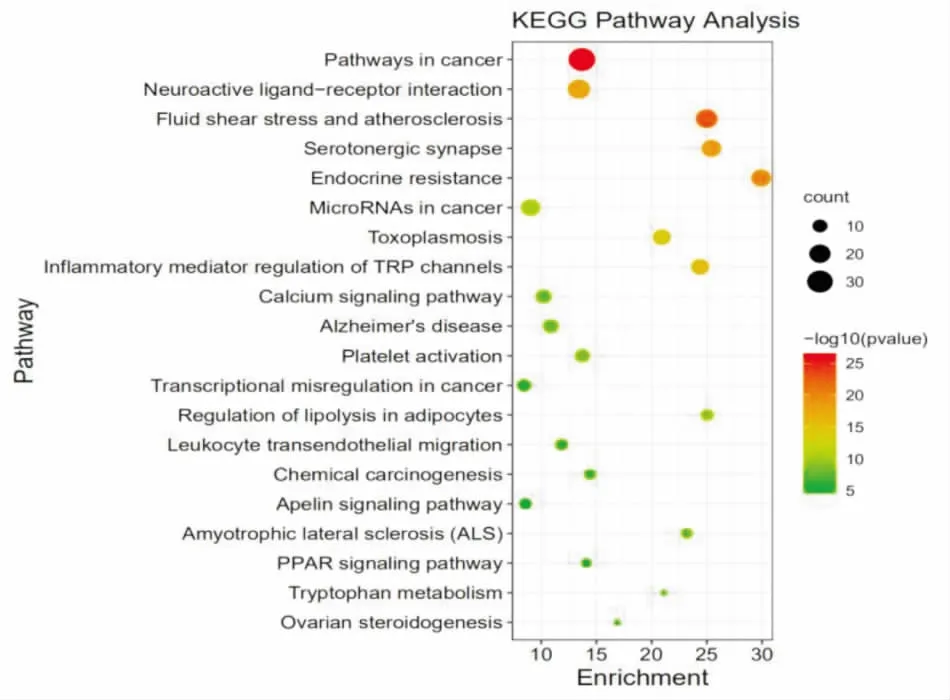
图4 KEGG富集分析
2.6 核心成分的分子对接验证将YD度值排名前3的化合物与PPI网络中排名前6的靶点进行分子对接验证。通常认为结合能<-5 kcal/mol提示两者可以结合,<-7 kcal/mol提示两者有较好的结合能力。结果显示,AKT1、STAT3、VEGFA、APP、MAPK8、PIK3CA均能与槲皮素、木犀草素、山柰酚结合。其中VEGFA、APP、PIK3CA能与主要成分较好的结合。见表5和图5。
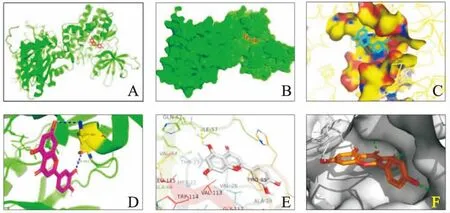
图5 分子对接图A-D:STAT3和木犀草素对接模式;E:VEGFA和木犀草素对接模式;F:PIK3CA和山萘酚对接模式

表5 蛋白与小分子结合能(kcal/mol)
2.7 YD对H/R损伤诱导的AC-16细胞活力的影响通过CCK-8比色法分析在H/R损伤诱导下,暴露于不同浓度YD的AC-16细胞系的细胞活力。结果表明,200 mg/L的剂量可增加H/R损伤诱导的AC-16细胞的细胞活力(P<0.000 1),见图6A。 因此,将增加AC-16细胞活力的200 mg/L YD用于以下实验。
2.8 YD对H/R损伤诱导的AC-16细胞的LDH渗漏的影响检测LDH含量以评估细胞膜的完整性。结果表明,200 mg/L的YD能减少H/R损伤诱导的AC-16细胞的LDH渗漏,P<0.05。见图6B。
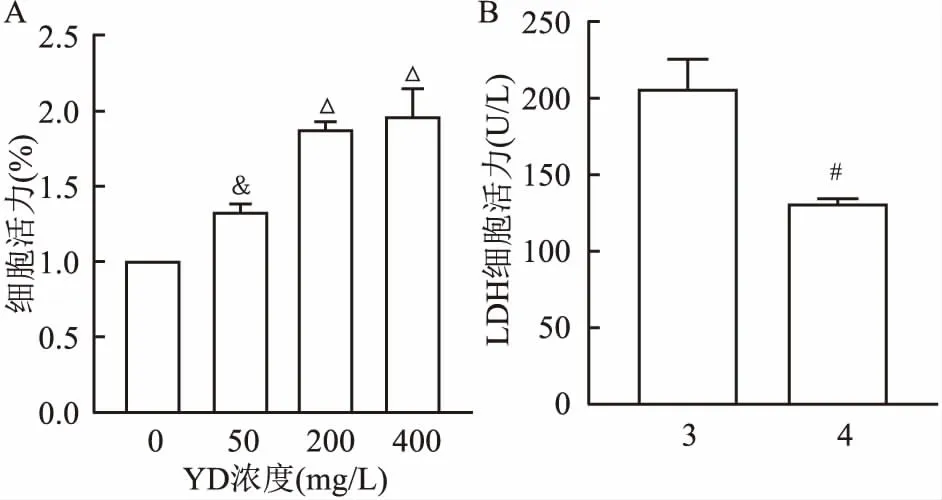
图6 YD对H/R损伤诱导的AC-16细胞活力、LDH渗漏的影响A:不同浓度YD对H/R损伤诱导的AC-16细胞的活力的影响;B:200 mg/L的YD对H/R损伤诱导的AC-16细胞LDH渗漏的影响;3:H/R组;4:H/R+YD组;与0 mg/L组比较:&P<0.05;与50 mg/L组比较:ΔP<0.05;与3组相比:#P<0.05
2.9 YD对H/R损伤诱导的AC-16细胞增殖的影响光镜观察YD对H/R损伤的AC-16细胞的增殖情况的影响。结果显示,与对照组相比,H/R损伤明显抑制细胞增殖,200 mg/L的YD可减轻这一现象。见图7。

图7 YD对H/R损伤诱导的AC-16细胞增殖的影响 ×100A:Control组;B:YD组;C:H/R组;D:H/R+YD组
2.10 YD对AC-16细胞STAT3、p-STAT3、PI3K、AKT1、p-AKT1蛋白表达的影响结果显示,在无H/R诱导情况下,加药组STAT3表达较未加药组降低;H/R诱导后,H/R损伤可导致STAT3水平降低,加药组与未加药组未见明显差异,见图8B。在无H/R诱导的情况下,加药组对STAT3磷酸化水平无明显影响,H/R损伤可以刺激STAT3磷酸化,在H/R诱导情况下,YD可以促进STAT3磷酸化水平,见图8C。在无H/R损伤诱导情况下,加药组与未加药组未见明显差异;H/R诱导可抑制Akt1磷酸化水平,200 mg/L YD能逆转这一现象,促进p-Akt1表达,见图8D。在无H/R诱导情况下,加药组PI3K表达增加;H/R诱导后,加药组PI3K表达明显降低;200 mg/L YD能逆转这一现象,促进PI3K表达,见图8E。
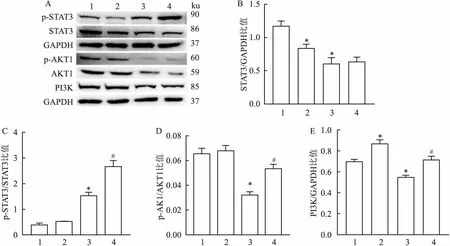
图8 YD对AC-16细胞STAT3、p-STAT3、PI3K、Akt1、p-Akt1蛋白表达的影响A:Western blot检测各组细胞蛋白表达水平;B:STAT3蛋白表达水平;C:p-STAT3蛋白表达水平;D:PI3K蛋白表达水平;E:p-Akt1蛋白表达水平;1:control组;2:YD组;3:H/R组;4:H/R+YD组;与Control组比较:*P<0.05;与H/R组比较:#P<0.05
3 讨论
MIRI是CHD病理生理过程中加重心肌组织进一步损伤的重要机制。再灌注期间,大量氧自由基生成引起氧化应激反应,白细胞激活,释放大量促炎因子,导致心肌缺血缺氧损伤进一步加重。YD应用于临床多年,疗效安全确定,然而目前对该药的药理作用研究报告甚少,为了探究YD治疗MIRI的药理机制,该研究通过TCMSP数据库和文献检索对其主要活性成分筛选,匹配出对应基因,再与疾病基因映射,最终得到该药物作用于MIRI的关键靶点和通路。
虽然在TCMSP 数据库中没有筛选出大蒜和艾片的活性成分,但大量文献资料报道了大蒜及艾片治疗心血管疾病药效明确。艾片具有抗炎、抗氧化作用[6],药理学研究表明,艾片对改善大鼠急性心肌梗死(acute myocardial infarction,AMI)药效明显优于天然冰片和合成冰片,且无明显量效关系[7]。大蒜辣素能抑制心肌梗死后大鼠的心肌纤维化[8],大蒜素可以抑制自噬,减轻心肌肥大,抑制心室重塑[9];蒜氨酸具有调节血脂和抗氧化的作用[10]。因此该研究增加了艾片中的4种活性成分以及大蒜中的大蒜素、大蒜精油、蒜氨酸和大蒜辣素。而在药物-靶点网络中也证实艾片中的α-蒎烯和左旋龙脑与核心靶点中的细胞色素P450c17α(CYP17A1)相互映射。
对PPI网络中筛选得到的重要靶标进行分析。其中度值位居第一的Akt1是影响心肌细胞活性与功能的主要决定因素之一,激活Akt1可以调控下游的因子影响细胞的增殖、凋亡、自噬等过程[11];传导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)在多种心血管疾病的病理生理过程中发挥重要调节作用。研究[12]表明,激活STAT3可降低心肌梗塞大鼠模型的梗塞面积。该研究中表明,YD能减轻H/R诱导的AC-16心肌细胞损伤,增加细胞活力,减少LDH渗漏。其机制与PI3K-AKT1和STAT3信号通路有关。
对160个共同靶点进行富集分析显示,YD主要通过流体剪应力与动脉粥样硬化、TRP通道的炎性介质调节、脂肪细胞脂解调节、血小板活化、钙信号通路、PPAR受体信号通路发挥抗MIRI的作用。流体剪应力能与TNF-α协同作用,促进内皮细胞自噬,加速内皮细胞的脱落[13],加快AS的进程。钙信号通路参与心肌细胞的增殖、凋亡过程,调节钙信号通能减轻细胞内钙超载,保护心肌缺血再灌注损伤[14]。过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPARs)参与脂质氧化和细胞增殖过程,激动PPAR信号通路能使caspase蛋白表达下调,保护心肌细胞[15]。
综上所述,YD治疗MIRI是多成分-多靶点-多通路协同作用的结果。该研究从多个角度对其潜在作用靶点及分子机制进行预测,并从细胞水平、蛋白水平进行验证,为后续实验提供新的探索思路,也为该药物应用于临床提供理论依据。
