NRAGE对结直肠癌细胞增殖和侵袭能力的作用机制
2022-02-22周堤侠吕海栋金秉巾刘国庆
周堤侠,吕海栋,金秉巾,刘国庆
全世界每年结直肠癌(colorectal cancer,CRC)发病例数达110万,死亡患者例数达88万[1]。近年来我国CRC的发病率亦有逐渐升高的趋势,每年新发病例数约38万,死亡例数约20万[2]。CRC早期表现不明显,发现时多为中晚期,寻找新的CRC肿瘤标志物有较大的临床意义。神经生长因子受体介导的黑色素瘤抗原编码基因同源蛋白(neurotrophin receptor-interacting MAGE homolog,NRAGE)编码基因位于16q23.1,属于黑色素瘤抗原基因家族成员,参与p75神经营养蛋白受体介导神经细胞的程序性细胞死亡[3]。NRAGE在口腔鳞癌[4]、肝癌[5]等多种类型的恶性肿瘤中均存在异常表达,并通过促进肿瘤细胞的增殖及转移,促进肿瘤的恶性进展,有望成为新的肿瘤诊断治疗的分子标志物。而目前CRC中NRAGE的表达及作用机制报道较少。该研究探讨NRAGE对CRC细胞增殖和侵袭能力的作用机制,为临床诊治提供理论依据。
1 材料与方法
1.1 病例资料选取2018年7月—2019年12月青海省人民医院诊治的84例CRC患者的临床病理材料。纳入标准:① CRC的诊断经病理学检查明确;② 首次诊治;③ 患者及家属知情同意。排除标准:① 合并炎症性肠病等胃肠道疾病;② 合并其他恶性肿瘤;③ 无放化疗等肿瘤治疗史。男50例,女34例;年龄29~79(53.1±7.3)岁;直肠癌30例,结肠癌54例;合并淋巴结转移者19例,未合并淋巴结转移者65例;合并远处转移9例,未合并远处转移75例;肿瘤直径:≤3 cm 59例,>3 cm 25例;肿瘤分期:Ⅰ-Ⅱ期55例,Ⅲ-Ⅳ期29例;肿瘤分化程度:高中分化53例,低分化31例。
1.2 主要实验材料NRAGE、Cyclin D1及N-cadherin单克隆抗体(ab104627、ab134175、ab18203, 美国Abcam公司);Vimentin、E-cadherin单克隆抗体(sc-6260、sc-8426,美国Santa Cruz公司)。慢病毒过表达(pCDH-GFP-NARGE)及敲除NARGE基因的SW480细胞(Plko.1-puro-shNARGE)及对照空载SW480细胞(上海吉凯生物科技公司);MTT细胞增殖检测试剂盒(货号:TB112, 美国Promega公司);Transwell细胞培养板(货号:3822,美国康宁公司);Matrigel基质胶(货号:356234,美国BD公司);293T细胞、正常CRC细胞系FHC及肿瘤细胞系HT29、SW480、SW620、LOVO(美国ATCC公司,细胞培养条件:10%胎牛血清RPMI 1640培养基,37 ℃、5% CO2细胞培养箱);SYBR Green PCR Mix(4312704,美国ABI公司)。
1.3 病毒包装及SW480细胞感染将293T细胞接种于 10 cm 细胞培养皿,利用增强型磷酸钙转染试剂盒(MaxiCap, 北京迈晨科技公司)进行病毒包装。体系:目的质粒6 μg,VSVG 1.5 μg,PAX 24.5 μg,HBS 1 ml,配好体系后, 加入CaCl267 μl充分混匀,静置15 min后加入到培养皿中。6 h后换液。48 h后收集病毒上清液。4 ℃、1 500 r/min 离心15 min,上清液用 0.45 μm 滤器过滤。按照病毒液 ∶浓缩液=4 ∶1的比例加入病毒浓缩液,4 ℃过夜,取出离心管,4 ℃、7 000 r/min 离心10 min,弃上清液,加PBS重悬后分装,-80 ℃保存。SW480细胞接种于6孔板,加polybrene(1 ∶1 000)和对应的病毒上清液,培养基2 ml,24 h后换液,加嘌呤霉素筛选SW480细胞(1 ∶2 000)3 d,用于下一步实验。
1.4 RT-PCR检测TRIzol法提取细胞中总RNA,以总RNA为模板,逆转录合成cDNA。以cDNA为模板进行RT-PCR检测。引物序列见表1。反应体系20 μl,包括SYBR premix 10 μl、上游引物1 μl、下游引物1 μl、cDNA模板2 μl、无核糖核酸酶水6 μl。反应条件:95 ℃ 10 s,95 ℃ 40 s,65 ℃ 60 s,70 ℃ 10 s,共40个循环。目的基因的相对表达水平采用2-ΔΔCt法表示。

表1 引物序列
1.5 MTT增殖实验将NC组、NRAGE过表达组、NRAGE敲低组细胞以每孔1×104个细胞的量接种至96孔板,每孔补培养基200 μl,每组3个复孔。待细胞贴壁后,培养0、24、48、72 h换液,加入20 μl MTT试剂,3 h后弃上清液,加入200 μl的DMSO溶解紫色的结晶物,然后酶标仪上450 nm波长处检测各孔的吸光度值,结果取各浓度复孔的平均值。
1.6 Transwell实验将Matrigel 基质胶与培养基以1 ∶8的比例稀释制备工作浓度的基质胶,将工作浓度的基质胶包被24孔板的Transwell小室的上室面于37 ℃ 静置30 min,基底膜用无血清培养基水化30 min。调整NC组、NRAGE过表达组、NRAGE敲低组细胞密度至50×104/ml。取200 μl加入上室,下室加入500 μl含20%胎牛血清的培养基。24 h后取出Transwell小室,用PBS洗2次,10%多聚甲醛固定40 min,0.5%结晶紫染色15 min,棉签轻轻擦掉膜上层的细胞,PBS洗2次。镜下(×400)随机选取5个视野,数下室侧贴壁细胞数目,结果取平均值。
1.7 免疫印迹实验将NC组、NRAGE过表达组、NRAGE敲低组细胞以每孔3×105个接种至6孔板,待细胞贴壁长满后,弃培养基,冷PBS洗2次,加RIPA细胞裂解液300 μl,冰上裂解10 min,将细胞刮下提取细胞蛋白。BCA法蛋白定量后,加5×SDS-上样缓冲液,99 ℃金属浴15 min。SDS-PAGE 胶电泳:浓缩胶恒压80 V,分离胶恒压120 V,湿转法转膜90 min恒流300 mA。将PVDF 膜放入5%脱脂奶粉中封闭2 h;TBST洗3次,每次10 min,一抗4 ℃孵育过夜,二抗室温1 h。电化学发光法(ECL)暗室显影照相。
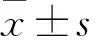
2 结果
2.1 NRAGE在CRC癌组织中的表达与癌旁组织相比,癌组织中NRAGE mRNA的相对表达量为(2.631±0.303)、(1.054±0.212)。癌组织中NRAGE mRNA相对表达量明显高于癌旁组织(t=40.475,P<0.001);与癌旁组织相比,癌组织中NRAGE蛋白表达明显较高,见图1。
图1 免疫印迹检测癌组织与癌旁组织中NRAGE的蛋白表达T:癌组织;N:相应的癌旁组织;1~4:4组癌与癌旁组织
2.2 CRC癌组织中NRAGE的表达与临床病理参数的关系CRC癌组织中NRAGE的表达与肿瘤分期、远处转移及淋巴结转移有关(P<0.05),而与性别、年龄、肿瘤大小、肿瘤位置、肿瘤分化程度无关。见表2。
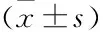
表2 癌组织中NRAGE表达与临床病理特征关系
2.3 CRC肿瘤细胞系及正常细胞系中NRAGE的表达CRC肿瘤细胞系HT29、SW480、SW620、LOVO NRAGE mRNA及蛋白明显高于正常细胞系FHC(t=7.325、9.124、18.644、19.012,P<0.001),高转移性细胞系SW620、LOVO NRAGE mRNA及蛋白的表达明显高于低转移性CRC肿瘤细胞系HT29、SW480(t=5.378、5.105、7.709、7.913,P<0.001)。见图2。
图2 CRC肿瘤细胞系及正常细胞系中NRAGE的表达A:各细胞系NRAGE mRNA表达;B:各细胞系NRAGE 蛋白表达;与FHC比较:*P<0.05;
2.4 过表达或敲低NRAGE对SW480细胞增殖及迁移能力的影响免疫印迹实验验证NRAGE的过表达或敲低的效率良好,见图3A。与NC组相比,NRAGE过表达组细胞活力较高(t=9.524,P<0.001)、侵袭细胞数增多(t=6.324,P<0.001),而NRAGE敲低组细胞活力较低(t=11.132,P<0.001)、侵袭细胞数减少(t=8.748,P<0.001),见图3B、C。
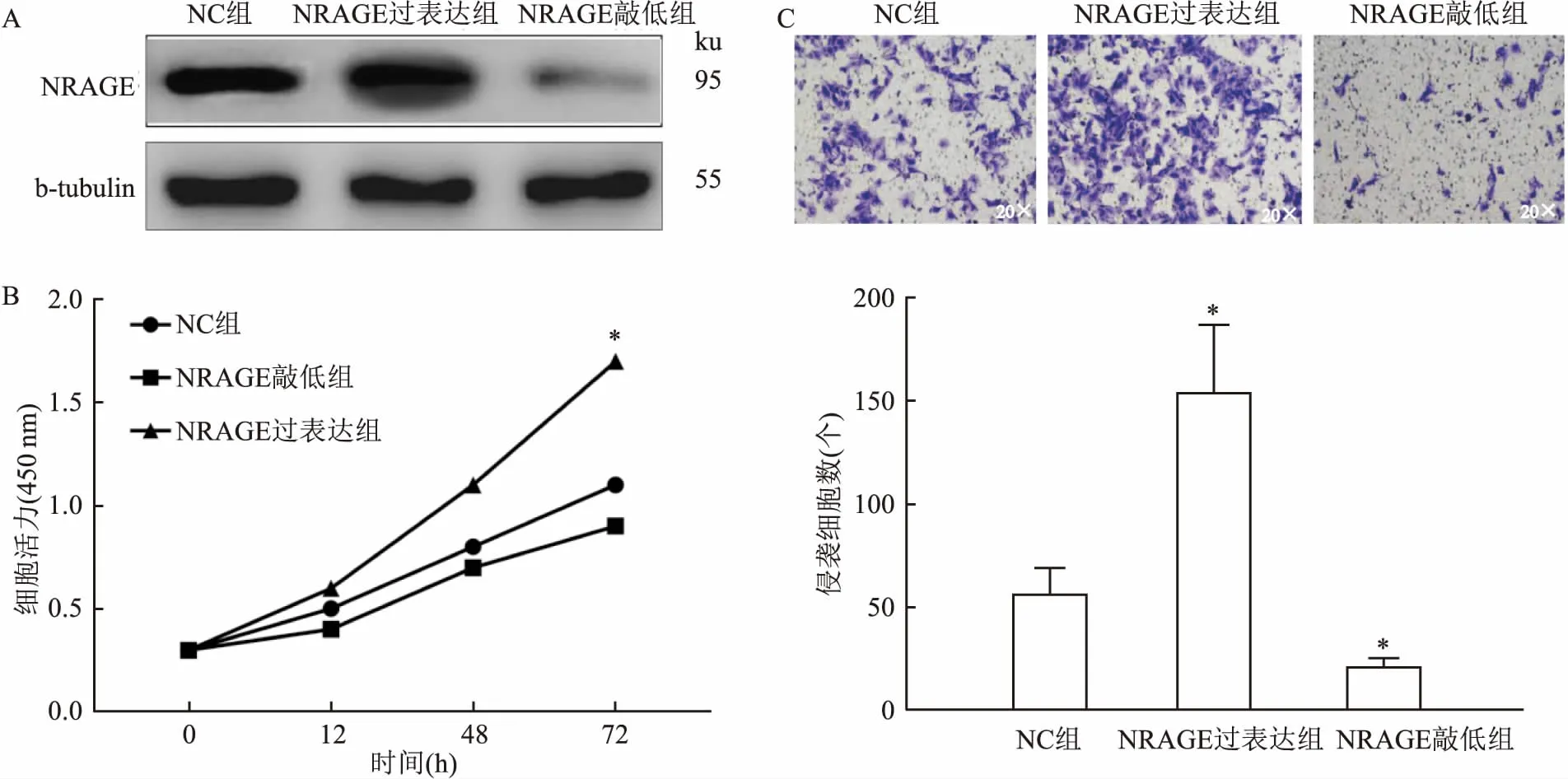
图3 NRAGE对SW480细胞增殖及迁移能力的影响A:SW480细胞NRAGE蛋白过表达及敲低效果验证;B:各组细胞增殖能力比较;C:各组细胞侵袭能力比较 ×20;与NC组比较:*P<0.05
2.5 过表达或敲低NRAGE对SW480细胞增殖及上皮间质转化(epithelial-mesenchymal transition,EMT)相关指标的影响与NC组相比,过表达NRAGE组SW480细胞CyclinD1、N-cadherin及Vimentin的mRNA及蛋白表达升高,E-cadherin的mRNA及蛋白表达降低,NRAGE敲低组SW480细胞CyclinD1、N-cadherin及Vimentin的mRNA及蛋白表达降低,E-cadherin的mRNA及蛋白表达升高(P<0.05)。见图4A、B。

图4 过表达或敲低NRAGE对SW480细胞增殖及EMT相关指标的影响A:各组增殖及EMT相关指标mRNA表达比较;B:各组增殖及EMT相关指标蛋白表达比较;与NC组比较:*P<0.05
2.6 NRAGE通过ERK信号通路调节SW480细胞增殖及迁移能力与NC组相比,过表达NRAGE组SW480细胞p-ERK1/2蛋白表达较高,而ERK1/2、AKT及p-AKT表达无明显差异,见图5A。予过表达NRAGE组SW480细胞应用ERK抑制剂U0126(20 μmol/L)24 h后,NRAGE组+U0126组细胞的增殖及迁移能力明显降低。见图5B、C。

图5 NRAGE通过ERK信号通路调节SW480细胞增殖及迁移能力A:各组ERK信号通路蛋白表达;B:各组细胞增殖能力比较;C:各组细胞侵袭能力比较 结晶紫染色×20;与NRAGE过表达组比较:*P<0.05
3 讨论
CRC的病因包括遗传因素、饮食及慢性炎症刺激等,多种因素共同作用导致基因或染色质结构的不稳定,引起多种癌基因的过度激活或(和)抑癌基因的失活,表现为无限增殖、凋亡抑制、免疫抑制、代谢改变及获得浸润转移等恶性生物学潜能。深入研究CRC的病因及发病机制,寻找新的CRC肿瘤标志物对于临床上CRC的早期诊断、治疗药物的研发及治疗效果评估具有重要临床价值。
黑色素瘤相关抗原(MAGE)基因家族成员包括Ⅰ型和Ⅱ型[6]。具有高度保守特征的Ⅱ型MAGE基因在人类、小鼠和斑马鱼中广泛表达,在生命个体的分化发育中起着至关重要的作用。NRAGE基因属于Ⅱ型MAGE亚家族,具有多种功能,包括调节细胞凋亡、细胞分化、生物钟、情绪调节等[7]。研究[8-9]表明,NRAGE在肝癌、乳腺癌等肿瘤中表达下调,而在食管癌、胃癌等消化道肿瘤中表达上调,参与影响恶性肿瘤的进展、转移和侵袭等生物学行为。该研究显示,CRC癌组织中NRAGE mRNA及蛋白表达明显上调,并与正常结直肠黏膜FHC细胞相比,CRC肿瘤细胞中NRAGE mRNA及蛋白表达均较高,目前CRC中NRAGE表达上调的机制尚不清楚,可能与ERK信号通路的过度激活有关。Jiang et al[10]在胃癌的研究中发现,ERK及ZO-1的磷酸化水平升高能促进NRAGE的表达,进而促进胃癌肿瘤细胞的浸润及转移。该研究结果显示,NRAGE的表达与肿瘤分期、淋巴结转移及远处转移有关,表明NRAGE的高表达参与促进CRC的肿瘤进展及转移。Sun et al[11]研究报道,肿瘤中NRAGE的高表达能够通过抑制细胞周期抑制因子P27的表达,促进肿瘤细胞G1/S周期的转换,促进肿瘤细胞的增殖,导致肿瘤分期升高。本研究显示,在SW480细胞中过表达NRAGE后,CyclinD1表达上调,因而NRAGE可能通过促进CyclinD1的表达,促进细胞周期的进行,导致肿瘤分期增高。为进一步研究NRAGE对CRC肿瘤细胞生物学行为的影响,通过MTT增殖实验及Transwell迁移实验对过表达或敲除NRAGE的SW480细胞进行功能验证,结果NRAGE过表达的SW480细胞增殖及迁移能力较NC组明显增强,而敲除NRAGE的SW480细胞增殖及迁移能力减弱。表明CRC中NRAGE的表达增加促进肿瘤细胞增殖及迁移。以往亦有研究[12]证实,NRAGE的表达水平升高能够激活下游癌基因如Ror2、Src等的表达,进而促进基质金属蛋白酶(MMP)1、MMP9的表达,导致细胞之间黏附能力减弱,促进肿瘤细胞的局部浸润和转移。EMT可促进肿瘤细胞的浸润转移能力,而EMT的调控是一个复杂的网络,涉及 TGFβ家族,Wnts、Notch和HIF等多个信号通路的异常改变,表现为细胞上皮-基底极性的丧失,上皮性标志E-cadherin表达的下调及间质性标志N-cadherin表达的上调[13]。因此,可假设NRAGE可能通过促进CRC细胞发生EMT,获得局部浸润及远处转移的能力。为验证该假设,本实验检测过表达或敲低NRAGE后,SW480细胞中EMT相关指标如E-cadherin、N-cadherin及Vimentin的表达,结果显示,与NC组相比,过表达NRAGE组的细胞N-cadherin及Vimentin表达较高,而E-cadherin表达较低,表明NRAGE的表达能够促进CRC细胞发生EMT,增强肿瘤细胞的浸润及迁移能力。冯振华[14]的研究提示,NRAGE的表达受到MAPK/ERK和AKT/PKB通路的表达调控,干扰NRAGE基因的表达可以抑制AKT激酶及ERK活性,也降低AKT及ERK的磷酸化水平,诱导肿瘤细胞的分化[15]。为分析SW480细胞中NRAGE促进肿瘤细胞的增殖及迁移的机制,该研究初步探索过表达NRAGE后ERK1/2、p-ERK1/2、AKT及p-AKT的表达情况,显示过表达NARGE后p-ERK1/2表达显著上调,并且加入ERK1/2抑制剂U0126后,NRAGE促进SW480细胞增殖及迁移的能力受到显著抑制,提示NRAGE可能通过促进ERK1/2的磷酸化,促进肿瘤细胞的增殖和迁移。
