CD147抑制前列腺癌细胞氧化应激作用
2022-02-22徐海月李泽颢韩永琪王立国
徐海月,李泽颢,韩永琪,王立国,方 芳
前列腺癌(prostate cancer, PCa)是一种恶性肿瘤,是全世界男性癌症死亡的主要原因之一[1]。PCa多发生于55 岁以上男性患者,高脂饮食、炎症、性激素失衡等是导致其发生的危险因素,这些因素与氧化应激密切相关。活性氧自由基(reactive oxygen species, ROS)是氧化应激反应中产生的一种最为重要的氧化性介质。一定水平的 ROS 有助于机体抵御感染等引起的炎症反应、促进细胞增殖等作用;而过量的ROS可能对细胞造成不同程度的氧化性损伤[2]。因此,调节肿瘤氧化应激的分子对肿瘤的治疗至关重要。
分化簇(CD)147(CD147),是一种属于免疫球蛋白超家族的跨膜糖蛋白,在PCa等恶性肿瘤中表达增高[3-5]。研究[6]表明,在黑色素瘤细胞中删除CD147的表达使细胞对过氧化氢(hydrogen peroxide,H2O2)诱导的氧化应激更为敏感。然而CD147对调节PCa细胞氧化应激作用尚不清楚。该研究旨在探讨CD147对PCa细胞氧化应激的调节作用,为PCa的临床治疗提供参考依据。
1 材料与方法
1.1 主要材料胰酶、胎牛血和RPMI-1640购自美国Gibco公司;CCK-8试剂盒购自北京博奥森公司;活性氧(ROS)检测试剂盒购自美国Sigma公司;RNA提取试剂盒购自北京索莱宝公司;反转录试剂盒及实时定量 PCR 试剂盒购自美国GeneCopoeia公司;PCR引物由库美公司合成;超氧化物歧化酶(SOD)、丙二醛(MDA)、还原型谷胱甘肽(GSH)试剂盒购自南京建成生物科技有限公司;Nrf2和HO-1 抗体购自美国Cell Signaling Technology公司;内参抗体 β-actin抗体购自美国Gene Tex公司。
1.2 实验方法
1.2.1细胞培养 低表达CD147的实验组LNCaP细胞(LNCaP/shCD147) 和阴性对照组LNCaP细胞(LNCaP/Scramble)由本实验室保存[7]。细胞用含10% FBS的RPMI-1640完全培养基于37 ℃、5% CO2培养箱中培养,隔日换液。
1.2.2RT-qPCR鉴定CD147 mRNA表达 采用有机溶剂抽提法TRlzol法提取细胞总RNA, 定量后逆转录为cDNA,以β-actin为内参照, RT-qPCR检测CD147 mRNA表达量,用基因相对定量法(2-△△Ct)计算结果。β-actin的上游引物序列为5′-CACTGTGCCCATCTACGAGG-3′,下游引物序列为5′-TAATGTCACGCACGATTTCC-3′;CD147的上游引物序列为5′- CAGAGTGAAGGCTGTGAAGTCG-3′,下游引物序列为5′- TGCGAGGAACTCACGAAGAA-3′。
1.2.3流式细胞仪检测ROS 收集两组细胞,1 000 r/min离心5 min后吸除上清液,用无菌PBS溶液洗涤2次。细胞内ROS水平检测按照ROS检测试剂盒说明书进行。即每份样本细胞中加入1 ml的DCFH-DA稀释液(无血清DMEM培养液按照1 ∶1 000比例稀释),混匀后置于37 ℃、5% CO2培养箱内避光孵育30 min,用PBS洗涤细胞并重复3次,重悬细胞于0.5 ml PBS中,用流式细胞仪进行检测和分析。
1.2.4SOD、GSH-PX和MDA水平的检测 收集细胞离心,将各组细胞沉淀用PBS重悬后超声裂解,离心后取上清进行蛋白含量测定,抗氧化酶(SOD,GSH-PX)活性及MDA含量的检测严格按照试剂盒说明书进行操作,分光光度计测吸光度。
1.2.5CCK-8实验观察细胞活力 取对数期细胞配制成浓度为4×108个/L的单细胞悬液,体积为每孔100 μl,接种于96孔板内,于37 ℃、5% CO2条件下培养。待细胞贴壁后将培养基吸掉,分别加入终浓度为100、200、400、800 μmol/L的 H2O2稀释液,同时设立阴性对照组,每组设4个复孔,分别作用2、4 h后,每孔避光加入10 μl CCK-8溶液,待培养液显色后用酶标仪检测450 nm吸光度值,以细胞的存活率表示细胞的活力。
1.2.6Western blot 检测细胞中p-AKT、AKT、Nrf2和HO-1蛋白表达 将两组细胞用无菌PBS缓冲液清洗3次,再用RIPA细胞裂解液冰上静置5 min,12 000 r/min 离心5 min,取上清液蛋白定量后加入上样缓冲液,煮沸5 min,10% SDS-聚丙烯酰胺凝胶电泳中每个泳道加入20 μl(含40 μg)的总蛋白电泳分离,转印至PVDF膜上,用5%脱脂奶粉室温下封闭1 h,加入兔抗p-AKT、AKT、Nrf2和HO-1抗体(1 ∶500)、β-actin和Histone H3抗体(1 ∶1 000)4 ℃过夜。次日TBST洗膜,分别加入HRP标记的羊抗兔抗体(1 ∶5 000),室温避光孵育45 min,TBST洗膜后ECL化学发光显影,Image J软件分析目的蛋白相对表达水平。
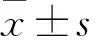
2 结果
2.1 RT-qPCR鉴定H2O2刺激下细胞内CD147的表达采用不同浓度的H2O2刺激LNCaP细胞后,CD147的表达逐渐增加(P<0.001)。见图1。
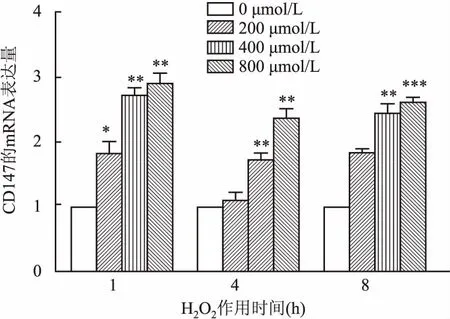
图1 H2O2刺激下CD147的表达情况与0 μmol/L组比较:*P<0.05,**P<0.01,***P<0.001
2.2 RT-qPCR鉴定细胞CD147的表达结果显示,与LNCaP/Scramble组细胞CD147表达水平比较,LNCaP/shCD147组CD147的表达下降,差异有统计学意义(F=64.408,P<0.01)。
2.3 沉默CD147对细胞ROS含量影响流式细胞仪检测两组细胞内ROS含量,结果显示阴性对照组LNCaP/Scramble细胞ROS含量为(3.60±0.84),细胞模型组LNCaP/shCD147细胞内ROS水平为(13.23±0.76),与阴性对照组比较,细胞模型组ROS增高(F=33.825,P<0.01)。见图2。
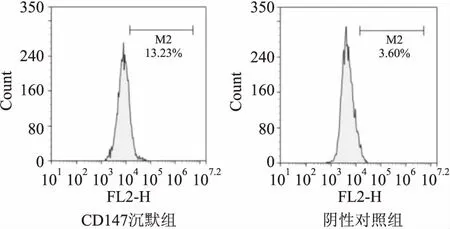
图2 沉默CD147表达对ROS的生成影响
2.4 沉默CD147对SOD、GSH-PX活性和MDA含量影响LNCaP/Scramble组细胞抗氧化酶SOD、GSH-PX的活性值和MDA的含量分别是(41.563±1.873)、(30.341±1.261)和(2.562±0.264);LNCaP/shCD147细胞组细胞抗氧化酶SOD、GSH-PX的活性值和MDA的含量分别是(250.755±12.502)、(173.112±14.591)和(3.678±0.398)。与LNCaP/Scramble组相比较,LNCaP/shCD147细胞SOD、GSH-PX的活性降低(F=74.376、48.999,P<0.01),而细胞上清中MDA的含量升高(F=16.568,P<0.05)。
2.5 沉默CD147对H2O2诱导的细胞损伤的影响CCK-8方法检测细胞存活率,结果显示:与LNCaP/Scramble组比较,当400 μmol/L H2O2作用细胞2 h时,LNCaP/shCD147细胞存活率下降(F=8.328,P<0.05),并且随着H2O2浓度的升高细胞存活比率越低(F=26.172,P<0.01)。当200 μmol/L H2O2作用LNCaP/shCD147细胞4 h后,细胞存活率下降(F=14.763,P<0.05),随着 H2O2浓度的升高LNCaP/shCD147组细胞存活率逐渐下降(F=78.790、151.603,P<0.01)。见图3。
图3 沉默CD147对过氧化氢诱导的细胞存活影响A:不同浓度H2O2作用2 h后细胞存活率变化;B:不同浓度H2O2作用4 h后细胞存活率变化;与LNCaP/scramble 组比较:**P<0.01
2.6 CD147通过PI3K/AKT途径抑制氧化应激实验结果表明,与对照组LNCaP/Scramble比较,LNCaP/shCD147细胞中Nrf2 和HO-1表达降低(F=38.495、73.597,P<0.01)。与LNCaP/shCD147细胞组比较,采用20 μmol/L PI3K/AKT途径抑制剂LY294002作用细胞24 h后,LNCaP/shCD147细胞中Nrf2 和HO-1表达进一步降低(F=50.342、47.756,P<0.01)。见图4。
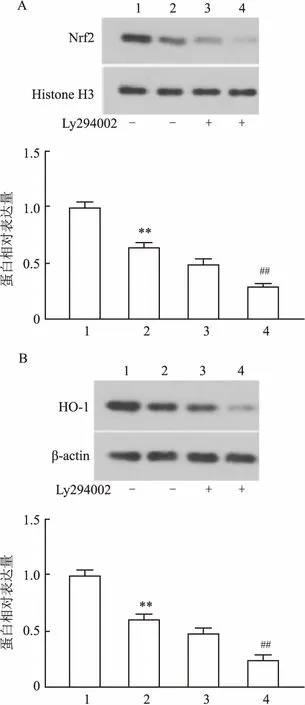
图4 沉默CD147促进H2O2作用LNCaP细胞Nrf2和HO-1的表达A:各组Nrf2蛋白表达;B:各组HO-1蛋白表达;1:LNCaP/scramble组;2:LNCaP/shCD147组;3:LNCaP/scramble+LY294002组;4:LNCaP/shCD147+LY294002组;与LNCaP/scramble组比较:**P<0.01;与LNCaP/shCD147组比较:##P<0.01
3 讨论
氧化应激在PCa发生发展中起重要作用。与PCa旁的正常前列腺组织相比,PCa组织中产生更高水平的内源性 ROS,促进肿瘤细胞的增殖和新血管形成等[8]。然而,过量的ROS可引起氧化应激,破坏、氧化脂质和蛋白质等导致细胞凋亡和坏死。因此,探讨肿瘤细胞在ROS作用下的分子机制,有望为治疗肿瘤提供新的线索。
首先通过RT-qPCR的实验检测到,选用不同浓度及不同时间点的H2O2作用LNCaP细胞后,CD147表达逐渐升高,这表明CD147可能参与了细胞内的氧化应激。接下来利用特异性siRNA干扰技术成功降低了CD147在PCa中的表达,发现PCa细胞氧化应激水平增高,导致细胞中过多的ROS积累,说明CD147可能具有抑制氧化应激的作用。ROS包括超氧化物阴离子、H2O2、羟基自由基,可刺激细胞引起结构破坏,包括脂质过氧化以及DNA和蛋白质氧化,破坏人体的氧化还原平衡并改变细胞的正常功能和形态[9]。在进化过程中,哺乳细胞中产生强大的抗氧化系统,例如SOD、GSH-PX和MDA等。SOD是体内重要的抗氧化酶,通过将超氧化物歧化为普通分子氧来维持机体代谢平衡。GSH-PX是体内重要的自由基捕获酶之一,能减少脂质过氧化物的形成,增强机体抗氧化损伤的能力。MDA在受到氧化刺激时会显著增加,能影响线粒体呼吸链复合物及关键酶活性并加剧膜的损伤,通过链式反应放大活性氧的作用,可反映机体脂质过氧化的程度。CD147干扰之后,细胞上清液中MDA含量升高,SOD和GSH-PX的活性降低,说明CD147可能通过调节抗氧化酶的作用使肿瘤细胞处于平衡状态。此外,利用H2O2作用细胞建立氧化应激模型表明CD147表达降低后细胞存活下降。实验结果进一步说明CD147具有对氧化应激的保护作用。
核转录因子E2相关因子2(Nrf2)具有重要的抗氧化作用,通过作用抗氧化反应序列元件(ARE)并调控下游Ⅱ相代谢酶和抗氧化蛋白/酶的信号通路在细胞防御保护中发挥重要作用。Ⅱ相代谢酶血红素加氧酶-1(HO-1)是血红素分解代谢过程中的限速酶,是一种参与抗氧化、抗凋亡和抗炎反应的应激蛋白[10]。实验结果表明,CD147表达下降后Nrf2和HO-1的水平减少。目前研究[11-12]表明,蛋白激酶 C(PKC)、丝裂原活化蛋白激酶(MAPK)、磷脂酰肌醇 3 激酶(PI3K)、核因子κB(NF-κB)和腺苷活化蛋白激酶(AMPK)途径等均参与了Nrf2/ARE信号通路的激活及其依赖的基因表达调控过程。课题组前期研究表明,CD147能够通过PI3K/AKT途径抑制PCa细胞自噬,减少自噬性细胞死亡及促进PCa细胞雄激素受体活性的作用[13],因此推测CD147是否可以通过PI3K/AKT途径参与调节PCa细胞的氧化应激。使用PI3K/AKT途径抑制剂LY294002作用细胞,结果显示LY294002能够使LNCaP/shCD147细胞中Nrf2和HO-1表达进一步降低。
