Epac1信号介导大鼠噪声暴露后内耳毛细胞损伤作用与机制
2022-02-22孙凡凡张俊戈孙家强董六一
王 成,孙凡凡,张俊戈,孙家强,董六一
听力损失是临床上常见的感觉障碍形式,噪声性听力损失(noise-induced hearing loss,NIHL)占成年人听力损失的16%[1],且有逐年增加的趋势。目前,临床上尚缺乏有效的预防或治疗措施[2],对NIHL的关注和研究已成为当前世界各国临床耳科医学工作者的研究热点。
环磷酸腺苷(adenosine cyclophosphate,cAMP)作为细胞内重要的的第二信使,可调控多种信号通路,如细胞再生、修复等。cAMP的效应器除了已被充分研究的cAMP蛋白激酶A(protein kinase A,PKA)外,还有由cAMP直接激活的环腺苷酸结合蛋白(exchange protein directly activated by cAMP,Epac)[3]。Epac是Ras家族小分子G蛋白Rap的交换因子,可促使无活性的GDP转换为有活性的GTP,并激活Rap蛋白,参与下游信号转导。研究[4]表明Epac-Rap1作为一个新的重要途径在cAMP信号通路中发挥重要作用。已有大量文献[5]报道Epac在神经元生长、再生与修复等功能作用中的相关研究,但Epac在NIHL中作用的研究国内外未见相关报道。该文主要探讨在噪声暴露条件下Epac1信号是否介导大鼠内耳毛细胞病理性损伤过程并初步研究其作用与机制,期望为NIHL的防治提供新的靶点。
1 材料与方法
1.1 实验动物与分组SPF级雄性SD大鼠20只,体质量为250~350 g,耳廓反应灵敏,于饲养室(22±3)℃,湿度40%~70%,饲养1周。动物购于安徽医科大学实验动物中心,生产许可证号:[SCXK(皖)2017-001],动物伦理报告编号:LLSC20200760。SD大鼠随机分为对照组和噪声暴露组,10只/组。
1.2 药品与试剂10% EDTA脱钙液购自西安赫特生物科技有限公司;PMSF购自美国Sigma公司;RIPA蛋白裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒购自上海碧云天生物技术公司;预染蛋白marker购自美国Thermo Fisher Scientific公司;兔来源Epac1一抗、兔来源CaMKⅡ一抗、鼠来源Rap1一抗、兔来源Bax、Bcl-2购自美国Abcam公司;cleaved caspase-3/9一抗;内参β-actin购自美国CST公司;兔来源Epac1一抗(免疫荧光)购自北京博奥森生物科技有限公司;iFluor488标记鬼笔环肽(绿色)购自上海翊圣生物科技有限公司;辣根酶标记山羊抗小鼠IgG二抗和山羊抗兔IgG二抗、ITC标记山羊抗兔IgG、封闭用羊血清(批号:ZLI-9022)购自北京中杉金桥有限公司;Triton X-100购自上海索莱宝生物科技有限公司。
1.3 仪器设备静音室(广州声左声学技术有限公司);噪声扬声器(上海创目公司);功能放大器(日本YAMAHA公司);声压计(杭州爱华公司);Tucker Davis Technologies(TDT)系统(美国Tucker-Davis公司);测听扬声器(美国Tucker-Davis公司);校准麦克(美国Tucker-Davis公司);超低温冰箱(日本Sanyo公司);TGL-16H高速离心机(珠海黑马医学仪器有限公司);DIAX-900内切式组织匀浆机(德国Heidolph公司);TE300型倒置显微镜(日本Nikon公司);SpectraMax190酶标仪(美国Molecular Devices公司);WD-9405B水平摇床(北京市六一仪器厂);Bioshine ChemiQ4600荧光及化学发光成像系统(上海欧翔科学仪器公司);透射电子显微镜(日本日立公司);蔡司显微镜(德国ZEISS公司);冷冻研磨仪(上海净信公司)。
1.4 方法
1.4.1噪声暴露 将噪声暴露组大鼠暴露于中心频率为4 kHz,声强度为101 dB SPL的宽频噪声中8 h。应用声级计测量和调整噪声强度。
1.4.2听觉脑干反应(auditory brainstem responses,ABR)测量 实验前 ,噪声暴露后分别对两组大鼠进行 ABR 检测。腹腔注射3%戊巴比妥钠溶液(30 mg/kg)麻醉大鼠。将皮下电极插入颅骨的顶点,参考电极插入左耳下的乳突处接地电极插入右耳下的乳突处。以宽频的Click(0.1 ms,21次/s)声及 Tone burst 声(4、8、12、16、20、24、32 kHz;0.5 ms上升/下降期,无平台期,交替相位)为刺激声,Tucker Davis Technology (TDT) 系统Ⅲ硬件及Biosig软件进行测量。每个刺激水平的重复高达521次。从90 dB开始,每5 dB逐级下降,直到检测不到重复的波形,确定阈值。所有ABR测量均由同一实验者进行。
1.4.3基底膜铺片染色 对照组与噪声暴露组大鼠(n=3)于噪声暴露24 h后,用戊巴比妥钠麻醉后迅速断头,取出颞骨,磷酸盐缓冲液(phosphate buffer saline,PBS)漂洗1次,将耳蜗浸泡在4%多聚甲醛中,4 ℃过夜后取出耳蜗,PBS漂洗3次,10% EDTA脱钙液中浸泡5 d。在解剖显微镜下去除侧壁、Reissner膜和覆膜,将基底膜用iFluor488标记鬼笔环肽(在PBS中1 ∶1 000稀释)染色30 min,用PBS漂洗后,置于载玻片上,在荧光显微镜下观察毛细胞。
1.4.4免疫荧光染色 将大鼠耳蜗基底膜置于3% Triton X-100溶液中透化30 min,PBS 洗涤3次(10 min/次)后于室温下山羊血清封闭30 min,4 ℃与Epac 1(1 ∶100)孵育24 h,洗涤3次后,置于FITC标记山羊抗兔IgG的二抗(1 ∶50)中,4 ℃避光过夜。将样品用PBS洗涤3次,并与iFluor488鬼笔环肽(1 ∶1 000)室温下避光孵育30 min,PBS洗涤3次,置于载玻片上,荧光显微镜观察。
1.4.5透射电镜 将大鼠耳蜗基底膜进行乙醇梯度脱水,用spurr环氧树脂进行包埋、切片,约70 nm/片。将制好的切片用1%甲苯胺蓝进行染色,透射电镜下观察耳蜗超微结构。
1.4.6Western blot 使用Western blot法检测大鼠耳蜗组织Epac1、CaMK-Ⅱ、Rap1通路相关蛋白和Bax、Bcl-2、CC3、CC9等凋亡蛋白表达的变化(n=3)。通过Bioshine ChemiQ 4600荧光及化学发光成像系统显影,用 Image J软件分析蛋白条带的灰度值。
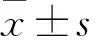
2 结果
2.1 大鼠噪声暴露前后ABR阈值变化ABR检测,噪声暴露后,对照组与噪声暴露组大鼠在12 kHz时的ABR波形。实验结果显示,噪声暴露前对照组与噪声暴露组大鼠的ABR阈值差异无统计学意义。噪声暴露后对照组大鼠4、8、12、16、20、24及32 kHz ABR听力阈分值别为(31.00±1.87)、(30.00±2.74)、(31.00±1.87)、(32.00±3.39)、(36.00±3.32)、(38.00±2.00)、(39.00±2.45 )dB SPL,噪声暴露组大鼠听力阈值为(64.00±1.87)、(67.00±5.61)、(73.00±2.55)、(74.00±1.87)、(73.00±2.25)、(84.00±2.45)、(82.00±1.13) dB SPL,差异有统计学意义(t=7.747、8.687、9.860、9.860、10.303、10.800、10.100,P<0.01)。噪声暴露后对照组大鼠的Click值为(25.00±2.24) dB SPL,噪声暴露组大鼠为(52.00±5.83) dB SPL,差异有统计学意义(t=8.416,P<0.01)。
2.2 噪声暴露后大鼠内耳外毛细胞损伤情况鬼笔环肽对大鼠耳蜗基底膜进行铺片染色结果显示,对照组大鼠内耳三层外毛细胞排列整齐,形态清晰,基本无细胞缺失;噪声暴露组大鼠内耳三层外毛细胞排列较整齐,但外毛细胞缺失明显。见图1 A。内耳外毛细胞计数结果显示,对照组大鼠耳蜗外毛细胞缺失率显著低于噪声暴露组,差异显著(t=7.869,P<0.05)。透射电镜结果显示,对照组大鼠耳蜗毛细胞形态完整,胞质均匀,线粒体形态正常、内部线粒体嵴清晰可见;噪声暴露组大鼠毛细胞形态不规则,静纤毛丢失或融合,细胞器损伤严重,线粒体外膜破裂,线粒体脊断裂或消失,出现空泡化等。见图1B。
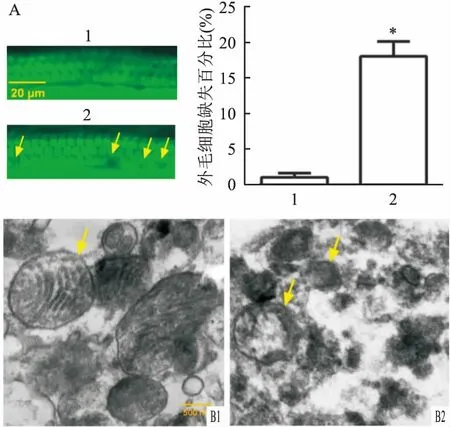
图1 噪声暴露后大鼠内耳外毛细胞损伤情况A:对照组与噪声暴露组大鼠耳蜗基底膜铺片鬼笔环肽染色 ×200;B:对照组与噪声暴露组大鼠耳蜗基底膜透射电镜观察结果 ×5 000;1:对照组;2:噪声暴露组;与对照组比较:*P<0.05
2.3 免疫荧光检测大鼠内耳毛细胞Epac1蛋白表达采用免疫荧光量化外毛细胞中Epac1免疫标记,结果显示,对照组大鼠的耳蜗外毛细胞中Epac1表达较弱,而噪声暴露组大鼠耳蜗外毛细胞中Epac1高表达(t=6.276,P<0.05)。见图2。
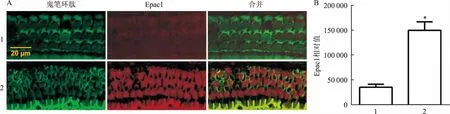
图2 Epac1免疫标记在对照组与噪声暴露组大鼠中的表达A: Epac1蛋白表达 ×200;B:Epac1蛋白半定量分析;绿色荧光:鬼笔环肽染色;红色荧光:Epac1蛋白表达;1:对照组;2:噪声暴露组;与对照组比较:*P<0.05
2.4 大鼠噪声暴露后耳蜗组织中Epac1、Rap1和CaMK-Ⅱ蛋白表达情况Western blot结果显示,与对照组比较,噪声暴露组大鼠耳蜗组织中Epac1蛋白表达上调(t=6.322,P<0.05),提示噪声暴露后Epac1蛋白激活,并促进其下游Rap1(t=2.871,P<0.05)和CaMK-Ⅱ(t=2.932,P<0.05)蛋白表达。见图3。
图3 对照组与噪声暴露组大鼠耳蜗Epac1、Rap1和CaMK-Ⅱ蛋白表达量的变化A:Epac1蛋白表达;B:Rap1蛋白表达;C:CaMK-Ⅱ蛋白表达;1:对照组;2: 噪声暴露组;与对照组比较:*P<0.05
2.5 噪声暴露后大鼠耳蜗组织中凋亡相关蛋白表达情况Western blot检测结果显示,与对照组相比,噪声暴露组大鼠耳蜗组织中Bcl-2蛋白表达下调,Bax表达上调,其Bcl-2/Bax比值下降(t=3.230,P<0.05);另外噪声暴露诱导耳蜗组织中CC3与CC9 激活,其CC3(t=3.014,P<0.05)和CC9(t=4.058,P<0.05) 表达增加,促进毛细胞凋亡。见图4。
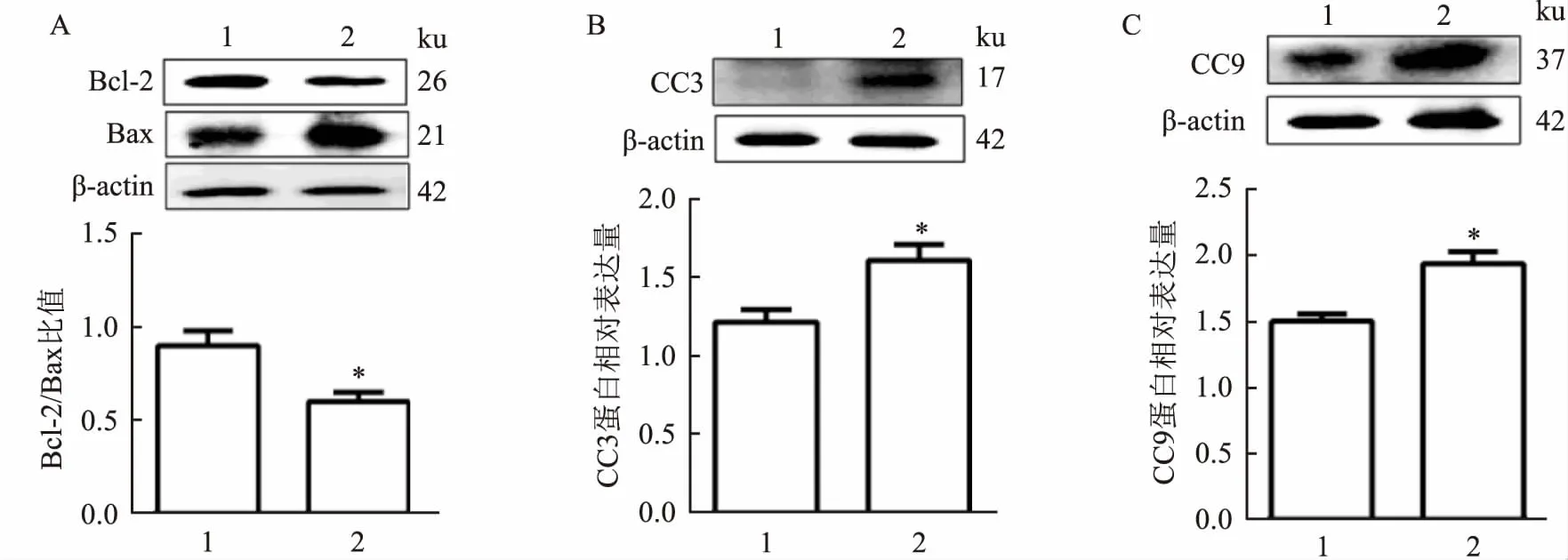
图4 对照组与噪声暴露组大鼠耳蜗Bcl-2/Bax、CC3、CC9蛋白表达量的变化A:Bcl-2蛋白表达;B:CC3蛋白表达;C:CC9蛋白表达;1:对照组;2: 噪声暴露组;与对照组比较:*P<0.05
3 讨论
噪声暴露对内耳毛细胞损伤主要通过两种途径:一种是直接的机械损伤,机械震动可破坏毛细胞的静纤毛导致毛细胞缺失,并损伤支持和螺旋神经节[6];另一种是细胞凋亡或坏死导致毛细胞死亡的生化途径[7]。目前已知噪声导致内耳毛细胞发生凋亡的机制有氧化应激、能量代谢障碍、中性粒细胞浸润、钙超载等[8]。然而这些非特异性变化与耳蜗损伤间的具体联系并无定论,其机制尚不明确。
该文参照了Coleman et al[9]的造模方法,ABR结果显示噪声暴露组大鼠的听力阈值较对照组大鼠显著升高(P<0.05),提示模型构建成功。鬼笔环肽染色及透射电镜结果均显示内耳毛细胞形态发生异常,证实了噪声暴露可导致内耳毛细胞形态结构损伤。
Epac1作为cAMP激活的下游信号传导途径,主要存在于中枢神经系统、心脏、血管、肾脏中,涉及如细胞生长、黏附、分化、分裂、胞吐和炎症等广泛的细胞功能,同时也是一种影响细胞钙摄取的关键介质[10]。该实验结果表明,与正常对照组比较,噪声暴露组大鼠耳蜗毛细胞Epac1免疫荧光显示高表达。另外,Western blot结果也证实噪声暴露组大鼠耳蜗组织中Epac1、Rap1和CaMK-Ⅱ蛋白表达均明显上调。据文献[11]报道,Epac的高表达会激活下游的Rap1通路,增加钙的摄取; Fazal et al[12]在心肌细胞研究中发现Epac家族蛋白对心肌细胞线粒体中Ca2+的摄取有激活作用,并且是通过CaMK-Ⅱ调控Ca2+进入线粒体的;Lezcano et al[13]研究表明Epac可以通过CaMK-Ⅱ调控内质网对钙的释放与摄取,进而影响细胞质中Ca2+浓度。该实验结果提示Epac通路参与了噪声诱导大鼠内耳损伤过程,而Rap1与CaMK-Ⅱ作为Epac的下游蛋白,其表达水平均显著上调,提示Epac激活介导大鼠噪声暴露内耳损伤可能与调控其下游Rap1与CaMK-Ⅱ蛋白表达,促进内耳毛细胞钙超载有关。
细胞凋亡是维持机体稳态的重要生理过程。正常细胞中促凋亡和抗凋亡因子之间保持平衡,使细胞维持正常的增殖和生长。如果该平衡被破坏会导致人体多种疾病的发生,而听力障碍则是其中一种。已知长时间的钙超载会导致Bax活化,诱导线粒体外膜的通透性和细胞色素C的释放,激活下游的Caspase通路从而使细胞发生凋亡,而Bcl-2可拮抗Bax的表达,调节细胞的凋亡过程[14-15]。该研究结果显示噪声暴露组大鼠耳蜗组织中Bcl-2表达降低,Bax表达上调,并且Caspase级联反应中的关键蛋白CC3和CC9激活,导致CC3与CC9表达上调。
