加速康复外科理念结合护理路径在胰腺癌术后患者中的应用
2022-02-22黄品芳林敏刘靖沈景亮
黄品芳 林敏 刘靖 沈景亮
胰腺癌属消化道恶性肿瘤疾病之一,手术是治疗该疾病的有效方法,但术后患者常存在恢复情况差、并发症发生率高、住院时间长等问题[1]。临床护理路径按照时间顺序为患者制定了规范的护理流程,虽然有助于护理人员明确护理目标和护理内容,避免常规护理的盲目性,但是其对术后快速康复的影响较低,患者术后恢复较慢,也在一定程度上提高了并发症的发生风险[2-3]。加速康复外科理念(ERAS)是一种多模式、多学科的综合干预方法,涉及患者教育、早期进食、提早运动等内容,将其与临床护理路径结合运用于胰腺癌患者的护理中,可有效改善机体的免疫功能和营养状况,从而降低并发症发生率[4]。基于此,本文对ERAS结合临床护理路径在胰腺癌患者护理中的运用效果进行分析。
1 对象与方法
1.1 研究对象
选择我院收治的60例胰腺癌患者作为研究对象,患者均于2019年1月—2020年8月接受手术治疗,按照组间基本特征具有可比性的原则分为观察组与对照组,各30例。对照组中男19例,女11例;年龄37~72岁,平均52.48±5.28岁;肿瘤位置:胰头19例,胰体/尾9例,全胰腺2例;肿瘤直径2~5 cm,平均3.42±0.61 cm。观察组中男20例,女10例;年龄38~74岁,平均53.75±5.66岁;肿瘤位置:胰头18例,胰体/尾9例,全胰腺3例;肿瘤直径2~5.5 cm,平均3.63±0.57cm。两组性别、年龄、肿瘤位置、肿瘤直径比较差异无统计学意义(P>0.05)。
1.2 纳入条件与排除条件
纳入条件:经影像学检查、术后病理证实为胰腺癌,符合《食管癌规范化诊治指南》[5];临床资料完整;神志清醒,能进行正常沟通;术前未接受过放化疗等治疗;对本次研究知情,并已签署同意书。排除条件:合并其他恶性肿瘤;严重营养不良;神志不清,无法与人进行正常沟通;术前接受放化疗等治疗;胰腺癌晚期,已失去手术机会。
1.3 护理方法
对照组采用临床护理路径进行干预,措施如下:术前,进行健康教育,将手术操作步骤及效果、术后并发症、注意事项等告知患者;术前1 d进行肠道准备,即指导患者口服肠道清洁剂,术前12 h清洁灌肠;手术当天提醒患者保持空腹状态;术中常规放置引流管;术后遵医嘱给予患者阿片类止痛药进行镇痛;术后2~3 d,放置导尿管;术后禁食,禁食期间行肠外营养,待肠道蠕动恢复正常后便可将胃管拔除,并进食少量流质食物;术后3~4 d,指导患者下床活动;术后使用3~5 d抗生素以预防感染。
观察组在临床护理路径中融入ERAS进行干预,措施如下:
(1)术前宣教:向患者及家属介绍疾病相关知识,使其明白手术的必要性;告知患者及家属各阶段治疗的过程及术后可能产生的并发症,使其做好心理准备,从而提高患者对医护工作的配合度,减轻术前焦虑情绪,在术后出现并发症时请患者按照术前健康教育时掌握的方法进行处理,减轻其恐慌心理。
(2)术前肠道准备:结合ERAS,术前不进行常规机械性肠道准备,提醒患者术前6 h禁食,术前2 h禁水;术前2 h可指导患者口服400~500 ml 10%葡萄糖溶液。
(3)术中引流与保温:在手术操作过程中,减少腹腔引流管的放置,可根据手术操作情况及患者的病情变化提前拔除引流管;术中进行输液时将液体进行加温处理,同时加强非手术区域的保温护理,拿毛毯覆盖其非手术区域,以减少机体的应激反应。
(4)术后镇痛及血栓预防:术后减少阿片类止痛药的使用,采取预防性思维进行多模式镇痛,如静脉阻滞麻醉、硬膜外麻醉、患者自控镇痛泵、静脉或肌内注射等,术后2~3 d可停止使用镇痛泵。术后6 h,协助患者在床上进行踝泵运动,并挤压其腓肠肌5~10 min,或者穿弹力袜,以预防血栓栓塞。
(5)术后早期进食:术后6~8 h可指导患者饮用10~20 ml温水,术后1~2 d可增加饮水量,在患者拔除胃管当天可进食流质食物,然后过渡到半流质食物、软质食物、正常饮食,遵循少食多餐的原则。在此期间应对营养状况进行评估,并监测其胃肠道有无不适症状。
(6)术后早期活动:手术结束当天,待患者生命体征平稳后可协助其在床上做抬臀运动,或在床上坐起,每天1~2次,每次15 min;术后第1天,协助患者起身,坐于床边30 min,每天2次;术后第2天,在床边坐1~2 h,并协助其在床边站立或行走5~10 min,每天2次;术后第3天,在床边坐2 h,每天3次,行走时间增加至每次20~30 min,每天2次;术后第4~5 d,可将行走时间增至每次30 min,每天4次,从而逐步恢复正常活动。
(7)术后导管管理:若患者在术后第1天的24 h胃液量<300~500 ml或在夹管1天后并无不适反应则可将胃管拔除;停止使用镇痛泵后4 h便可将导尿管拔除;术后第4~5天,若患者每天的腹腔引流量<100 ml且引流液淀粉酶<300 U/L,则可将腹腔引流管拔除。
1.4 观察指标
(1)营养状况[6-7]:于术前1 d、术后5 d分别抽取患者清晨空腹状态下的肘静脉血5 ml,采用免疫比浊法的转铁蛋白(TRE)、前清蛋白(PAB)和白蛋白(ALB)三项营养指标进行检测。
(2)免疫功能[8]:于术前1d、术后5 d分别抽取患者清晨空腹状态下的肘静脉血5ml,采用免疫混悬计检法的免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)三项体液免疫指标进行检测。
(3)术后并发症[9]:常见并发症有胰瘘、感染、消化道出血、吻口合瘘、胃排空延迟,各项并发症发生例数/总例数×100%=总发生率。
1.5 统计学方法
采用SPSS 22.0统计学软件进行数据分析,符合正态分布的计量资料用“均数±标准差”表示,组间均数比较采用t检验;计数资料组间率的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组术前1 d、术后5 d营养状况比较
两组术前1 d TRE、PAB、ALB比较差异无统计学意义(P>0.05);术后5 d,观察组TRE、PAB、ALB均高于对照组,差异有统计学意义(P<0.05),见表1。

表1 两组术前1 d、术后5 d的营养状况比较(g/L)
2.2 两组术前、术后免疫功能比较
两组术前1 d免疫功能比较差异无统计学意义(P>0.05);术后5 d,观察组IgA、IgG、IgM均高于对照组,差异有统计学意义(P<0.05),见表2。
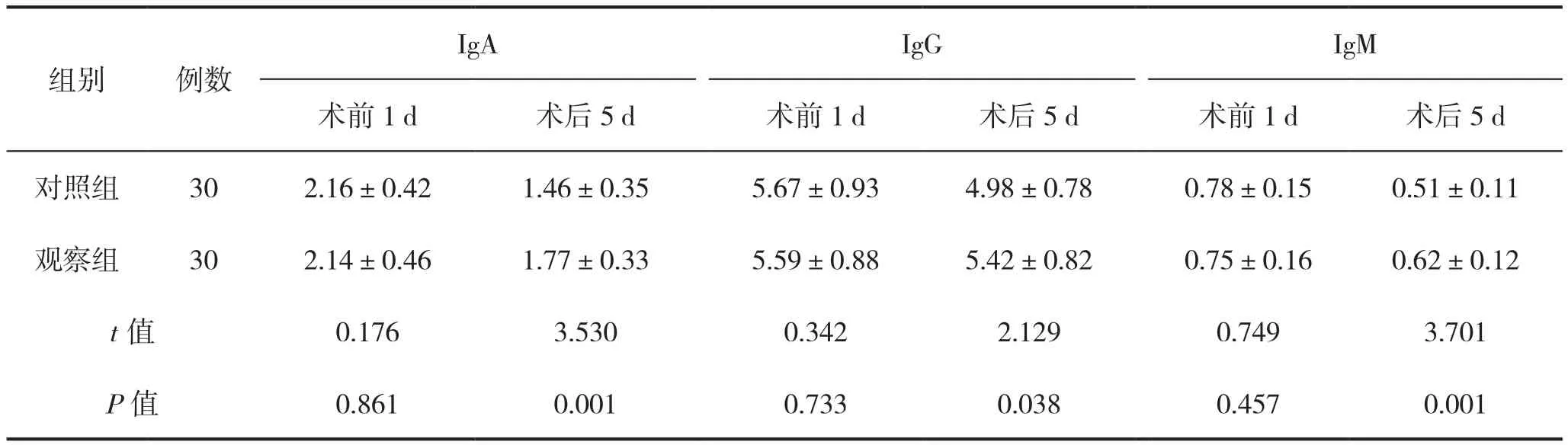
表2 两组术前1 d、术后5 d的免疫功能比较(g/L)
2.3 两组术后并发症发生率比较
术后,观察组术后并发症发生率低于对照组,差异有统计学意义(P<0.05),见表3。

表3 两组术后并发症发生率比较
3 讨论
胰腺癌的发生通常是由遗传因素、环境污染、生活不规律、滥用非类固醇类抗炎药所致,患者常表现为消瘦、乏力、腹痛等,具有较高病死率[10]。目前,手术是帮助胰腺癌患者延长生存周期的主要手段,但由于该手术创口较大,且操作复杂,患者术后并发症发生率较高,往往需要较长时间方能康复。因此,科学、有效的护理干预对提高患者治疗效果、延长其生命周期具有非常重要的意义。
本次研究中,观察组术后5 d的TRE、PAB、ALB等营养指标水平均高于对照组,与既往研究结果一致[11]。原因在于,临床护理路径在患者入院后便根据其各个阶段的治疗情况有计划、有针对性地进行干预,虽然可以确保护理工作的规范性与全面性,但是其忽略了手术治疗会对胰腺癌患者的生理功能产生干扰,加上疾病本身及其术后康复时间较长,若长时间术后禁食会导致机体缺乏营养。而在临床护理路径中融入ERAS则可以在术前做好充分准备,如与患者做好术前沟通、胃肠道准备、营养支持等,使患者的负性情绪及应激损伤有所减轻,术中对液体加温和进行保温护理,可以使机体的分解代谢减少,从而有效控制机体营养流失[12]。此外,ERAS鼓励患者早期进食和下床活动,可以有效促进肠蠕动恢复,缩短患者的禁食时间,从而维持机体的营养状态。
本次研究中,观察组术后IgA、IgG、IgM等免疫功能指标均高于对照组,与既往研究一致[13]。原因在于,ERAS主张让患者尽早下床活动、尽早拔除导管,术后根据患者的病情改善情况,在其耐受范围内合理安排每天的运动时间、频率等,从而促进血液循环,加快新陈代谢,增强机体免疫力;尽早拔除导管则可以在缓解患者负性情绪的同时,减轻其应激反应,有利于其恢复运动,促进机体免疫功能的提升[14-15]。本次研究中,观察组并发症发生率低于观察组,说明ERAS对胰腺癌患者来说可提高其手术治疗的安全性。原因在于,ERAS在术中减少腹腔引流管的放置,可以缓解腹胀,并降低吻合口瘘的发生率;术后采用多模式镇痛,可以提高患者早期活动、进食的依从性,促进肠道功能恢复和切口愈合,从而减少了感染、消化道出血、胃排空延迟等并发症的发生;术后尽早拔管则可以避免长时间放置引流管所致的胰瘘、感染、流脓等并发症[16-17]。ERAS结合临床护理路径对胰腺癌患者进行护理干预最关键的是优化术后镇痛,鼓励患者早期进食和运动。与单纯临床护理路径相比,该护理理念在循证医学指导下,贯穿于整个治疗过程中,以促进患者快速康复为目标,将各个护理环节具体化,令护理工作更为完善与细致,最终达到令患者及其家属满意的护理效果[18-19]。
总之,对胰腺癌患者实施ERAS结合临床护理路径干预,可减轻手术对机体营养状态、免疫功能的影响,减少并发症的发生。
