合并冠心病的经导管主动脉瓣置换术患者管理及处理策略
2022-02-22陈姣华李捷孙英皓罗建方
陈姣华 李捷 孙英皓 罗建方
主动脉瓣狭窄(aortic stenosis,AS)是发达国家最常见的心脏瓣膜疾病,65岁以上人群的患病率为2%~7%[1]。采用外科手术进行主动脉瓣置换在过去很长一段时间是治疗重度AS的唯一手段,但很多患者由于手术风险过高无法进行外科手术。经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)的引入使得重度AS患者的治疗有了更多选择,并且其应用范围已经从高龄、高危AS患者扩展到较年轻的、低危的重度AS患者[2]。TAVR患者中冠心病的发病率较高,但各研究对冠心病患者的纳入标准不统一。TAVR患者合并冠心病时是否需要进行经皮冠状动脉(下称冠脉)介入术(percutaneous coronary intervention,PCI),PCI是否需与TAVR一站式进行,TAVR后冠脉再介入方式有哪些等问题相关数据信息尚少。本文对合并冠心病的TAVR患者管理及处理策略进行探讨。
1 TAVR患者合并冠心病的流行病学
AS和冠心病患者有共同的危险因素(如高龄、高血压、高血脂、抽烟)及相似的症状(如胸痛、气促等)。不同研究报道的TAVR患者中冠心病发病率为38.0%~74.9%,这可能是由于各研究组对于纳入患者合并冠心病的诊断标准有区别[3]。有研究将有过血运重建(PCI史或者冠脉搭桥手术史)的患者认定为冠心病患者[4];有研究则将冠心病定义为1支及以上血管狭窄>50%[5];也有研究将冠心病定义为既往有血运重建史或者血管狭窄>50%[6]。TAVR患者中冠心病发病率很高,PARTNERⅡ和SURTAVI两项RCT研究比较了中危AS患者进行TAVR或外科手术的预后,在纳入患者中合并冠心病者>60%[7-8]。然而,在这些冠心病患者中是否需要进行血管再通仍然有争议[9]。
2 是否血运重建及是否完全血运重建
血运重建可改善血流动力学并且降低血栓风险。但是PCI可能出现靶血管重建失败或支架内血栓等严重并发症;PCI后抗栓药物的使用也会增加出血风险。ACTIVATION研究将合并冠心病拟行TAVR的235例患者随机分为PCI组(119例)和非PCI组(116例),研究团队近期报道了其1年的随访结果:两组的主要复合终点事件(病死率或再住院率)比较差异无统计学意义(41.5%比44.0%,P>0.05);PCI组有更高的出血事件(44.5%比28.4%,P<0.05)。值得注意的是,研究者并未将急性心肌梗死和急诊血运重建作为主要终点事件[10]。
既往各研究对于冠心病定义不尽相同,Stefanini等[11]研究发现TAVR治疗后1年主要不良心血管事件(major adverse cardiovascular event,MACE)发生率随着SYNTAX评分(SYNTAX score,SS)升高而增加,发生MACE患者中,无冠心病的患者占12.5%,低SS(0~22分)的患者占16.1%,高SS(>22分)的患者占29.6%,两者比较差异有统计学意义(P<0.05)。值得注意的是,高SS的患者更多的是进行了不完全血运重建;残余SS>14分的患者有更高的MACE发生。因此,针对前文提到的各研究组对于冠心病纳入人群标准不同,笔者建议使用SS来制定冠心病患者纳入标准,因其可提供准确的基线冠心病以及PCI后残余冠心病以及临床终点等信息,便于制定治疗方案。
合并冠心病的TAVR患者是否应进行完全血运重建,众多研究所得到的结论不一致。Witberg等[12]研究了1 270例TAVR患者,发现未行完全血运重建(残余SS>8分)是死亡的独立危险因素(HR=1.72,95%CI:1.05~2.81,P<0.05)。而Paradis等[13]回顾性研究了377例TAVR患者,发现其SS与MACE不呈正相关,并且完全血运重建(残余SS<8分)与改善预后不相关。TAVR患者合并冠心病是否应行PCI或者是否该完全血运重建,还有待更多随机对照临床试验来解答。目前TAVR患者合并冠心病的冠脉治疗原则与单纯的动脉粥样硬化性心脏病患者相同:有重度冠脉病变如左主干、左前降支近端或者多支病变的患者应该进行PCI[3]。2021年欧洲心脏病学会瓣膜病指南建议TAVR患者冠脉近端狭窄>70%考虑行PCI(Ⅱa);TAVR患者拟行二尖瓣介入和冠脉近端狭窄>70%考虑行PCI(Ⅱa)[14]。
3 功能性检查
3.1 无创检查多排计算机断层扫描(multiple-slicespiral computed tomography,MSCT)、基于计算机断层扫描血管造影衍生的血流储备分数(computerised tomography angiography-derived FFR,CTFFR)、负荷超声心动图、单光子发射计算机断层成像术(single-photon emission computed tomography,SPECT)、正电子发射断层成像术(positron emission tomography,PET)、心脏磁共振均有助于诊断评估TAVR患者合并冠心病情况。
MSCT是目前TAVR影像学评估的主要手段,通过三维重建,可多切面观察瓣膜形态,评估瓣膜厚度、钙化程度及其在主动脉根部所占体积,并在瓣环平面测量瓣环的周长和面积,继而计算瓣环内径,为瓣膜型号、类型选择提供依据,评估术后瓣周漏的风险;同时MSCT还可评估冠脉开口的高度,预测冠脉阻塞风险以及评估冠脉病变,也可对血管入径进行评估。
通过标准的CT采集,CT-FFR可提供冠脉解剖信息、评估其功能从而帮助诊断。Michail等[15]将42例患者分别行侵入性FFR和计算机体层摄影血管造影(computed tomography angiography,CTA);其中通过CTA分析CT-FFR 39例。侵入性FFR和CT-FFR的平均值分别是0.83±0.10和0.77±0.14。经单支血管分析,侵入性FFR与CT-FFR呈正相关(r=0.64,P<0.01),准确度为76.7%,说明CT-FFR对于AS患者评估冠脉情况较为可靠。
3.2 有创检查包括冠脉造影、FFR、瞬时无波形比值(instantaneous wave-free ratio,iFR)。冠脉造影是诊断评估冠脉病变的金标准。Lunardi[16]等回顾性研究比较了重度AS患者单纯冠脉造影指导的PCI组和FFR指导的PCI组的结果。随访两年,后者有78.2%的血管为阴性(FFR<0.8)。FFR-PCI组的生存率更高(82%比92.6%,HR=0.4)。该观察性的研究结果提示FFR指导有助于PCI决策。然而对于合并冠心病的TAVR患者,FFR的诊断界值是否应与单纯冠心病患者一样等问题未作出确定答复。
与FFR相似,iFR是一个不需要应用冠脉血管扩张药物评价冠脉血管狭窄程度的新的生理学压力指标。Scarsini等[17]研究了合并冠心病的患者进行TAVR时冠脉血流动力学的改变,结果发现综合FFR与iFR结果制定的治疗方案,可以使63%的患者避免使用腺苷。
4 血管再通时机
严重AS合并冠心病患者究竟应该一站式进行TAVR和PCI还是分期行TAVR和PCI,目前尚无定论。SURTAVI研究对于行TAVR和PCI患者的亚组分析中,将52例一站式行TAVR和PCI的患者和76例分期行PCI和TAVR(PCI后平均间隔6 d完成TAVR)的患者进行了比较。两组患者主要终点包括全因死亡、脑卒中事件比较差异均无统计学意义(均P>0.05);但是对于分期PCI和TAVR组的患者,其造影剂用量以及急性肾损伤比例较高(2.0%比11.8%,P<0.05)。值得注意的是,在临床特征基线比较中显示分期手术患者心绞痛比例更高(17.3%比38.2%,P<0.01),提示研究者倾向于对心绞痛症状明显患者先行PCI再行TAVR[18]。目前尚无RCT研究比较一站式手术和分期手术的差异。2020年美国心脏协会/美国心脏病学会瓣膜病指南建议对左主干和冠脉近端狭窄患者在TAVR前行PCI(Ⅱa)[19]。
5 冠脉再介入的难点
前文提到冠心病在中危TAVR患者中发病率很高。Mentias等[20]报道,在14万TAVR患者中,4.7%的患者在术后1年内由于急性冠脉综合征住院,并且其中有48%的事件发生在6个月内。鉴于冠脉粥样硬化疾病持续进展,大部分合并冠心病的TAVR患者在某个时刻可能需要进行冠脉造影或者PCI。TAVR治疗后急性冠脉综合征,行血管再通显著降低病死率。Boukantar等[21]的研究显示16例植入自展瓣患者中,只有9例成功进入两个冠脉口,其中7例拟进行PCI,而仅有6例成功。TAVR治疗后再进入冠脉口的主要困难在于缺少指引导管的支持。同时会影响到冠脉再介入的因素有:瓣膜的设计和选择、释放的位置、植入瓣膜和原生瓣膜瓣叶的相互影响、冠脉开口的高度、主动脉窦的宽度及高度等[22]。自展瓣植入深度相当关键:若冠脉开口<10 mm,Evolut-PRO的裙部高度最低为13 mm,需将瓣膜放置在瓣环4 mm以下以确保裙部不会遮盖住冠脉。自展瓣的优势在于,若只部分瓣膜展开,仍可调整释放位置。若瓣膜释放位置过高,由于其窄腰设计,距离Valsalva窦仍有空间,则冠脉阻塞不一定会发生。然而这种情况下,选择性造影较困难。此时可考虑采用带短头的指引导管如JR4挂冠脉口。急性冠脉阻塞在球扩瓣中更常见[23]。新款Sapien 3较Sapien XT更长,因而可能更易影响冠脉再介入。但Sapien 3的网眼较Sapien XT大38%,所以冠脉阻塞不一定会发生。球扩瓣释放还需注意窦管交界(sinotubular junction,STJ)的宽度和高度。若展开时超过STJ,冠脉再介入则更加困难。
对于自展瓣,冠脉再介入的导管选择有以下注意事项:鉴于CoreValve的窄腰设计,左冠脉(left coronary artery,LCA)的衔接需要使用比常规型号更小的导管,可用JL3.5或JR4指引。可将Ikari right指引导管作为二线方案。衔接右冠状动脉(right coronary artery,RCA),JR4导管是首选。当Valsalva窦较宽时,可使用尖端较长的导管,如AR2、JR4.5或Ikari right导管。若联合部位于冠脉口前方,则首选MP或Ikari right导管。LCA介入治疗的首选是FL3.5/3.0导管。RCA介入治疗则首选FR4导管(图1至图2)。
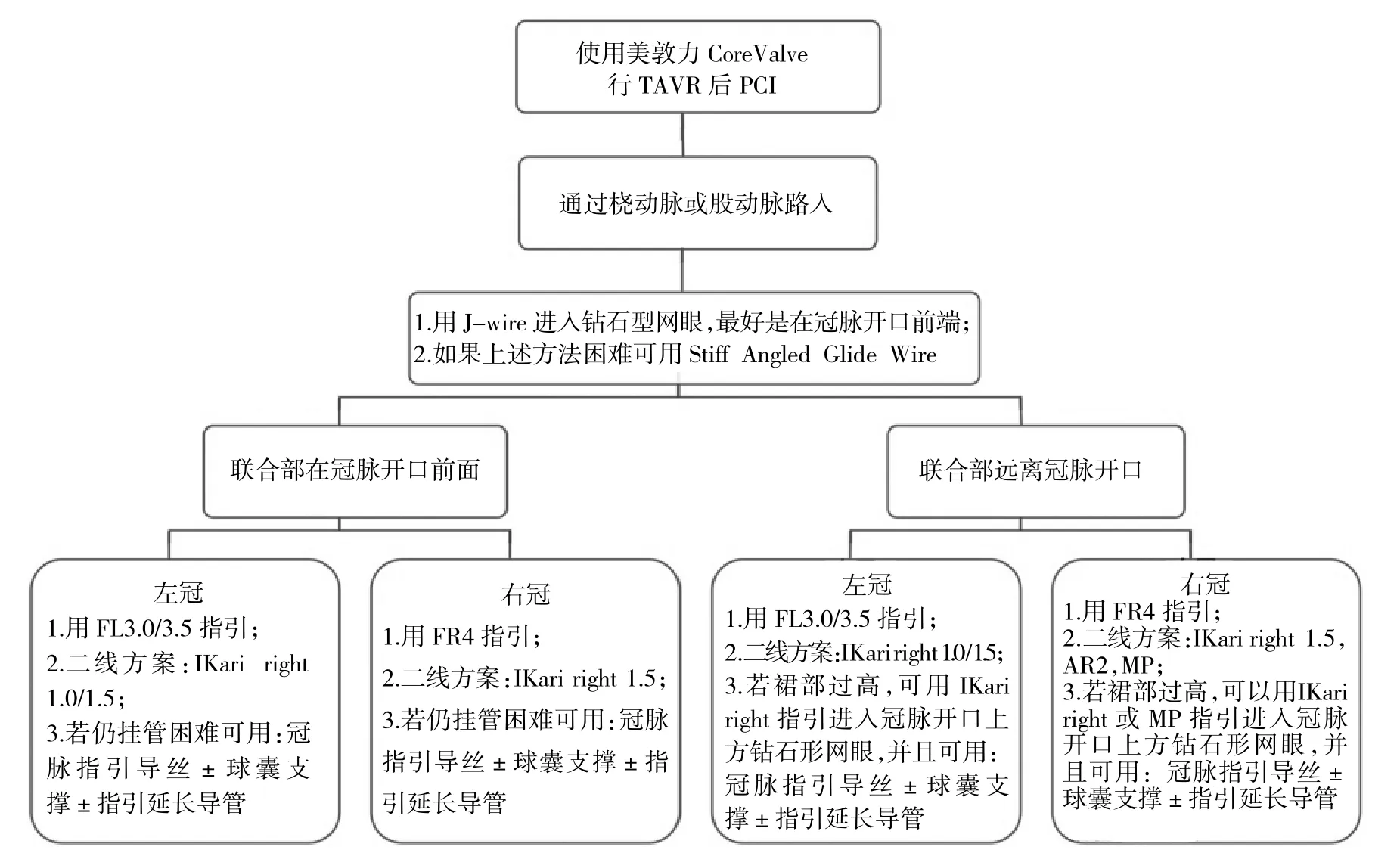
图2 使用自展瓣行TAVR后PCI流程图
对于球扩瓣冠脉再介入的导管选择:球扩瓣的瓣膜框架通常延伸至冠脉开口上方,选择性造影通常可行,因此可选择使用常规造影导管。如遇困难,可能是联合部位与冠脉开口的位置重叠,此时建议将导管放在临近网眼行非选择性造影。拟行PCI时,可使用冠脉导丝从主动脉进入冠脉作为导轨。若导管衔接和支撑不理想,可考虑使用延伸导管(图3至图4)。
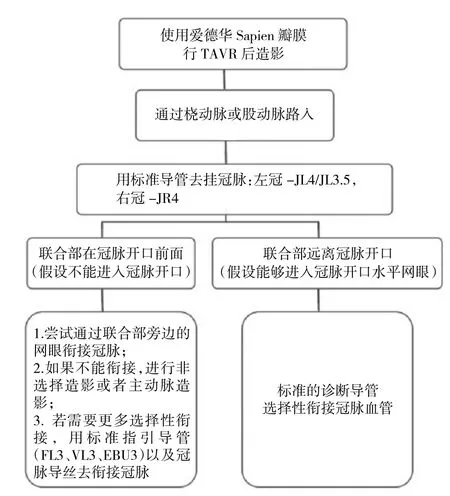
图3 使用球扩瓣行TAVR后冠脉造影流程图
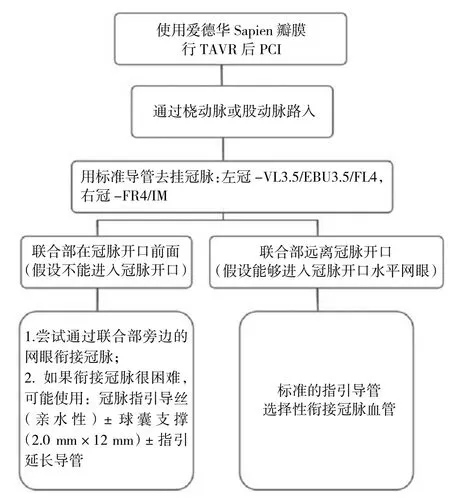
图4 使用球扩瓣行TAVR后PCI流程图
近年来,有国外学者提出通过调整瓣膜缝合区低位和冠状窦同轴的方法,以减少冠脉再介入的难度。Align TAVR研究结果显示,术前Sapien 3装瓣的方向对最终瓣膜交界处是否对齐没有影响,交界处与左主干重叠的总发生率为36.9%,与RCA重叠为38.7%,两条冠脉同时重叠为23.6%,因冠脉和导管大部分时候能在瓣架上通过,Sapien 3的低瓣架使得其对交界处对齐的要求降低。而Evolut瓣膜使用特定的“Hat”标记可提高交界处对准率,Evolut组患者严重冠脉重叠率仅为31%,而Sapien 3高达为51.3%[24]。
TAVR治疗后冠脉造影或PCI具有挑战,所以在冠脉介入的时机选择上,医生更愿意在TAVR前或者TAVR中同步解决冠脉问题。各个瓣膜生产厂家也在设计上尽可能保护冠脉开口,球扩瓣因为其短瓣架的设计,天然对冠脉开口有保护作用。而长瓣架的自展瓣,则通过适当增大腰部网眼(例如微创瓣膜)或者缩短瓣膜长度(例如乐普瓣膜)等来减少冠脉再介入的难度。瓣膜的设计以及它与冠脉开口、法氏窦、STJ的位置关系可以帮助预测冠脉再介入的难度以及制定手术方案。推荐的流程图(图1至图4)可以帮助处理解决复杂的临床情况。
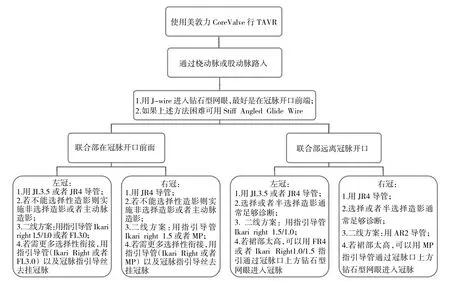
图1 使用自展瓣行TAVR后冠脉造影流程图
6 总结及展望
TAVR的应用使重度AS患者的治疗方式呈现革命性的改变。重度AS合并冠心病发病率很高。功能学检查对评估冠脉病变及指导PCI在AS合并冠心病的患者中具有重要意义。合并AS的冠心病患者冠脉干预的指征与单纯冠心病相似,但在实施PCI与TAVR治疗时,应该选择一站式还是分期进行,尚无定论。其次,TAVR治疗后的冠脉再介入具有一定的挑战性,自展瓣和球扩瓣进行冠脉再介入的策略和技巧有所不同。虽然自展瓣冠脉再介入难度更高,但有望通过瓣膜设计改良降低冠脉再介入的难度。对于合并冠心病的TAVR患者的管理及处理策略,仍待进一步研究以提供更全面的指导。