微囊化溶剂对吡唑醚菌酯微囊悬浮剂应用性能的影响
2022-02-22曹海潮狄春香刘然鹏李北兴
王 瑞, 曹海潮, 狄春香, 管 磊,刘然鹏, 李北兴, 刘 峰*,
(1. 山东农业大学 植物保护学院,山东 泰安 271018;2. 山东省农村经济管理服务总站,济南 250013;3. 江苏省连云港市海州区板浦镇农村经济和农业技术服务中心,江苏 连云港 222000)
随着人们环保意识和安全意识的提高,农药制剂中芳烃类等危害人体健康、存在安全风险的有机溶剂已逐步被限制或取代[1]。近年来,性能稳定、成本低廉、环境友好的酯化植物油类溶剂已逐渐替代二甲苯等用于农药乳油、油悬浮剂等剂型中[2]。其中,植物源衍生物油酸甲酯在叶面喷雾应用中具有较高的作物安全性,有助于增加药剂对叶面的黏附和渗透,提高药效[3-4]。研究发现,油酸甲酯对磺草酮、莠去津和烟嘧磺隆均有增效作用[5]。油酸甲酯可破坏害虫体壁的蜡质层,促进药液的吸收和渗透。以油酸甲酯为溶剂的阿维菌素乳油对棉蚜Aphis gossypiiGlover、美国白蛾Hyphantria cunea、桑白蚧Pseudaulacaspis pentagonaTargioni)的室内毒力和药效均高于普通乳油[3]。油酸甲酯还可通过延长杀菌剂在菌丝体上的滞留时间而增加渗透性,从而提高药效[6]。
对现有剂型进行改造,开发“安全、高效、环保”的农药制剂,进一步提高农药利用率,也是目前农药制剂研究的方向之一[7]。近年来,微囊相关剂型的制剂数量逐年增加[8]。在制备农药微囊时,有机溶剂的作用是溶解或稀释原药形成油相,其中芳烃[9]、甲醇[10]、N,N-二甲基甲酰胺 (DMF)[11]等是常用溶剂,但其对人体健康与环境安全存在一定风险[12-13],有必要开展微囊剂型中溶剂的优化工作。
本研究采用界面聚合法,以4,4′-二异氰酸酯二苯甲烷 (MDI) 为油相单体,以聚乙二醇 (PEG400)为水相单体,分别以油酸甲酯和150# 溶剂油为溶剂,制备了9%吡唑醚菌酯微囊悬浮剂。通过比较制剂稳定性、表征载药微囊性能及验证对花生叶斑病田间防治效果,评价以油酸甲酯作为吡唑醚菌酯微囊悬浮剂油相溶剂的可行性与应用潜力,以期为农药制剂的环境友好化提供依据。
1 材料与方法
1.1 供试材料与主要仪器
98%吡唑醚菌酯(pyraclostrobin)原药 (山东康乔生物科技有限公司) ;油酸甲酯 (工业级,北京广源益农有限公司) ;150# 溶剂油 (工业级,淄博高凯化工有限公司) ;木质素磺酸钠 (98%,美国MeadWestvaco 公司) ;4'-二异氰酸酯二苯甲烷(MDI,99%,山东万华化学集团股份有限公司) ;聚乙二醇 (PEG400,99%,山东豪顺化工有限公司) ;辛基酚聚氧乙烯醚 (工业级,OP-10,江苏省海安石油化工厂) ;黄原胶 (工业级,山东淄博中轩生化有限公司) ;乙二醇 (分析纯,天津科密欧化学试剂有限公司) ; 吡唑醚菌酯乳油 (250 g/L,巴斯夫欧洲公司) ;试验用水为去离子水。
TENSOR II 红外光谱仪 (德国布鲁克公司) ;DTG-60 型差热热重同步分析仪 (日本岛津公司) ;SS-550 扫描电子显微镜 (日本岛津公司) ;LSPOP (6) 激光粒度分析仪 (珠海欧美克仪器有限公司) ;高效液相色谱仪安捷伦1200 (安捷伦科技有限公司) ;HH-4 超级恒温水浴锅 (金坛区西城新瑞仪器厂) ;JJ-1 型数显测速电动搅拌器 (常州国华电器有限公司) ;T18 剪切分散机 (德国 IKA 公司) 。
1.2 试验方法
1.2.1 溶剂/原药配比筛选 模拟农药微囊悬浮剂制备与储存过程中油相状态变化,筛选合适的原药与溶剂配比。将油酸甲酯、150# 溶剂油分别与吡唑醚菌酯原药按质量比4 : 1、2 : 1、1 : 1、1 : 2 混合,装入样品瓶中密封,水浴 (70 ℃) 3 h后,于室温下静置7 d,观察原药晶体析出情况,并拍照记录。
1.2.2 载药微囊制备 采用界面聚合法制备载药微囊[14]。保证油相与水相质量比为2 : 5,制备不同溶剂/原药的吡唑醚菌酯微囊悬浮剂。以制备100 g样品为例,按表1 称取吡唑醚菌酯原药,按比例分别加入油酸甲酯或150# 溶剂油,加热至完全溶解,冷却至室温,加入1 g MDI,溶解后获得油相;用66 mL 去离子水溶解2.5 g 分散剂木质素磺酸钠、0.5 g 乳化剂OP-10 与2 g 水相单体PEG400,获得水相。将油相缓慢注入水相,使用高速剪切机于15000 r/min 下剪切,获得稳定的水包油乳液。将乳液转移至三颈烧瓶中,水浴 (70 °C) 中固化3 h (于2 h 时加入0.15 g 黄原胶与2 g 乙二醇)。固化完成后,补齐在固化过程中损失的水分,即得到分别以油酸甲酯和150# 溶剂油为溶剂的9%吡唑醚菌酯微囊悬浮剂。

表1 吡唑醚菌酯微囊悬浮剂配方中的溶剂和原药用量Table 1 The dosages of solvent and technical material in pyraclostrobin microcapsule suspensions
1.2.3 溶剂/原药对吡唑醚菌酯微囊悬浮剂制剂稳定性的影响 分别采用文献方法[15-16]评价吡唑醚菌酯微囊悬浮剂热贮与冷贮稳定性;另外,将微囊悬浮剂于室温条件下放置2 a,观察稳定性。通过测定其冷、热贮稳定性,选取稳定性最优的两种不同溶剂制备的微囊悬浮剂进行下一步研究。
1.3 载药微囊的表征
1.3.1 形貌与粒径分布 将微囊悬浮剂用去离子水稀释至适宜浓度,取适量稀释液涂于硅片表面,于室温晾干24 h 后,用扫描电子显微镜 (SEM)观察载药微囊形貌。
将微囊悬浮剂用去离子水稀释至适宜浓度,使用激光粒度分布仪测定载药微囊的粒径。
1.3.2 热稳定性与红外光谱分析 将微囊悬浮剂用去离子水稀释后于2500 r/min 下离心,去除上清液后,加入去离子水,振荡悬浮,再次离心获得沉淀。重复3 次。将沉淀物 (载药微囊) 涂于玻璃板上于室温条件下晾干。用热重分析仪对载药微囊、吡唑醚菌酯原药和油酸甲酯分别进行热重分析。测试条件为以20 °C/min 升温至500 °C。
用傅里叶红外光谱仪分别测定载药微囊、吡唑醚菌酯原药、油酸甲酯、150# 溶剂油和MDI 的红外吸收光谱。
1.3.3 包封率与释放性能测定 以正己烷为溶剂对微囊悬浮剂中游离的吡唑醚菌酯进行萃取[17]。称取1 g 微囊悬浮剂于玻璃样品瓶中,加入10 mL正己烷,置于滚管器上匀速 (70 r/min) 滚动30 min;取0.5 mL 上层正己烷溶液过0.22 μm 有机滤膜,用高效液相色谱仪 (HPLC) 测定吡唑醚菌酯的质量浓度,同时计算出微囊悬浮剂中吡唑醚菌酯的游离率。按公式 (1) 计算微囊悬浮剂的包封率 (E) ,按公式 (2) 计算微囊悬浮剂中吡唑醚菌酯的游离率 (R) 。

其中,c1为正己烷中吡唑醚菌酯的质量浓度,mg/L;V1为正己烷的体积,L;m1为微囊悬浮剂中吡唑醚菌酯的总质量,mg。
使用快速释放液测定载药微囊的释放性能[17]。用去离子水将微囊悬浮剂稀释至450 mg/L,取10 mL 稀释液于玻璃样品瓶中,先后加入80 mL正己烷与10 mL 甲醇后静置;分别于5、10、15、20、25、30、40、50 和60 min 取0.5 mL 上层正己烷溶液,过0.22 μm 有机滤膜,用HPLC 检测吡唑醚菌酯的含量。每次取样后补充等体积的正己烷以保持释放体系中正己烷的总量不变。
色谱条件:色谱柱为C18不锈钢柱 (250 mm ×4.6 mm) ;流动相为V(甲醇) :V(水) = 80 : 20;流速1.0 mL/min;柱温25 ℃;检测波长275 nm;进样量20 μL。
按公式 (3) 求得累积释放速率 (ε) 。

式中,c2为正己烷中吡唑醚菌酯的质量浓度,mg/L;V2为正己烷的体积,L;m2为微囊悬浮剂稀释液中吡唑醚菌酯的总质量,mg。
1.3.4 抗紫外光解性能测定 采用人工模拟紫外老化法对载药微囊的抗紫外光解性能进行评价[18]。将微囊悬浮剂用去离子水稀释20 倍,取0.2 mL均匀涂抹于载玻片 (25 mm × 75 mm) 上,于室温下避光晾干后,再稀释20 倍置于20 μW/cm2的紫外光下,分别于0、10、30、60、100、150 和200 min 依次取出玻片,用20 mL 甲醇对剩余的吡唑醚菌酯进行超声萃取30 min。使用HPLC 测定吡唑醚菌酯的含量。按公式 (4) 求得吡唑醚菌酯的光解剩余率 (ρ) 。

式中,c3为甲醇中吡唑醚菌酯的质量浓度,mg/L;V3为甲醇的体积,L;m3为涂于载玻片上的微囊悬浮剂稀释液中吡唑醚菌酯的总质量,mg。
1.4 吡唑醚菌酯微囊悬浮剂防治花生叶斑病田间药效试验
2018 年9 月6 日于山东省泰安市岱岳区大汶口镇东大吴村 (117.13°E,35.97°N) 进行田间药效试验。花生品种为大白沙,于6 月24 日播种,生长期间未进行其他叶部病害防治与花生控旺处理。供试药剂为9% 吡唑醚菌酯微囊悬浮剂 (以油酸甲酯为溶剂) 与9% 吡唑醚菌酯微囊悬浮剂 (以150# 溶剂油为溶剂) ,对照药剂为250 g/L 吡唑醚菌酯乳油,施药剂量均为有效成分2250 g/hm2,用水量为6750 L/hm2,以清水处理为空白对照。每处理设3 次重复,每小区面积为 20 m2,随机区组排列,小区间设有保护行。分别于施药前及施药后7、15、22 和32 d,按照文献方法[19]调查发病情况。分级标准:0 级,无病;1 级,病斑面积占整片叶面积的5%以下;3 级,病斑面积占整片叶面积的6 % ~ 25 %;5 级,病斑面积占整片叶面积的26 % ~ 50 %;7 级,病斑面积占整片叶面积的51 % ~75 %;9 级,病斑面积占整片叶面积的76 %以上。
病情指数 (D) 根据公式 (5) 计算,防治效果(E) 根据公式 (6) 计算。

式中,G为各级病叶数;i为相对级数值;L为调查总叶数;Db为空白对照区病指;Dc为处理区病指。
1.5 数据处理与分析
运用DPS 数据处理软件对试验中所获得数据进行单因素方差分析,采用Tukey 法比较各处理间的差异显著性,图表使用Origin 绘图软件绘制。
2 结果与分析
2.1 溶剂原药筛选
在原药与有机溶剂质量相同的前提下,通过改变二者的配比,模拟药剂在囊芯的溶解状态。如图1 所示,于室温 (20 ℃) 放置48 h 时只有150# 溶剂油、原药质量比为4 : 1 和2 : 1 的原药能溶解,这与王仁飞等[20]报道的150# 溶剂油对吡唑醚菌酯原药的溶解度明显优于油酸甲酯是一致的,而经过70 ℃预热3 h 时,则原药全部溶解,制备过程中不会有晶体析出。于室温 (20 ℃) 下放置7 d 后,在150# 溶剂油为溶剂的处理组中,仅150# 溶剂油与原药质量比为1 : 2 的处理中有少量晶体析出;在油酸甲酯的处理组中,各处理比例均有药剂晶体析出,且随着溶剂、原药质量比的降低而增多。

图1 溶剂原药比例筛选Fig. 1 Screening the proportion of solvent and technical material
2.2 囊芯状态对吡唑醚菌酯微囊悬浮剂稳定性的影响
将所制备的吡唑醚菌酯微囊悬浮剂分别进行冷、热贮 (14 d) 及常温存放 (2 a) ,通过对比制剂中原药晶体的析出量评价制剂的稳定性。常温放置2 a 的制剂稳定情况如图2 所示,溶剂、原药质量比显著影响微囊悬浮剂的稳定性,表现为随油相中原药比例的升高,微囊悬浮剂的稳定性下降。另外,通过光学显微镜观察发现,在大量晶体析出的样品中,存在微囊囊壳破裂的现象,根据囊芯模拟的结果推测,囊芯中药剂晶体可沉积于囊壁,刺破囊壳引起囊芯释放,从而形成大量晶体。另外,在溶剂、原药质量比为4 : 1 的样品中,出现了制剂分层现象,这是由于囊芯中溶剂含量较高,导致载药微囊密度较低,于水相上层聚集 (表2) 。本研究以溶剂、原药质量比为2 :1 制备不同溶剂的9%吡唑醚菌酯微囊悬浮剂进行后续测定。

图2 不同溶剂原药质量比条件下制备的微囊悬浮剂稳定性情况 (常温放置2 a)Fig. 2 Stability of microcapsule suspensions with different proportions of solvent and technical material(Storage at room temperature for 2 years)

表2 9%吡唑醚菌酯微囊悬浮剂稳定性Table 2 The stability of 9% pyraclostrobin microcapsule suspension
2.3 微囊悬浮剂的表征
2.3.1 微囊形貌与粒径分布 如图3A 所示,两种溶剂制备的微囊均为凹陷的球体,囊壳为光滑的无孔膜。其粒径与激光粒度分布仪中测定的数据相同。两种溶剂制备的微囊粒径分布见图3B,以150# 溶剂油和油酸甲酯为溶剂制备的微囊的D50分别为2.63 μm 和2.92 μm,且符合正态分布。

图3 不同溶剂制备的吡唑醚菌酯微囊的扫描电镜图(A) 与粒径分布图(B)Fig. 3 SEM of microcapsules (A) and particle size distribution of microcapsules (B) prepared with different solvents
2.3.2 微囊的热重分析 图4 分别是吡唑醚菌酯原药、吡唑醚菌酯 (150# 溶剂油) 微囊、吡唑醚菌酯 (油酸甲酯) 微囊的热重分析 (TGA) 谱图 (A) 和差式扫描量热法 (DSC) 谱图 (B) 。由图可知,吡唑醚菌酯 (图4A-a 曲线) 的熔融峰267 ℃,只有一个质量损失阶段;吡唑醚菌酯 (150# 溶剂油) 微囊(图4B-c 曲线) 有两个质量损失阶段,在第一个质量损失阶段是囊芯中溶剂的挥发,第二个阶段是微囊壁材的损失;吡唑醚菌酯 (油酸甲酯) 微囊(图4B-b 曲线) 也只有一个质量损失阶段,是由于吡唑醚菌酯 (油酸甲酯) 微囊的溶剂油酸甲酯的挥发峰和吡唑醚菌酯的挥发峰重合所致。且在DSC谱图中,两种微囊中的吡唑醚菌酯熔融温度均比吡唑醚菌酯原药高,这是由于囊壳材料对原药保护作用造成的。结合微囊的形态,可以判断吡唑醚菌酯被包裹在囊壳材料中。

图4 TGA (A) 谱图和DSC (B) 谱图Fig. 4 TGA (A) and DSC (B) spectrogram diagram
2.3.3 红外分析 (FTIR) 从图5 可以看出,两种微囊红外光谱基本一致,吡唑醚菌酯原药 (图5-e)的红外光谱在1716 cm−1处出现强吸收峰,为吡唑醚菌酯的羰基峰。相对于原药的谱图,两种微囊在1720 ~ 1740 cm−1附近出现羰基复合峰,为吡唑醚菌酯的羰基峰和聚氨酯 (OP-10 与MDI、水与MDI 生成聚脲) 的羰基峰,其中吡唑醚菌酯 (油酸甲酯) 微囊 (图5-a) 的羰基复合峰还包括油酸甲酯的羰基峰。MDI (图5-f) 由于存在异氰酸酯基团,所以在2247 cm−1出现强吸收峰,且在界面聚合后两种微囊的吸收峰显著降低。吡唑醚菌酯 (150#溶剂油) 微囊 (图5-c) 在2965 ~ 2855 cm−1处的吸收峰主要为甲基的C-H 的伸缩振动峰。吡唑醚菌酯 (油酸甲酯) 微囊 (图5-a) 在2922 cm−1和2855 cm−1处为甲基和亚甲基的C-H 的伸缩振动峰。以上结果进一步表明,吡唑醚菌酯被包覆到囊壳材料中。

图5 微囊红外光谱图Fig. 5 FTIR spectra of microcapsules
2.3.4 微囊的包封率和释放曲线 以油酸甲酯为溶剂制备的微囊包封率为96.51 %,以150# 溶剂油为溶剂制备的微囊包封率为95.63 %。
如图6 所示,两种吡唑醚菌酯微囊的释放曲线在60 min 时的释放量几乎达到100%,其中吡唑醚菌酯 (150# 溶剂油) 微囊在20 min 时累积释放量约为50%,而9%吡唑醚菌酯 (油酸甲酯) 微囊在20 min 时累积释放量约为92 %,在释放30 min后达到平衡,表明吡唑醚菌酯 (油酸甲酯) 微囊相对于吡唑醚菌酯 (150# 溶剂油) 微囊释放速度快。
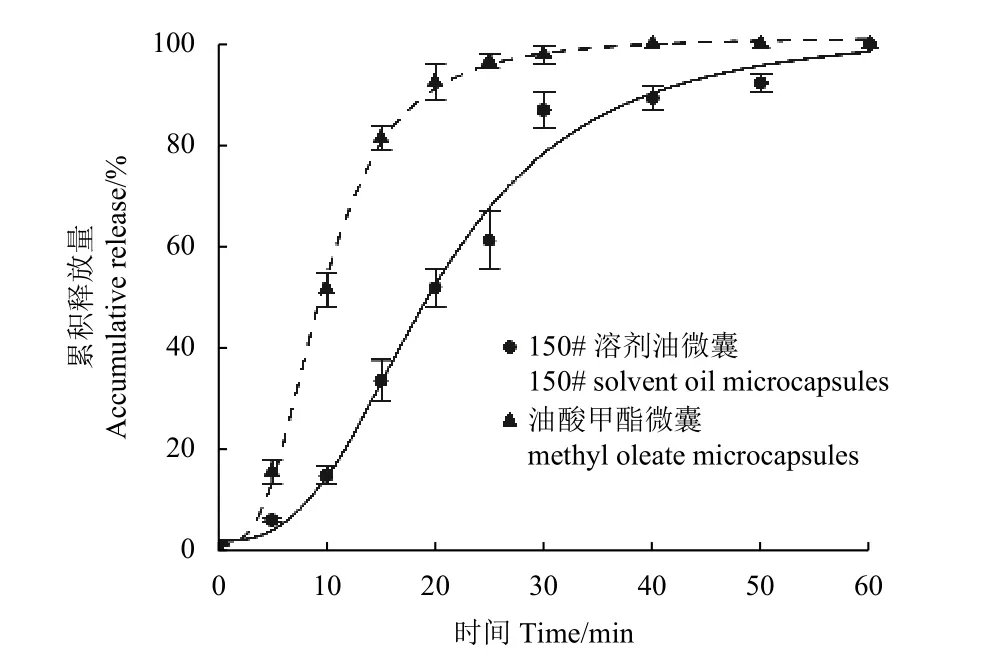
图6 微囊中吡唑醚菌酯的累积释放曲线Fig. 6 Accumulative release curves of pyraclostrobin from the microcapsules
2.3.5 微囊的抗紫外线性能 抗光解能力是决定吡唑醚菌酯在田间使用时持效期的一个重要因素。如图7 所示,两种微囊在0 ~ 60 min 段均快速降解;在60 min,9%吡唑醚菌酯 (150# 溶剂油) 微囊降解剩余量为14.25 %,而9%吡唑醚菌酯 (油酸甲酯) 微囊降解剩余量为52.32 %,二者有较大差异。在100 min 时,9%吡唑醚菌酯 (150#溶剂油) 微囊中的吡唑醚菌酯含量为7.86 %,而9%吡唑醚菌酯 (油酸甲酯) 微囊中的吡唑醚菌酯含量为38.45 %,表明后者相对于前者具有较好的抗紫外线性能,能有效阻止吡唑醚菌酯的光降解。

图7 微囊光解动态曲线Fig. 7 Photolysis dynamic curves of microcapsules
2.4 两种溶剂制备的吡唑醚菌酯微囊悬浮剂对花生叶斑病的田间防治效果
如图8A 所示,施药前各处理的病情指数无显著性差异。施药后7 d,乳油处理组病指低于微囊处理组,表明乳油剂型的速效性较好,可快速控制病情;另外,两种微囊处理组无显著性差异。施药后15 d,各药剂处理组间的病指无显著差异,表明载药微囊持续释放,控制病害。施药后22 d,微囊可提高药剂的抗光解性能,对病害控制效果好,所以微囊处理组的病指显著低于乳油处理组,且两种微囊处理组无显著性差异。施药后32 d,各处理的病指大幅上升,各药剂处理的防效显著下降。
从施药后7 d 和施药后32 d 不同处理的田间照片 (图8B) 来看,施药后7 d,各处理花生叶片均呈绿色,未见脱叶;而在施药后32 d,两种微囊悬浮剂处理组的未见明显落叶,而乳油处理组与清水对照组发生不同程度的落叶,其中,后者脱叶严重甚至死亡。

图8 不同处理防治花生叶斑病试验结果 (同组处理后不同字母表示应用 Tukey 检验在 0.05 水平上差异显著)Fig. 8 Results of controlling peanut leaf spot by different treatments. (same treatment followed by different letters indicated significantly different at the 0.05 level according to Tukey HSD)
3 结论与讨论
本研究分别以油酸甲酯和150# 溶剂油为溶剂制备了9% 吡唑醚菌酯微囊悬浮剂。结果发现,以油酸甲酯作溶剂的微囊中吡唑醚菌酯释放速率更快,抗光解能力更强,在防治花生叶斑病的田间药效试验中防治效果更好且持效期更长,具有较大的应用潜力。
农药微囊作为一种特殊的剂型,其制剂稳定性与溶剂、原药质量比以及溶剂的种类密切相关[21]。利用界面聚合技术制备农药微囊时,需要将原药与油相单体完全溶解于有机溶剂中,形成均一稳定的油相溶液,其中溶剂与原药的比例,通常由溶剂的溶解度决定;另外,根据成囊过程中加热固化的需要,通过预热方式可提高溶剂对药剂的溶解度,从而减少有机溶剂的用量。然而该工艺制备的微囊悬浮剂在恢复常温后,药剂会在微囊中结晶析出,不但降低了微囊悬浮剂的贮存稳定性,而且对药剂的沉积、释放等二次分散行为存在影响。因此,原药溶剂比过高,原药在囊芯中易结晶析出,刺破囊壳,使囊芯成分泄露;原药溶剂比过低,导致微囊密度过小,制剂析水分层。由于低温会严重影响微囊制剂的稳定性,故微囊在存储过程中尽量保持恒温,如需要低温贮存,应选择对原药溶解度大的溶剂或适当降低原药溶剂比。
酯类溶剂相比于芳烃类溶剂更易穿透高分子材料[22],且油酸甲酯对昆虫表皮和叶片上的蜡质层亲和力和渗透力更强[23]。由此推断,油酸甲酯比150# 溶剂油更容易渗透囊壳,因此以油酸甲酯作溶剂制备的微囊药剂释放速率高于以150# 溶剂油作溶剂的微囊。在紫外光照射条件下,以油酸甲酯为溶剂的载药微囊更容易释放,致使部分药剂渗透到底层,紫外光需要穿透囊壳层才能降解药剂,因此其抗光解性能高于150# 溶剂油为溶剂的微囊。在田间应用过程中,以油酸甲酯为溶剂的吡唑醚菌酯微囊悬浮剂,囊芯可被快速释放并对叶面亲和、渗透,提高其对叶部的保护作用,同时其较强的抗光解性能,得以延长对病害的控制作用。另外,油酸甲酯的蒸气压较低,难以挥发,释放的囊芯以油性液体的形态长期附着于叶面;而150# 溶剂油挥发性强,其挥发后药剂形成晶体,容易流失,且其保护面积小于液体状态。因此,这也可能是以油酸甲酯为溶剂制备的吡唑醚菌酯微囊悬浮剂对花生叶斑病控制期更长的原因。
油酸甲酯可生物降解,对环境友好,符合绿色农药的发展要求[24],但对许多农药的溶解度较低,可考虑与溶解度较高的溶剂混合使用来改善对原药的溶解度,还有待进一步研究。
