LED红光对人根尖乳头干细胞增殖和成骨分化的影响
2022-02-22苏雨童侯兰姜冰郑艮子刘源王瑶
牙源性干细胞是目前的研究热点,目前已经被分离和鉴定的人类牙源性干细胞有5 种
。根尖乳头干细胞(human stem cells from apical papilla,hSCAPs)是由Sonoyama 等从成年人的牙齿中分离出来的一组具有干细胞特性的细胞群,具备多向分化能力
。hSCAPs 较其他牙源性干细胞具备更强的自我更新和分化能力
,其增殖和分化可以促进牙根发育。hSCAPs 是干细胞治疗中潜在的细胞来源
。
两个相邻小镇一天死了4个人,人们议论纷纷。参与救援玛丽的消防员菲利普和朋友理查德在闲谈时,偶然提到玛丽死前吃过泰诺速效胶囊,理查德不经意地说:“也许亚当一家也是吃泰诺死的?”
光生物调节(photobiomodulation,PBM)是通过低能量激光或发光二极管(light-emitting diode,LED)照射来调节生物组织功能,可以有效减少炎症
、促进伤口愈合
、增强细胞活力
、促进细胞增殖和成骨分化能力
。LED 红光是指波长在620~720 nm 范围内的不相干光源,穿透力强,可以达到组织深层。LED 红光较激光具有仪器便于携带、经济、安全的特点
,能促进干细胞增殖和成骨分化
。LED红光对牙源性干细胞生物学特性的影响机制尚不明确。因此本实验选择hSCAPs 为研究对象,探讨LED 红光照射对其增殖和成骨分化的影响。
为便于比较,采用单项污染物指数法,按城镇污水处理厂污染物排放标准(GB18918—2002)中一级标准中A标准进行污染分析[9].计算公式为:
1 材料和方法
1.1 主要试剂与仪器
CCK-8 试剂盒(Dojindo,日本),低糖DMEM(Hyclone 公司,美国),青霉素-链霉素(Bioder 公司,中国),胎牛血清(四季青,中国),Dispase II 分散酶(Yeasen,美国),PBS磷酸盐缓冲液干粉、胰蛋白酶、地塞米松、β-甘油磷酸钠、维生素C、1% Triton-X100、茜素红染色液、氯化十六烷吡啶(Sloarbio 公司,中国),抗CD24、抗CD34、抗CD45、抗CD90、抗CD146(Ebioscience,美国),I 型胶原酶、多聚甲醛(Biosharp 公司,中国),碱性磷酸酶显色试剂(生工公司,中国),BCA蛋白浓度测定试剂盒(Beyotime公司,中国),碱性磷酸酶测定试剂盒(南京建成,中国),TRIpure Total RNA Extraction Reagent、EntiLink
1st Strand cDNA Synthesis Kit、EnTurbo
SYBR Green PCR SuperMix(ELK Biotechnology,中国)。
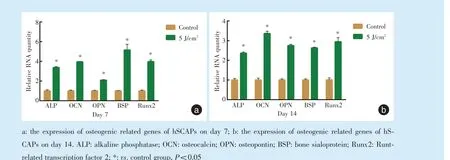
在光照后第7 天,5 J/cm
组较对照组上调hSCAPs 中成骨相关基因ALP(
=784.697,
<0.001),OCN(
=3 563.798,
<0.001),OPN(
=511.775,
<0.001),BSP(
=150.117,
<0.001)和Runx2(
=713.872,
<0.001)的表达,差异有统计学意义。光照后第14 天,5 J/cm
组上调hSCAPs 中成骨相关基因ALP(
=601.905,
<0.001)、OCN(
=779.152,
<0.001)、OPN(
=1120.033,
<0.001)、BSP(
=1736.171,
<0.001)和Runx2(
=206.170,
<0.001)的表达,差异有统计学意义,见图6。
分别统计两版教材“平方根”“无理数的引入”两块内容中的例习题数量,我们发现:美GMH版的例习题数量远多于浙教版,大约是浙教版的1.5倍.而且美GMH版在每一道例题后都会相应安排同一类型的习题,方便学生及时巩固.
1.2 hSCAPs 的分离培养和鉴定
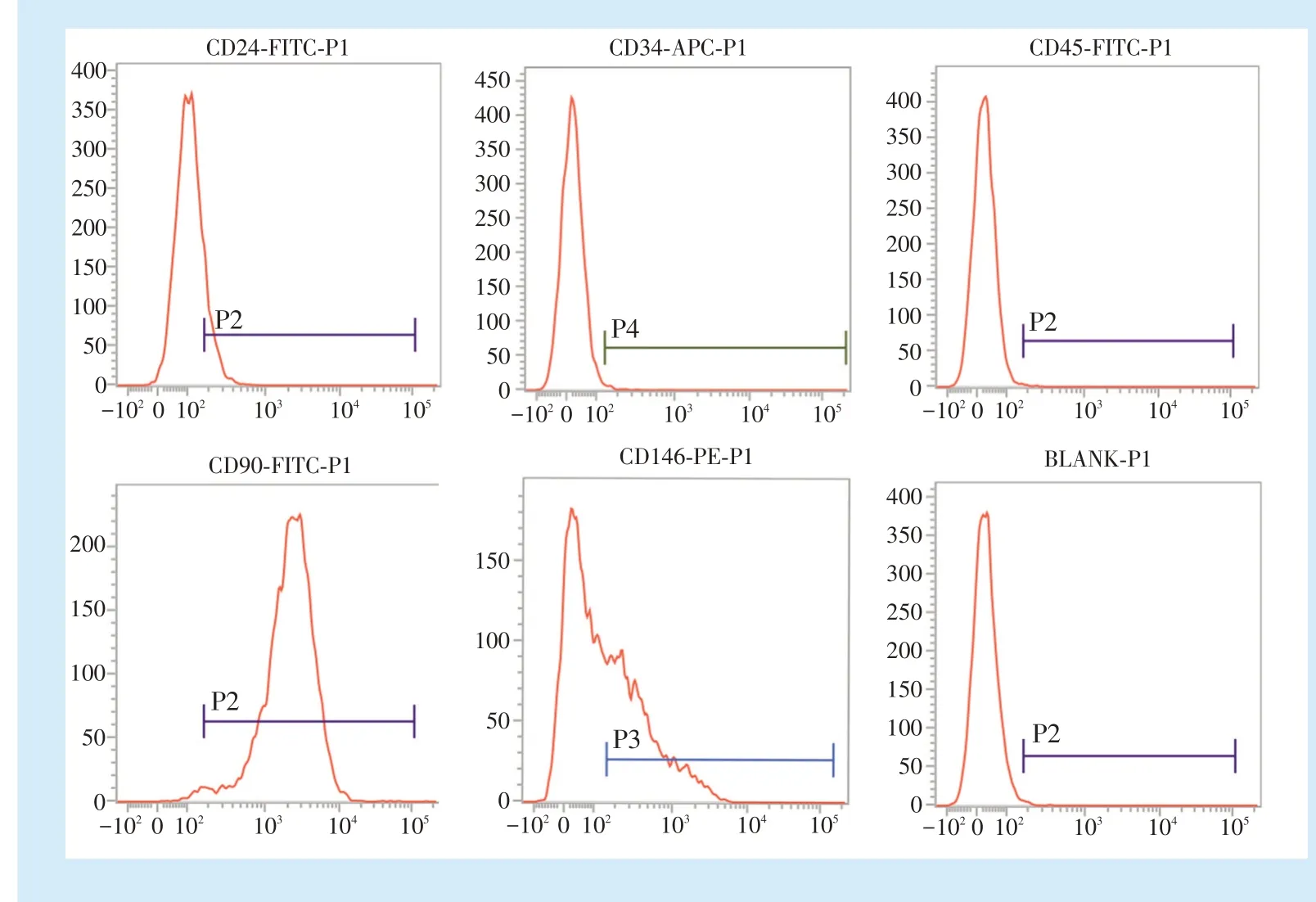
5 d 后可见细胞从组织块边缘爬出,贴壁生长,呈长梭形,见图1a。培养约20 d,可见细胞趋于融合,见图1b;成骨诱导3 周后,茜素红染色可见钙结节沉积,见图1c;成脂诱导3 周后,油红O 染色可见着色的脂滴,见图1d。流式细胞鉴定结果:第3 代hSCAPs 的干细胞表面标志物CD24、CD90、CD146 表达呈阳性,造血干细胞表面标志物CD34、CD45 呈阴性,表明获得的细胞属于间充质干细胞谱系,见图2。
1.3 实验分组及干预
根据CCK-8 检测的结果绘制每组hSCAPs 的生长曲线,见图3a。与对照组相比,在光照后第1、3、5、7 和9 天,实验组均显著促进hSCAPs 的增殖。光照后第1 天(1 J/cm
组
对照组,
=0.002;3 J/cm
组
对照组,
=0.001;5、7 J/cm
组
对照组,
<0.001)、第7 天(
=51.110,
<0.001)、第9 天(
=83.743,
<0.001),各光照组的细胞增殖能力均强于对照组。光照后第3 天,3、5、7 J/cm
组的细胞增殖率明显高于对照组(
=106.942,
<0.001)。光照后第5 天,仅5 J/cm
组显示出更强的细胞增殖能力(
=18.199,
<0.001)。此外,在各检测时间点的光照组之间,hSCAPs 的细胞增殖率也有差异,见图3b。
1.4 CCK-8 检测LED 红光对hSCAPs 增殖的影响
取第4 代hSCAPs 接种于96 孔板,密度为2 ×10
/孔,每组设置5 个副孔,加入含10%FBS 的低糖DMEM 培养基、37 ℃、5%CO
条件下孵育。次日换液后分组进行光照。分别在光照后的第1、3、5、7、9天进行CCK-8 检测。去原培养液,加入CCK-8 混合液,孵育1 h,酶标仪(450 nm)检测吸光度值。根据用每个时间点的平均吸光度绘制细胞生长曲线。
1.5 ALP 染色和ALP 定量检测hSCAPs 成骨分化
取第4 代hSCAPs 接种于3.5 cm 细胞培养皿中,加入含10% FBS 的低糖DMEM 培养基、37 ℃、5% CO
孵育,2 d 后更换为成骨诱导培养基。分组进行光照。培养至第7、14 天时,去上清液,PBS 清洗3 遍,多聚甲醛固定30 min。PBS 清洗2 遍,根据ALP 显色试剂说明书配置染液,染色15 min。在倒置显微镜下观察细胞。
hSCAPs 经成骨诱导培养至第7、14 天时,胰蛋白酶消化,1% TritonX-100 裂解细胞40 min。使用BCA 蛋白浓度测定试剂盒测定裂解物中总蛋白质浓度、ALP 测定试剂盒测定样本细胞内ALP 活性,计算ALP 相对活性。
1.6 茜素红定量检测hSCAPs 成骨矿化
hSCAPs 经成骨诱导培养至第21 天时,去除上清液,PBS 清洗3 遍,多聚甲醛固定30 min。PBS 清洗2 遍,1%茜素红染色5 min。超纯水清洗2 遍,加入氯化十六烷基吡啶溶液,室温避光静置30 min。将溶解后的上清液分别置于96 孔板中,每组设置5 个副孔,酶标仪(562 nm)检测吸光度值。
1.7 RT-PCR 检测hSCAPs 中成骨相关基因的表达
选择5 J/cm
LED 红光照射条件作为RT-PCR的实验组。hSCAPs 经成骨诱导培养至第7、14 天时,使用TRIpure Total RNA Extraction Reagent 试剂盒进行总RNA 提取。使用EntiLink
1st Strand cDNA Synthesis Kit 试剂盒进行第一链cDNA 的合成。以GAPDH 为内参照,使用EnTurbo
SYBR Green PCR SuperMix 试剂盒进行实时聚合酶链反应(RTPCR)分析各组细胞中成骨相关基因碱性磷酸酶(alkaline phosphatase,ALP)、骨钙素(osteocalcin,OCN)、骨桥蛋白(osteopontin,OPN)、骨唾液酸蛋白(bone sialoprotein,BSP)和Runt 相关转录因子2(Runt-related transcription factor 2,Runx2)的表达水平,每个样品均设置3 个复孔。目的基因的相对表达量通过2
方法计算得出。相关基因的引物序列见表1。

1.8 Western blot 检测hSCAPs 中成骨相关蛋白的表达
3、注意:家长一定要在旁边观察宝宝的反应,并且多用言语鼓励宝宝看镜子和拿玩具,还可以利用镜子的反射和宝宝做鬼脸、对话。建议大家从宝宝2个月左右大的时候开始做这个亲子游戏,每周安排至少2次这样的训练。玩具最好能经常换一换,增加宝宝的新鲜感。
1.9 统计学分析
采用SPSS 17.0 进行统计学分析。结果进行方差齐性检验,Shapiro-Wilk 法进行正态性检验,采用重复测量数据的方差分析进行多组间的比较,LSD法进行不同组间样本均数的两两比较。计量资料以均数±标准差表示,
<0.05 为差异有统计学意义。
④明确规定供水企业、用水户、管水部门的权利、义务以及相关法律责任,使供、用、管水三方能够从各自角度出发自觉执行计划用水管理办法。
2 结 果
2.1 hSCAPs 的分离培养和鉴定
本实验已取得西南医科大学附属口腔医院伦理委员会批准(批号:20180314001)。根尖乳头组织来源于西南医科大学附属口腔医院颌面外科。患者因正畸需拔除的阻生第三磨牙,获得患者及家属知情同意后立即放入PBS 中备用。待生物安全柜消毒完毕后,用含有20%、3%青霉素-链霉素双抗的PBS 反复冲洗净组织表面残留物,将组织剪碎,加入Ⅰ型胶原酶(3 g/L)和Dispase 酶(4 g/L),待组织块消化至絮状后加入等量完全培养基中止反应,将组织块接种于培养瓶中,加入含10% FBS的低糖DMEM 培养基,于37 ℃、5% CO
条件下培养,每隔3 d 换液,细胞长满瓶底后传代。取第3 代SCAPs,经成骨诱导及成脂诱导培养3 周后,去除上清液,PBS 清洗3 遍,多聚甲醛固定30 min。PBS清洗2 遍,进行茜素红染色及油红O 染色。取第3代SCAPs,PBS 重悬,分别加入抗人CD24、CD34、CD45、CD90、CD146 抗体,室温避光孵育30 min,流式细胞仪检测细胞表面标志物。

2.2 CCK-8 检测LED 红光对SCAPs 增殖的影响
本研究采用的LED 红光光源功率输出稳定、连续,波长在600~700 nm 之间。光源与细胞之间的距离为2 cm。在这些条件下,测得光源的功率密度约为66.7 mW/cm
。根据公式:辐射曝光量(radiant exposure,J/cm
)=功率密度(power density,W/cm
)×时间(irradiation time,s)计算可得,LED 红光照射15、45、75、105 s 时,辐射曝光量分别为1、3、5、7 J/cm
。将细胞分为0 J/cm
组(对照组),1 J/cm
组,3 J/cm
组、5 J/cm
组和7 J/cm
组,每48 h 对细胞进行一次照射。所有细胞均在暗室中进行照射,照射的第一天设为光照后第0 天。

2.3 ALP 染色和ALP 定量检测LED 红光对hSCAPs成骨分化的影响
LED 红光照射后第7 天和第14 天,ALP 染色结果显示光照组较对照组着色较明显,且5 J/cm
组着色最深;同时,光照后第14 天各组较第7 天染色深,见图4a。ALP 活性检测结果显示在光照后第7天和第14 天,光照组ALP 活性高于对照组;光照后第7 天,3、5 和7 J/cm
组促进hSCAPs 的ALP 活性(
=9.380,3 J/cm
组
对照组,
=0.006;5 J/cm
组
对照组,
<0.001;7 J/cm
组
对照组,
=0.008);在各光照组之间,5 J/cm
组ALP 活性最高(5 J/cm
组
1 J/cm
组,
=0.002;5 J/cm
组
3 J/cm
组,
=0.043;5 J/cm
组
7 J/cm
组,
=0.032);光照后第14 天,仅3 J/cm
和5 J/cm
组促进hSCAPs 的ALP 活性(
=36.867,3 J/cm
组
对照组,
=0.035;5 J/cm
组
对照组,
<0.001),5 J/cm
组较其他光照组显著提高ALP 活性(
<0.001);同时,光照后第14 天各组都显示出比第7天更高的ALP 水平,见图4b。
成骨诱导培养至第7、14 天时,收集对照组和5 J/cm
组细胞,使用RIPA 总蛋白裂解液提取细胞总蛋白,BCA 蛋白质浓度测定试剂盒测定裂解物中总蛋白质浓度,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜后,加入封闭液室温封闭1 h,孵育一抗,二抗,增强化学发光(enhanced chemiluminescence,ECL)方法进行显影。

2.4 茜素红定量检测LED 红光对hSCAPs 矿化的影响
Western blot 结果显示,5 J/cm
组在第7 天ALP(
=172.997,
<0.001)、OCN(
=465.951,
<0.001)、OPN(
=207.232,
<0.001)、BSP(
=209.934,
<0.001)和 Runx2(
=585.258,
<0.001)蛋白的表达上调,差异具有统计学意义。5 J/cm
组在第14 天上调ALP(
=110.244,
<0.001)、OCN(
=182.052,
<0.001)、OPN(
=38.148,
=0.003)、BSP(
=65.461,
=0.001)和Runx2(
=79.046,
=0.001)蛋白的表达,差异具有统计学意义,见图7。

2.5 RT-PCR 检测LED 红光对hSCAPs 成骨相关基因表达水平的影响
生物安全柜(BSC-1000ⅡA2,苏州净化设备厂,中国),低速离心机(KDC-1044,中佳,中国),CO
孵箱(CCL-170B-8,Esco Micro Pte. Ltd.,新加坡),流式细胞仪(FACSAria,BD,美国),倒置相差荧光显微镜(IX2-ILL100,Olympus,日本),LED 红光灯(T6,芮森,中国),高精度光功率计(Field-MaxII-TO,Coherent,美国),酶标仪(Synergy
HTX,BioTek,美国),PCR 仪(Veriti 96-Well Thermal Cycler,Thermofisher,新加坡),荧光定量PCR 仪(CFX Connect
,Bio-Rad,美国),蛋白转膜系统(DYY-6C,北京市六一仪器厂,中国)。
2.6 Western blot 检测LED 红光对hSCAPs 成骨相关蛋白表达水平的影响
茜素红染色结果见图5a。茜素红定量检测结果(
=8.763)为仅5 J/cm
组促进hSCAPs 的矿化(
<0.001),且5 J/cm
组的矿化结节表达量高于1 J/cm
、3 J/cm
和7 J/cm
组(5 J/cm
组
1 J/cm
组,
=0.002;5 J/cm
组
3 J/cm
组、
=0.004;5 J/cm
组
7 J/cm
组,
=0.001)。用1、3、5和7 J/cm
LED红光照射后,各光照组矿化结节表达量分别相当于对照组的104%、105%、118%和102%,见图5b。

3 讨 论
间充质干细胞因其强大的自我更新和分化能力,成为再生疗法中日益重要的细胞来源
。hSCAPs 具有类似于神经嵴细胞的增殖和分化特征,免疫原性低,有助于组织再生和修复
。年轻恒牙疾病在保守治疗后可能出现牙髓坏死和根尖周病变,但其牙根仍能继续发育,表明hSCAPs 可能在牙髓坏死过程中存活,促进牙根的继续发育
。一定条件下hSCAPs 可以分化形成牙髓-牙本质复合体
、牙周组织
和骨组织
。因此,hSCAPs不仅具有发育成生物根的潜力,促进牙根继续发育,在牙周软硬组织再生中也能发挥作用,可以应用于组织工程和干细胞治疗研究。
近五年,所读之书多与小学语文和教育关联不大,是跳出语文、跳出教育的阅读。在这些阅读中,中国文化让我感到特别亲切,因为它比较贴近我们的生活,尤其是巴蜀文化及巴蜀名士的书籍,司马相如、扬雄、三苏、魏了翁、刘沅、唐甄、贺麟等,更让我着迷。为了让学生们了解并热爱地方文化,我们结合小学语文教学研究的情况,在“儿童视野下的小学语文教学研究”的基础上,提出了小学“三味”语文教学的主张,即小学语文教学要具有儿童味、语文味和地方味,并在一些学校开展了一系列探索和实践,取得了比较好的效果。
LED 红光已被证明具有多种生物调节作用,如减轻炎症和促进伤口愈合
,具有价格低廉、使用寿命长、电路实现简单、应用安全等优点,仪器便于携带,可以作为在家中进行光动力治疗的工具
,可以通过多种方式影响不同干细胞的增殖和成骨分化
。现阶段LED 红光对牙源性干细胞增殖和成骨分化的影响逐渐引起关注,但其对hSCAPs 生物学特性的影响研究较少。Horvát-Karajz等
发现细胞经光照后的光生物学效应可以持续48 h。Marques 等
发现1.2~7.5 J/cm
的红光能对干细胞的细胞存活率和增殖产生积极效应。同时本课题组前期实验发现1、3、5 J/cm
的LED 红光对牙源性间充质干细胞有积极作用
。故本实验选择1、3、5、7 J/cm
LED 红光,每48 h 对细胞进行一次照射,探讨LED 红光对hSCAPs 增殖及成骨分化的影响,以期为光生物疗法在牙组织工程中的应用筛选适宜的光学参数,为hSCAPs 作为牙再生种子细胞提供实验数据。
Hamblin 等
认为光生物调节作用存在双相剂量反应,即低剂量光照具有促进作用,高剂量光照产生抑制作用,可能是细胞色素C 氧化酶光受体吸收LED 红光后被激活,提供更高速率的氢质子泵入线粒体,产生能量,并催化产生活性氧(reactive oxygen species,ROS)促进细胞增殖。Ferreira 等
报道5 J/cm
红光促进牙髓干细胞增殖,Marques等
发现5 J/cm
红光照射乳牙牙髓干细胞的存活率和增殖率较高,Yamauchi 等
发现8 J/cm
对PDLSCs 增殖促进效果最显著。本实验中,增殖实验结果也显示LED 红光在hSCAPs 增殖早中晚期均有不同程度的促进作用,5 J/cm
红光照射对hSCAPs 的促进作用最显著,提示LED 红光照射对不同干细胞产生的光生物学效应有微小差异。
本实验发现在成骨诱导条件下,LED 红光促进hSCAPs 的成骨分化及钙结节的形成,其中5 J/cm
组在第7、14 和21 天均有良好的促进作用,表明5 J/cm
LED 红光可以在hSCAPs 早中晚期成骨中均发挥有利作用。根据以上结果,笔者选择5 J/cm
组与对照组进行PCR 和western blot 实验探讨相关机制。ALP 和Runx2 是成骨分化早期的标志
,OCN 在成骨细胞分化晚期表达
。OPN 的表达与骨形成/吸收相关,是成骨分化中晚期的标志
。BSP 在骨形成开始时、成骨分化后期和矿化早期表达
。结果显示5 J/cm
LED 红光能上调ALP、Runx2、OCN、OPN、BSP 基因和蛋白的表达,进一步提示LED 红光促进SCAPs 成骨分化。Li 等
报道LED 红光促进大鼠骨髓间充质干细胞成骨分化,Ruan 等
发现LED 红光具有促进人骨髓间充质干细胞成骨分化的作用,与本研究结果一致。但Pagin 等
提出LED 红光不影响前成骨细胞MC3T3细胞的分化,这可能与LED 红光照射曝光量等光学参数不一致有关,也可能与LED 红光选择性促进干细胞成骨分化有关。
综上所述,本实验探讨LED 红光对hSCAPs 增殖和成骨分化的量效关系,发现在模拟成骨诱导环境中,LED 红光促进hSCAPs 体外增殖和成骨分化,其中5 J/cm
的光照效果最显著,为促进hSCAPs和光生物调节疗法在组织工程和干细胞治疗中的应用提供了新的研究基础。
ACEO有机硅3D打印是全球首创的基于有机硅弹性体的3D打印技术,采用DOD技术按需滴胶,可用于生产各种几何图形复杂的部件配件以及此前无法生产的“不可能的产品”。有机硅具有耐热性、低温柔韧性、透明性和生物相容性等独一无二的性能,因此这种技术在汽车制造、航空航天、医疗保健以及机械工程等众多行业拥有巨大的应用前景,适用于设计建模、配件生产以及小批量生产。ACEO提供一系列服务,包括设计支持、打印实验室的培训课程,以及便于文件上传和下单的网上商店。
Su YT performed the experiments and wrote the article. Hou L, Jiang B, Zheng GZ, Liu Y and Wang Y performed the experiments and revised the article. All authors read and approved the final manuscript as submitted.
[1]Gan L, Liu Y, Cui D, et al. Dental tissue-derived human mesenchymal stem cells and their potential in therapeutic application[J].Stem Cells Int,2020:8864572.doi:10.1155/2020/8864572.
[2]Sonoyama W,Liu Y,Fang D,et al.Mesenchymal stem cell-mediated functional tooth regeneration in swine[J].PLoS One, 2006,1(1):e79.doi:10.1371/journal.pone.0000079.
[3]叶青松, 王晓燕. 牙源性干细胞储存和临床应用的研究进展[J].口腔疾病防治,2018,26(1):15-25.doi:10.12016/j.issn.2096-1456.2018.01.004.Ye QS, Wang XY. Progress in storage and clinical application of dental stem cells[J].J Prev Treat Stomatol Dis, 2018,26(1):15-25.doi:10.12016/j.issn.2096-1456.2018.01.004.
[4]Saberi E,Farhad-Mollashahi N,Sargolzaei AF,et al.Proliferation,odontogenic/osteogenic differentiation, and cytokine production by human stem cells of the apical papilla induced by biomaterials: a comparative study[J]. Clin Cosmet Investig Dent, 2019, 11: 181-193.doi:10.2147/CCIDE.S211893.
[5]Kang J,Fan W,Deng Q,et al.Stem cells from the apical papilla:a promising source for stem cell-based therapy[J]. Biomed Res Int,2019:6104738.doi:10.1155/2019/6104738.
[6]Hamblin MR. Mechanisms and applications of the anti-inflammatory effects of photobiomodulation[J]. AIMS Biophys, 2017, 4(3):337-361.doi:10.3934/biophy.2017.3.337.
[7]Ghaemi M, Sharifi D, Mokmeli S, et al. Comparison and evaluation of the low-level laser and the red and blue LED effects on wound healing in rabbit[J]. J Lasers Med Sci, 2019, 10(3): 189-193.doi:10.15171/jlms.2019.30.
[8]Pasternak-Mnich K, Ziemba B, Szwed A, et al. Effect of photobiomodulation therapy on the increase of viability and proliferation of human mesenchymal stem cells[J]. Lasers Surg Med, 2019, 51(9):824-833.doi:10.1002/lsm.23107.
[9]Ferreira LS, Diniz I, Maranduba C, et al. Short-term evaluation of photobiomodulation therapy on the proliferation and undifferentiated status of dental pulp stem cells[J].Lasers Med Sci, 2019,34(4):659-666.doi:10.1007/s10103-018-2637-z.
[10] Wu Y,Zhu T,Yang Y,et al.Irradiation with red light-emitting diode enhances proliferation and osteogenic differentiation of periodontal ligament stem cells[J].Lasers Med Sci, 2021,36(7):1535-1543.doi:10.1007/s10103-021-03278-1.
[11] Dzobo K. Recent trends in multipotent human mesenchymal stem/stromal cells:learning from history and advancing clinical applications[J]. OMICS, 2021, 25(6): 342-357. doi: 10.1089/omi.2021.0049.
[12] Li G, Han N, Zhang X, et al. Local injection of allogeneic stem cells from apical papilla enhanced periodontal tissue regeneration in minipig model of periodontitis[J]. Biomed Res Int, 2018:3960798.doi:10.1155/2018/3960798.
[13] Edanami N, Yoshiba K, Shirakashi M, et al. Impact of remnant healthy pulp and apical tissue on outcomes after simulated regenerative endodontic procedure in rat molars[J]. Sci Rep, 2020, 10(1):20967.doi:10.1038/s41598-020-78022-w.
[14] Zhuang X, Ji L, Jiang H, et al. Exosomes derived from stem cells from the apical papilla promote dentine-pulp complex regeneration by inducing specific dentinogenesis[J]. Stem Cells Int, 2020:5816723.doi:10.1155/2020/5816723.
[15] Li G, Han N, Yang H, et al. SFRP2 promotes stem cells from apical papilla-mediated periodontal tissue regeneration in miniature pig[J]. J Oral Rehabil, 2020, 47(Suppl 1): 12-18. doi: 10.1111/joor.12882.
[16] Son YB, Kang YH, Lee HJ, et al. Evaluation of odonto/osteogenic differentiation potential from different regions derived dental tissue stem cells and effect of 17β-estradiol on efficiency[J]. BMC Oral Health,2021,21(1):15.doi:10.1186/s12903-020-01366-2.
[17] Pigatto GR, Silva CS, Parizotto NA. Photobiomodulation therapy reduces acute pain and inflammation in mice[J].J Photochem Photobiol B, 2019, 196: 111513. doi: 10.1016/j.jphotobiol.2019.111513.
[18] Ruan Y, Kato H, Taguchi Y, et al. Irradiation by high-intensity red light-emitting diode enhances human bone marrow mesenchymal stem cells osteogenic differentiation and mineralization through Wnt/β - catenin signaling pathway[J]. Lasers Med Sci,2021,36(1):55-65.doi:10.1007/s10103-020-03002-5.
[19] Chaweewannakorn C, Santiwong P, Surarit R, et al. The effect of LED photobiomodulation on the proliferation and osteoblastic differentiation of periodontal ligament stem cells:
[J]. J World Fed Orthod,2021,10(2):79-85.doi:10.1016/j.ejwf.2021.03.003.
[20] Horvát-Karajz K, Balogh Z, Kovács V, et al.
effect of carboplatin,cytarabine,paclitaxel,vincristine,and low-power laser irradiation on murine mesenchymal stem cells[J]. Lasers Surg Med,2009,41(6):463-469.doi:10.1002/lsm.20791.
[21] Marques NP, Lopes CS, Marques N, et al. A preliminary comparison between the effects of red and infrared laser irradiation on viability and proliferation of SHED[J]. Lasers Med Sci, 2019, 34(3):465-471.doi:10.1007/s10103-018-2615-5.
[22] Yamauchi N,Taguchi Y,Kato H,et al.High-power,red-light-emitting diode irradiation enhances proliferation, osteogenic differentiation,and mineralization of human periodontal ligament stem cells via ERK signaling pathway[J]. J Periodontol, 2018, 89(3): 351-360.doi:10.1002/JPER.17-0365.
[23] Vimalraj S. Alkaline phosphatase: structure, expression and its function in bone mineralization[J]. Gene, 2020, 754: 144855. doi:10.1016/j.gene.2020.144855.
[24] Komori T.Regulation of proliferation,differentiation and functions of osteoblasts by Runx2[J]. Int J Mol Sci, 2019, 20(7): 1694. doi:10.3390/ijms20071694.
[25] Komori T. Functions of osteocalcin in bone, pancreas, testis, and muscle[J]. Int J Mol Sci, 2020, 21(20): 7513. doi: 10.3390/ijms21207513.
[26] Si J,Wang C,Zhang D,et al.Osteopontin in bone metabolism and bone diseases[J]. Med Sci Monit, 2020, 26: e919159. doi:10.12659/MSM.919159.
[27] Ding SJ,Shie MY,Hoshiba T,et al.Osteogenic differentiation and immune response of human bone-marrow-derived mesenchymal stem cells on injectable calcium-silicate-based bone grafts[J].Tissue Eng Part A, 2010, 16(7): 2343 - 2354. doi: 10.1089/ten.TEA.2009.0749.
[28] Li WT,Yc L,Wu JL.Red-light light-emitting diode irradiation increases the proliferation and osteogenic differentiation of rat bone marrow mesenchymal stem cells[J]. Photomed Laser Surg, 2010,28(Suppl 1):S157-S165.doi:10.1089/pho.2009.2540.
[29] Pagin MT, De Oliveira FA, Oliveira RC, et al. Laser and lightemitting diode effects on pre-osteoblast growth and differentiation[J].Lasers Med Sci,2014,29(1):55-59.doi:10.1007/s10103-012-1238-5.
