边缘革蜱Dm 86基因表达及免疫原性分析
2022-02-21李敏马英呼尔查何文文史倩云阿力木江加帕尔蒋倩巴音查汗
李敏,马英,呼尔查,何文文,史倩云,阿力木江·加帕尔,蒋倩,巴音查汗
(新疆农业大学动物医学学院,乌鲁木齐 830052)
0 引言
【研究意义】边缘革蜱(Dermacenter marginatus,D.marginatus)为三宿主蜱[1]。我国主要分布于新疆,是携带多种病原的地方优势种媒介蜱,可携带并传播巴贝斯虫、泰勒虫、立克次体、布鲁氏菌、和莱姆等多种蜱传病原体[2]。近年来,我国新疆昭苏、和硕、博乐、哈巴河等边缘革蜱孳生数量逐渐增加[3]。降低蜱及蜱传疾病风险的主要方法有化学杀螨剂的应用[4]。疫苗接种可使宿主增强免疫力,针对性消灭不同蜱种,污染率低。挖掘抗蜱疫苗候选基因及其保护性抗原分子的研究极其重要,是一个有效防蜱控蜱的研究方向,具有良好的应用前景。【前人研究进展】Boophilus microplus86(Bm86)抗原是被证明免疫后有效的商品化疫苗。Willadsen等[5-6]从半饱血微小牛蜱雌蜱肠道中分离出一种膜结合糖蛋白,用微克级的抗原免疫牛所产生的抗体即对牛有抗蜱保护作用,当微小牛蜱吸食了用Bm86抗原免疫的牛的血液时,血液中的抗体即与蜱肠道表面的相应糖蛋白结合,使蜱肠道受到严重损伤,当牛血液渗入蜱的血淋巴后,能更进一步引起蜱的大规模死亡及繁殖和生存能力的下降等,并已证明Bm86为一种“隐藏抗原”。国外针对其优势蜱微小牛蜱的Bm86的基因工程疫苗已在多国注册并进行田间试验中,控蜱效果在50%~100%[7],降低了蜱传疾病的发病率。【本研究切入点】在Bm86其它同系物研究中,璃眼蜱的Hd86抗原可能在若蜱蜕皮为成蜱阶段起作用,长角血蜱HI86蛋白的宿主动物能可有效降低饱血雌蜱的体重,在篦子硬蜱Ir86抗原的免疫实验中,并未观察到显著吸血和产卵阶段变化[8-10]。关于新疆优势硬蜱的保护性抗原的研究未见报道。边缘革蜱Dm86能否作为保护性抗原发挥作用还需要相关的研究。【拟解决的关键问题】拟克隆Dm86基因CDs区核酸片段,经采用生物学分析,筛选亲水性较高、抗原性强和抗原表位连续的核酸片段,构建重组质粒,表达蛋白后制备其多克隆抗体验证其免疫原性,分析蜱虫不同发育阶段的Dm86基因相对表达量,为抗边缘革蜱疫苗保护性抗原的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品及试验动物
所用边缘革蜱F3代由新疆农业大学寄生虫实验室饲养,供血动物为3月龄新西兰大白兔1只,体重2.1 kg,购自新疆医科大学实验动物中心。
1.1.2 质粒、菌种及试剂
所使用的主要试剂材料中pMD19-T载体、T4连接酶、BL21感受态细胞、Blue Plus Protein Marker、DNA Marker购自北京全式金生物技术有限公司;RNAisoPlus、大肠杆菌DH5a感受态细胞、Fast-King cDNA第一链合成试剂盒、2×TaqPCR Mix、普通DNA产物纯化回收试剂盒、质粒小提试剂盒购自新疆宝信源柏生物技术有限公司;谷胱甘肽琼脂糖树脂纯化试剂盒购自上海翊圣生物科技有限公司;pGEX-4T-1为质粒由实验室保存。
1.2 引物设计与合成
1.2.1 引物设计与合成
参考实验室所有的边缘革蜱转录组数据,参照GenBank中变异革蜱Dr86的序列(GB144601.1),使用Primer Premier 5.0软件分别设计特异性引物。表1

表1 Dm86基因PCR引物Table 1 Dm86 gene PCR primer
1.2.2 边缘革蜱不同发育阶段虫体收集
以实验室的F3代边缘革蜱为材料,通过耳袋法将40只(雌雄各20只)接种于新西兰大白兔的耳朵,每天打开耳套,观察吸血情况。饱血雌蜱落体后,放置于培养皿中,温度控制在25℃,湿度控制在85%待其产卵。卵蜕皮成为幼蜱后,接种兔耳朵继续吸血。待幼蜱吸饱血后,蜕皮成为若蜱,接种于兔耳朵继续吸血。待若蜱吸饱血后蜕皮后,即为成蜱。在开始吸血后第24、48、72和96 h、半饱血和饱血期和生活史的每个阶段收集小部分虫体于1.5 mL EP管。
1.2.3 边缘革蜱总RNA的提取及第一链
cDNA合成以F4代边缘革蜱各发育(卵、饥饿幼蜱、饱血幼蜱、饥饿若蜱、饱血若蜱、成蜱)及吸血(第24、48、72和96 h、半饱血、饱血)阶段虫体为组织材料,液氮研磨后Trizol法提取总RNA,按照FastKing cDNA第一链合成试剂盒说明书将总RNA反转录成cDNA。
1.2.4 Dm86基因片段的克隆
以边缘革蜱饱血雌蜱cDNA为模板,反应体系(50µL):2×TaqPCR Mix 25µL,Dm86-out-F/Dm86-out-R各2µL,cDNA模板2µL,ddH2O补足至50µL,反应条件:95℃,预变性5 min;95℃,变性30 s;64℃,退火30 s;72℃,延伸2min,共35个循环;72℃,延伸10min。扩增产物用1%琼脂糖凝胶电泳检测,目的基因使用DNA产物回收试剂盒回收,纯化后的目的片段与载体质粒pMD19-T连接,转化至DH5a感受态细胞中,扎取菌落扩大培养后进行菌液PCR验证,并将有目的条带的菌液送往上海生工生物工程有限公司测序。
1.2.5 Dm86基因生物学
在线软件ExPASy-ProtParam(https://web.ex-pasy.org/compute_pi/)分析目的蛋白理化性质;经ProtScale(http://web.web.expasy.org/protscale)在线分析目的蛋白的亲(疏)水性;经SignalP 3.0(http://www.cbs.dtu.dk/services/SignalP-3.0/)在线分析目的蛋白信号肽;经TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)在线分析目的蛋白有无跨膜结构;NetNGlyc 1.0 Server(http://www.cbs.dtu.dk/cgi-bin/webface2.)N端糖基化位点分析。经IEDB(http://tools.iedb.org/bcell/)在线预测B细胞抗原表位。NPS@(https://npsa-prabi.ibcp.fr/cgi-bin/npsa)在线蛋白分析系统对目的蛋白预测二级结构,经Phyer2和EzMol2.1在线预测目的蛋白的三级结构。
1.2.6 实时荧光定量
PCR反应以不同发育、吸血阶段的边缘革蜱cDNA为模板,延伸因子1α基因(Elongation factor 1-alpha)为内参[11],Dm86-q-F/Dm86-q-R为引物,根据QuantiNova SYBR®Green PCR试剂盒说明书,应用生物系统7 500快速实时™系统(美国应用生物系统),反应条件为95℃,2 min;95℃,15s、60℃,35 s,共40个循环。检测Dm86在边缘革蜱的相对表达量。
1.2.7 截短目的基因克隆
以边缘革蜱饱血雌蜱cDNA为模板,反应体系(50µL):2×TaqPCR Mix 25µL,Dm86-ep-F/Dm86-ep-R各2µL,cDNA模板2µL,ddH2O补足至50µL,反应条件:95℃,5 min;95℃,30 s、64℃,30 s、72℃,30 s共35个循环;72℃,8 min。扩增产物用1%琼脂糖凝胶电泳检测,目的基因使用DNA产物回收试剂盒进行回收。纯化后的目的片段与载体质粒pMD19-T连接,转化至大肠杆菌DH5ɑ感受态细胞中,扎取菌落扩大培养后验证菌液PCR,并将有目的条带菌液送往上海生工生物工程有限公司测序。
1.2.8 重组质粒的构建
将重组克隆质粒pMD19-T-Dm86和表达载体pGEX-4T-1使用XhoI和EcoRI双酶切,回收目的片段。通过T4DNA连接酶与载体质粒pGEX-4T-1连接,构建重组质粒Dm86-pGEX-4T-1并转化至大肠杆菌BL21感受态细胞中,扎取菌落扩大培养后,提取质粒进行PCR和双酶切验证,将菌液送往上海生工生物工程有限公司测序验证。
1.2.9 重组质粒Dm86-pGEX-4T-1诱导表达和纯化
将Dm86-pGEX-4T-1菌液按1:100比例加入100 mL含有Amp+的LB液体培养基中,180 r/min,37℃,培养3 h,OD600达到0.6时,加入1 mmol/L IPTG进行诱导表达后,离心取上清和沉淀进行可溶性分析。按照说明书使用树脂纯化试剂盒纯化Dm86融合蛋白,并通过SDS-PAGE鉴定。
1.2.10 制备多克隆抗体及Western blot分析
以纯化的融合蛋白免疫新西兰大白兔,获得该融合蛋白的多克隆抗体,并检测其抗体效价。以获得的多克隆抗体作为一抗,用5%脱脂奶粉1∶100稀释,孵育。羊抗兔IgG为二抗,用5%脱脂奶粉1∶10000稀释,对重组蛋白进行Western blot分析。
1.3 数据处理
使用MEGA 6.0软件,选择T92+G+I模型,以软蜱(Ornithodoros savignyi)为外类群,对Dm86基因构建ML(最大似然法)系统发育树。SignalP 3.0在线分析,经NPS@在线蛋白分析系统(MLRC方法)对目的蛋白进行二级结构预测,在线预测经IEDB在线分析,单因素方差分析吸血期,收集蛋白并使用One Drop®OD-1000紫外-可见光全光谱分光光度计检测,经SDS-PAGE验证。
2 结果与分析
2.1 边缘革蜱Dm86基因扩增PCR
研究表明,长片段的Dm86序列在1 773 bp出现明显的扩增带,与预期大小一致。图1

图1 边缘革蜱Dm86基因PCR扩增Fig.1 Result of PCR amplification of Dm86 gene of D.marginatus
2.2 边缘革蜱Dm86基因进化
研究表明,克隆菌液测序所得序列,与NCBI所公布的网文革蜱Dermacentor reticulatus86(Dr86)的相似度为89.29%。边缘革蜱Dm86基因序列与Dr86基因聚为一支。图2

图2 边缘革蜱Dm86基因的系统发育Fig.2 Phylogenetic analysis of Dm86 gene of D.marginatus
2.3 生物信息学(图3)
2.3.1 目的蛋白理化性质
研究表明,Dm86蛋白有591个氨基酸组成,分子量为64 857.81,理论等电点为6.78,酸性。在体外哺乳动物网状细胞的半衰期为1.9 h,在酵母菌体内为20 h,在大肠杆菌体内为10 h。不稳定指数为51.77,是不稳定蛋白。脂肪系数为57.60。
2.3.2 亲水性、信号肽、跨膜结构和N端糖基化位点
研究表明,目的蛋白大部分属于亲水性氨基酸,总平均亲水性系数为-0.502<2,是亲水性蛋白。存在信号肽。NetNGlyc 1.0 Server有5个N端糖基化位点。
2.3.3 二级结构、B细胞抗原表位和三级结构
研究表明,从高到低依次是无规则卷曲(65.48%)、延伸链(24.03%)和α螺旋(10.49%)。抗原性最强且抗原位点最多的区域在522~564。Phyre2 Job Status蛋白质三级结构,红色部分抗原性最强且抗原表位连续的43个氨基酸。
2.4 边缘革蜱生活史各阶段Dm86基因荧光定量PCR检测
研究表明,Dm86基因在边缘革蜱不同阶段均有表达。幼蜱阶段的相对表达量较高,但无显著差异;若蜱阶段的相对表达量低,有显著差异;成蜱阶段的相对表达量较低,有显著差异。以饥饿雌蜱为基准,饥饿雌蜱较缓慢吸血期和半饱血期的基因相对表达量高,但无显著差异,较饱血阶段的基因相对表达量低,存在显著差异。图4,图5

图4 各发育周期相对表达量Fig.4 Relative expression levels of each developmental period
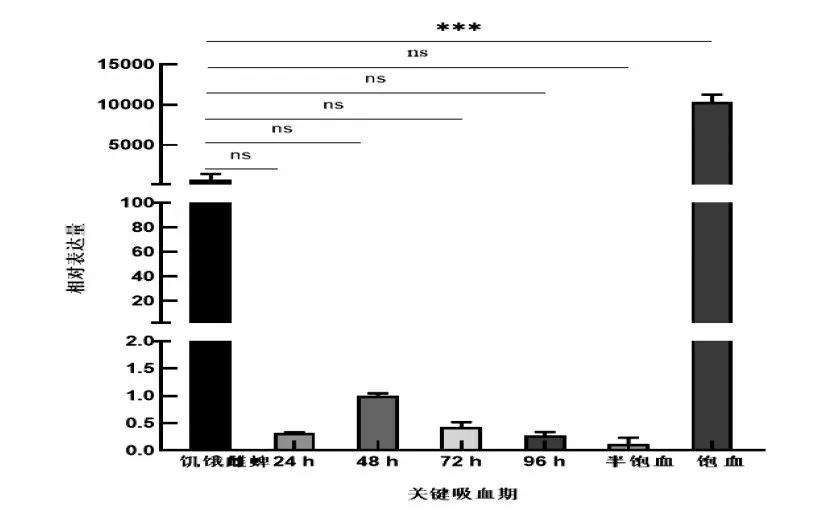
图5 吸血期相对表达量Fig.5 Relative expression level in the bloodsucking stage
2.5 Dm86截短基因的扩增
研究表明,在345 bp出现表达性截短片段。图6

图6 边缘革蜱截短Dm86基因PCR扩增结果Fig.6 Result of PCR amplification of Dm86 gene of D.marginatus
2.6 重组质粒的双酶切验证
研究表明,重组质粒经过XhoI和EcoRI双酶切,产物经1%琼脂糖凝胶电泳,出现2条特异性条带分别约为4 954和345 bp,与预期片段大小一致,送往上海生工生物工程股份有限公司进行测序。目的基因Dm86插入到表达载体pEGX-4T-1中。图7

图7 Dm86重组质粒酶切验证Fig.7 Dm86 recombinant plasmid enzyme digestion validation
2.7 重组蛋白表达及纯化
研究表明,纯化浓缩蛋白,浓度为2.0 mg/mL。在39 kDa处出现条带,与预期大小一致。图8

图8 重组蛋白SDS-PAGEFig.8 SDS-PAGE of protein
2.8 多克隆抗体的制备和Western blotting分析
研究表明,多克隆抗体能够识别重组蛋白,在39 kDa有明显特异性条带,阴性血清无特异性条带。图9

图9 蛋白多克隆抗体的Westernblotting分析Fig.9 Western blotting analysis of polyclonal antibody against Dm86 protein
3 讨论
3.1Bm86是迄今为止候选蜱抗原中最有效的基因,主要降低吸血蜱的数量、重量、产卵和蜕皮能力,减少蜱的数量和蜱媒病原体的流行[12]。通过实验室所有的新疆优势种边缘革蜱转录组数据,参照GenBank中变异革蜱Dr86的序列(GB144601.1)克隆Dm86基因。克隆序列BLAST比对并构建系统发育树显示,Dm86与Dr86相似度为89.29%并聚为一支,证明边缘革蜱体内存在Dm86基因。
3.2 对Dm86编码的蛋白进行生物信息学预测,Dm86蛋白属于酸性、不稳定的亲水性蛋白,存在信号肽和5个N端糖基化位点,这与新疆微小牛蜱Bm86的部分理化特性相似[13]。抗原表位是抗原分子中决定抗原特异性的特殊化学集团,找到抗原表位就可能找到针对该抗原的抗体或疫苗[7]。Dm86蛋白无规则卷曲所占比例较高、亲水性较强及多个抗原表位的预测结果,均提示该蛋白抗原性较强[14-16]。蛋白序列在522~564个氨基酸是无规则卷曲、抗原性最强且连续抗原表位最多的区域,为获得免疫原性较强的蛋白,截取此区域在大肠杆菌中以重组蛋白的形式表达。
3.3 “隐蔽抗原”在自然感染条件下,不与宿主接触引起免疫反应的一类抗原[17]。Willadsen等[5]研究表明,Bm86是位于中肠的“隐蔽抗原”,不同于其他种类的抗原,牛自然感染微小牛蜱时不会与Bm86接触并产生抗体。试验通过人工感染融合蛋白制备多克隆抗体,产生的抗体效价较高,并通过Western blotting验证融合蛋白具有免疫原型,重组蛋白可以作为抗蜱疫苗的候选抗原。
3.4Dm86基因在边缘革蜱各发育阶段的相对表达量存在差异,与微小牛蜱Bm86表达情况不同[19]。微小扇头蜱为典型的一宿主蜱,在宿主体表连续吸血,3周左右即可完成整个吸血期[20],而边缘革蜱需要1~2年的时间完成生长,在幼蜱、若蜱和成蜱3个阶段饱血后均会离开宿主,进行能量消耗和蜕皮生长,可能造成发育各周期的表达量不同。对于Bm86蛋白的功能和特定的细胞类型定位研究成果较少,边缘革蜱的幼蜱、若蜱和成蜱阶段吸血造成中肠肠腔扩大[21],饱血后的Dm86基因表达量较饱血前的高,可能与中肠细胞在吸血时期的生长和消化有关[22]。在饥饿雌蜱吸血期间,基因相对表达量下降后一直在一个相对较低的水平,可能中肠在吸收血液时消化细胞的不断倍消耗和未分化细胞不断取代等血液消化过程有关[21]。Dm86基因作为保护性抗原在各发育阶段,均有可能发挥作用,但其真正的保护效果,还需要进一步的研究验证荧光定量PCR的推测结果。
4 结论
PCR扩增获得了1 773 bp目的片段,Dm86蛋白由591个氨基酸组成,分子量为64 857.81,理论等电点为6.78,酸性,具有不稳定性、亲水性和多个B细胞抗原表位;Dm86基因在边缘革蜱不同阶段均有不同程度的表达,饱血蜱阶段的表达量较高;重组蛋白大小为39kDa,以包涵体形式表达;抗体效价可达1:25 600,能够识别重组蛋白。Dm86重组蛋白具有一定的反应原性和免疫原性。
