牛源无乳链球菌耐药性与毒力基因的表达量差异分析
2022-02-21赵艳坤杜晓慧王富兰
范 雪,邵 伟,赵艳坤,杜晓慧,陈 贺,王富兰,王 帅
(1.新疆农业大学动物科学学院/新疆肉乳用草食动物营养实验室,乌鲁木齐 830052;2.新疆农业科学院农业质量标准与检测技术研究所/农业农村部农产品质量安全风险评估实验室/新疆农产品质量安全实验室,乌鲁木齐 830091)
0 引言
【研究意义】奶牛养殖环境、牛体本身以及致病菌之间的相互作用是导致奶牛乳房炎的主要致病菌,引起奶牛乳房炎的原因有很多,挤奶时工人手上携带的细菌以及卧床垫料等都可能引起奶牛乳房炎。无乳链球菌是一类人畜共患性病原菌,作为奶牛乳房炎的主要致病菌,能引起奶牛急性慢性的乳房炎,造成奶牛乳区出血等症状。【前人研究进展】无乳链球菌是一类条件性致病菌,致病性广泛,可通过体表创伤以及口腔等途径感染动物机体[1]。无乳链球菌在侵入动物机体后,可逃避宿主细胞的吞噬作用而大量繁殖,从而造成动物机体发病。无乳链球菌的致病性因毒力因子在表达上的不同而表现出差异性。无乳链球菌可凭借自身的毒力和致病性来侵袭寄主的组织,并在组织中生长繁殖。无乳链球菌的毒力因子主要有β-溶血素、CAMP因子、荚膜多糖等致病因子。【本研究切入点】无乳链球菌是引起奶牛乳房炎的主要致病菌之一。近年来,由于生产生活中对奶牛乳房炎的治疗致使无乳链球菌产生了一定的耐药性及多重耐药现象。目前无乳链球菌对抗菌药物的耐药性及多重耐药情况日较严重。【拟解决的关键问题】对检测无乳链球菌中的一些耐药基因及毒力基因,并且对不同无乳链球菌菌株的毒力基因的表达量进行差异分析,为无乳链球菌引起的奶牛乳房炎筛选出合适的抗菌药物提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株
菌株除质控菌株为购买的编号为ATCC12386,其他均由前期对患奶牛乳房炎牛乳中经过培养、生化鉴定及16SrDNA比对分离鉴定所得,菌株由新疆农业科学院农业质量标准与检测技术研究所保存。
1.1.2 主要试剂
16种抗菌药物药敏板购买自天津市金章科技发展有限公司,试验所需哥伦比亚血平板均购自泰州木凡生物科技有限公司,胰蛋白胨大豆肉汤购自北京陆桥技术有限责任公司。DNA Maker DL2000及2×PowerTapPCR MasterMix均为百泰克生物技术股份有限公司产品。细菌基因组提取试剂盒为天根公司产品。
1.2 方法
1.2.1 药物敏感性检测
所用无乳链球菌菌株在哥伦比亚血平板上培养18~24 h复苏纯化,后在胰蛋白胨大豆肉汤进行增菌,采用微量肉汤稀释培养的方法进行药敏试验。
1.2.2 毒力基因与耐药基因的PCR检测
所采用的毒力基因引物参照[2-3]的方法进行设计,耐药基因参照[4-6]的方法设计,引物均有北京鼎峰生物技术股份有限公司合成。反应体系为30µL:2×PowerTapPCR MasterMix 15 uL,上下游引物各1µL,DNA模板2µL,ddH2O补齐至30µL。表1

表1 无乳链球菌毒力基因与耐药基因引物序列Table 1 Primer sequence of virulence gene and drug resistance gene of Streptococcusagalactiae
1.2.3 无乳链球菌8种毒力基因的荧光定量检测
细菌RNA提取先用20 mg/mL的溶菌酶处理,后用Trizol法进行RNA提取。反应体系为20µL:2×One Step SYBR Green Mix 10µL,One Step SYBR Green Enzyme Mix 1µL,上下游引物各0.4µL,50×ROX reference Dye 1 0.4µL,模板DNA1µL,无RNA酶的ddH2O补至20µL。反应体系为逆转录(50℃,3 min),预变性(95℃,30 s),循环反应(95℃,10 s;60℃,30 s)×30,溶解曲线(95℃15 s;60℃1 min;95℃15 s)。表2

表2 无乳链球菌毒力基因荧光定量引物序列Table 2 Sequence of fluorescent quantitative primers for virulence gene of Streptococcus agalactiae
1.3 数据处理
使用EXCEL对数据进行初步整理,之后利用SPSS统计软件(22.0)对无乳链球菌毒力基因的表达量进行单因素方差分析,并进行Duncan多重比较,P<0.05视为差异显著。利用EXCEL绘制药敏试验柱状图、GraphPad Prism软件(7.0)绘制基因表达量图。
2 结果与分析
2.1 无乳链球菌抗菌药物敏感性检测
研究表明,牛源无乳链球菌对青霉素、阿莫西林/克拉维酸、苯唑西林、头孢噻吩、头孢噻呋、庆大霉素、氟苯尼考、利福昔明、万古霉素、环丙沙星、复方新诺明这11种药物的敏感性达到了65%以上,其中敏感性最高的是氟苯尼考(92.4.%)和头孢噻呋(88.4%);无乳链球菌菌株对这16种药物均存在不同程度的耐药,无乳链球菌对氨苄西林、红霉素、克林霉素的耐药率均达到了50%以上,对磺胺异恶唑的耐药率也达到了45%以上。图1

图1 牛源无乳链球菌耐药性检测结果Fig.1 Testing results of drug resistanceof Streptococcusagalactiae from cattle
多重耐药情况多为2耐和4耐,多重耐药率分别为23.1%和15.4%,多重耐药最严重的是对这16种抗菌药物均耐药。奶牛乳房炎无乳链球菌均有多种耐药情况,并且根据场间用药不同,地区不同而有所差异。图2

图2 牛源无乳链球菌多重耐药检测结果Fig.2 Testing results of multi-drug resistance of Streptococcusagalactiae from cattle
2.2 无乳链球菌耐药基因与毒力基因的检测
研究表明,无乳链球菌对红霉素、克林霉素及多西环素,氨苄西林这是4种抗菌药物产生耐药,并产生了多重耐药现象,多集中于对2~5种药物耐药,甚至达到了对16种药物都耐药。sul1和gyrA的检出率为100%,ermB检出率为93.3%,ermC的检出率为33.3%;而ermA、sul2、sul3及parC这4种耐药基因未检出。pavA、cfb、fbsA、bibA、cspA、sip、iagA、hylB的检出率为100%,rib检出率为13.3%,bca的检出率为53.3%,cylE检出率为73.3%;而bac、lmb、scpB这3种毒力基因未检出。图3,图4

图3 无乳链球菌毒力基因的凝胶电泳Fig.3 Gel electrophoresis of virulence gene of Streptococcusagalactiae

图4 无乳链球菌耐药基因的凝胶电泳Fig.4 Gel electrophoresis of drug resistance genes of Streptococcus agalactiae
2.3 无乳链球菌毒力基因的表达量差异
研究表明,野生菌株HLJ044和NM-038-2显著高于质控菌株ATCC12386(P<0.05);在cspA基因中,NM-038-2的表达量显著高于其它2株菌,HLJ044的表达量显著高于质控菌株ATCC12386(P<0.05);在sip基因的表达量检测结果中,HLJ044的表达量显著高于其他2株菌,质控菌株ATCC12386又显著高于NM-038-2(P<0.05);对于iagA基因,NM-038-2菌株的表达量显著高于其他2株菌(P<0.05);对于pavA基因和hylB基因,NM-038-2菌株的表达量显著高于其他2株菌(P<0.05);NM-038-2的表达量显著高于其他2株菌,而ATCC12386菌株的表达量又显著高于HLJ044菌株(P<0.05);在bibA基因的表达量检测图中,NM-038-2显著高于其他两株菌,HLJ044菌株的表达量又高于质控菌株ATCC12386(P<0.05)。图5
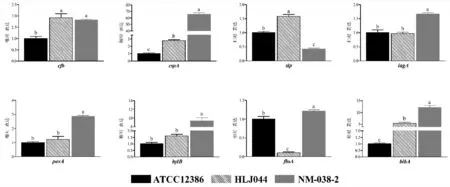
图5 无乳链球菌不同菌株毒力基因的表达量Fig.5 Testing results of virulence genes expressions in different strains of Streptococcusagalactiae
3 讨论
3.1 无乳链球菌耐药性
抗菌药物的用量与细菌耐药性的形成存在着一定的关系,除了细菌自身耐药性的变迁和药物自身的特点之外,还可能与药物种类、数量和药物的用量相关[7-8]。大环内酯类药物为抑菌剂,而β-内酰胺类为杀菌剂,可以先使用大环内酯类抗菌药物抑制细菌的生物被膜的形成,采用β-内酰胺类药物采用自身对细菌的杀菌效果,把细菌铲除,达到相辅相成的效果[9]。
无乳链球菌常常定植于奶牛的乳腺中,虽然无乳链球菌的致病性不强,但其对奶牛乳腺组织造成伤害并使奶牛机体的免疫功能失衡。研究结果显示,无乳链球菌对红霉素、克林霉素,磺胺异恶唑及四环素耐药,与多个文献对于无乳链球菌的药敏结果趋于一致[10-13]。可能与对于无乳链球菌引起的病症采用同类药物所造成有关。对于青霉素、阿莫西林/克拉维酸、苯唑西林、头孢噻吩等11种抗菌药物的敏感性较高,此结果与邓颖颖[14]的研究结果一致,但与刘婵[15]、祝宇[5]等分离出的无乳链球菌对不同抗菌药物表现出不同的耐药性的结果有所不同,尤其是对青霉素、红霉素等药物的耐药的结果不一致,可能是因为地区或菌株来源不同所采用的治疗药物也有所不同而导致。
3.2 无乳链球菌毒力基因与耐药基因检测
鞭毛、菌毛,生化因子等等都可以作为调节细菌的物理属性[16-18]。pavA、cfb、fbsA、bibA、cspA、sip、iagA、hylB毒力基因的检出率为100%,此研究结果与前人研究一致[19-20];而对于rib检出率为13.3%,bca的检出率为53.3%,cylE检出率为73.3%,3种毒力基因的检出率均有所出入。而对于bac、lmb、scpB这3种毒力基因未检出,这与Carvalho-Castro[21]等在巴西分离的菌株未检出bac基因相符,与Duarte等[22]的检出率为7.3%的结果有所不同,可能是由于无乳链球菌的来源不同而导致。
研究共检测到了4种耐药基因。与药敏试验结果基本相符合,并且试验无乳链球菌菌株产生了同时携带4种耐药基因的菌株。结果发现,对于氟喹诺酮类耐药基因gyrA的检出率为100%,而parC的检出率为0%,与王爱媛[19]的研究结果不同,对于无乳链球菌携带ermB基因的检测结果来看,与路璐等的研究结果有所差异,可能是由于各地对于细菌引起的奶牛乳房炎的用药不同所导致。
3.3 无乳链球菌毒力基因的表达量差异
粘附与定植相关的纤维蛋白原结合蛋白,黏连蛋白,细菌免疫原性黏附素基因等等,与侵袭相关的β溶血素,CAMP因子,透明质酸盐裂解酶等,与免疫逃避相关的荚膜合成及细胞壁相关因子,表面免疫原性蛋白,超氧化物歧化酶等等。苏友禄等[23]的研究,结果显示,蛋白缺失导致弱毒株的毒力变强,而强毒株的毒力明显减弱,并且缺失蛋白菌株的毒力基因(sodA、cspD及cspG)在弱强菌株中的表达呈现出相反模式,但cspA和pavA基因的表达未受影响。Wang[24]的研究结果显示,缺失hylB基因会导致可能导致无乳链球菌的存活能力降低,对宿主的毒力明显减弱。
4 结论
无乳链球菌对红霉素和克林霉素的耐药率较高,在实际生产过程中,场内在用药前先做诊断,采用合适的抗菌药物防止奶牛乳房炎。大多数毒力基因都有不同程度的检出,但对于普通PCR和荧光定量PCR检测较高的pavA、cfb、fbsA、bibA、cspA、sip、iagA、hylB这8个基因对无乳链球菌的致病性起着重要的作用。
